作者简介: 黄 斌, 1996年生,武汉工程大学光学信息与模式识别湖北省重点实验室硕士研究生 e-mail: 291887894@qq.com
还原态烟酰胺腺嘌呤二核苷酸(NADH)在维持细胞生长、 分化、 能量代谢以及细胞保护方面起着非常重要的作用, NADH的无创在体检测具有非常重要的意义。 运用激光拉曼散射实验和密度泛函理论(DFT)计算研究了200~3 300 cm-1光谱范围内NADH分子的振动模式特性。 DFT计算采用了B3LYP杂化方法, 并选用了极化6-311+G(d,p)基组。 为了准确的分析NADH分子的振动模式和频率, 首先运用B3LYP/6-311+G(d,p)理论对NADH分子的基态结构进行了几何优化, 并计算了基态结构NADH分子的各个键长和键角。 同时考虑到DFT计算中的非谐性, 运用波数线性标度方法对所有计算所得振动模式波数重新进行了标度。 重新标度后, DFT计算所得的振动模式波数与激光拉曼散射实验观测到的拉曼峰波数吻合的很好: 在200~3 300 cm-1整个光谱范围内, 计算与实验结果具有非常好的线性相关性, 而且大部分振动模式的计算与实验之间的偏差都小于5 cm-1。 此外, 讨论了实验观察所得拉曼光谱的分子振动模式归属, 分析了NADH分子中腺嘌呤、 烟酰胺、 及二核苷酸的特征振动模式, 并初步提出了运用拉曼光谱实现NADH快速准确无创在体检测的方法。 位于732 cm-1处的拉曼峰是腺嘌呤的特征振动模式, 而且可以选为检测NADH分子的最特征拉曼峰。 位于1 690 cm-1处的拉曼峰是烟酰胺的特征振动模式, 可以选为进一步准确检测NADH分子的另一个特征拉曼峰。 位于1 086和1 339 cm-1两处拉曼峰的组合可以作为二核苷酸的特征振动模式, 用于进一步更准确的检测NADH分子。 所以在运用拉曼光谱法实现NADH快速准确无创在体检测时, 可以首先运用位于732 cm-1处NADH分子的最特征振动模式进行快速检测, 然后再运用位于1 690 cm-1及1 086和1 339 cm-1组合等特征振动模式进行准确分析。
Reduced nicotinamide adenine dinucleotide (NADH) plays a crucial role in many biochemical reactions in human metabolism. Noninvasive and in vivo monitoring of the NADH level in skin tissue is of great interest. In this paper, the Raman scattering experiment and density functional theory (DFT) calculation have been applied to investigate the vibrational properties of NADH in the spectral range of 200~3 300 cm-1. The DFT calculation was performed with hybrid exchange functional using B3LYP functions with a polarized 6-311+G(d,p) basis. To achieve accurate analytical vibrational frequency calculation, the ground-state geometry of NADH molecule was first optimized at B3LYP/6-311+G(d,p) level of theory without any symmetry restrain, and the bond lengths and bond angles of NADH molecule were calculated. Then, the calculated wavenumbers were normally scaled with a necessary wavenumber linear scaling procedure by accounting for anharmonicity in DFT calculation. The DFT calculated spectrum of NADH is in good agreement with the Raman experimental spectrum: a good linear correlation between calculated and experimental wavenumbers has been obtained in the spectral range of 200~3 300 cm-1, and the deviations are smaller than 5 cm-1. In addition, the characteristic vibrational modes of the three parts adenine, nicotinamide, and dinucleotide of NADH molecule have been assigned and discussed, which would be helpful for the noninvasive and in vivo analyses of NADH. The characteristic mode of adenine at 732 cm-1 can be chosen as the most representative model for analyzing NADH. The characteristic mode of nicotinamide at 1 690 cm-1 can be chosen as another representative mode for further analyzing NADH. The characteristic modes of dinucleotide at 1 086 and 1 339 cm-1 can be chosen as a combination for further more accurately analyzing NADH. Therefore, when applying the Raman method for noninvasive and in vivo monitoring of the NADH level in skin tissue, first, the most representative mode at 732 cm-1 can be used for quick analyses, then the mode at 1 690 cm-1 and/or the combination modes of 1 086 and 1 339 cm-1 can be used for further accurate analyses.
NADH (reduced nicotinamide adenine dinucleotide)是烟酰胺腺嘌呤二核苷酸的还原态, N指烟酰胺, A指腺嘌呤, D是二核苷酸。 NADH在维持细胞生长、 分化和能量代谢以及细胞保护等各方面起着重要的作用, 可以降低因辐射、 药物、 有毒物质、 剧烈运动、 缺血等各种因素引起的细胞的氧化应激, 从而保护血管内皮细胞、 肝细胞、 心肌细胞、 成纤维细胞、 神经元等[1, 2, 3]。 因此分析检测人体内NADH水平具有非常重要的意义[4]。
拉曼光谱作为一种分子指纹分析技术, 具有快速、 准确、 无损等优点, 而且可获得物质物理化学及深层结构信息, 已广泛应用于生物医学、 物理、 化学、 材料、 食品科学等领域[5, 6]。 密度泛函理论(DFT)是一种研究多电子体系结构的量子力学方法, 在研究物质光谱方面得到了广泛应用[7, 8]。 近年来, NADH无创在体检测得到了越来越多关注[9, 10]。 运用激光拉曼光谱方法非常有希望实现NADH的快速准确无创在体检测。 但目前对NADH拉曼光谱的研究较为缺乏。 本文运用激光拉曼散射实验和DFT计算研究了200~3 300 cm-1光谱范围内NADH分子的振动模式特性, 讨论了实验观察所得NADH拉曼光谱的分子振动模式归属, 并分析了NADH分子中腺嘌呤、 烟酰胺、 及二核苷酸的特征振动模式。
实验所用NADH样品从阿拉丁生化科技有限公司购买。 拉曼散射实验采用赛默飞世尔科技有限公司的激光共焦显微拉曼光谱仪, 本实验采用了532和785 nm两种不同波长的激光进行测量, 实验条件相同, 光谱采集波数范围为200~3 200 cm-1, 积分时间为10 s, 积分次数为6次, 激光功率为2 mW。
DFT计算采用常用的Becke交换泛函方法, 同时结合Becke的三参数混合交换泛函并使用了Lee, Yang和Parr(B3LYP)的LYP相关泛函[11]。 在几何优化和解析振动频率计算中, 采用了极化6-311+G(d, p)基组。 量子力学计算使用了Gaussian09程序[12]。 计算数据分析和拉曼光谱绘制采用了Multiwfn_3.4.1(dev)程序[13], 每个拉曼峰的线型选用洛伦兹曲线, 峰半高宽选用4 cm-1。
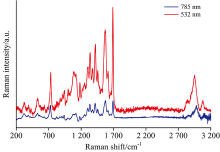
图1显示了在200~3 200 cm-1光谱范围内NADH在532和785 nm两个不同波长激光激发下的拉曼光谱。 NADH分子有两个主要吸收峰, 分别约为340和260 nm[9]。 拉曼散射所用激光波长远离NADH吸收峰。 在非共振条件下, 拉曼散射强度与激发光波长四次方成反比, 因此532 nm比785 nm更容易观察到NADH振动模式。 图1中可清楚地观测到24个振动模式。 NADH分子式为C21H29N7O14P2, 分子结构如图2所示, 可分为烟酰胺、 腺嘌呤、 及二核苷酸三个部分, 分别用N-蓝色、 A-红色及D-黑色表示。 由于NADH分子包含很多个原子且分子结构复杂, 确定图1中24个拉曼峰的分子振动模式并找到NADH分子的特征拉曼峰对未来运用拉曼光谱方法实现NADH的无创在体检测具有非常重要的意义。 本文运用DFT计算分析了图1中24个拉曼峰的分子振动模式, 并讨论了NADH分子中腺嘌呤、 烟酰胺、 及二核苷酸的特征振动模式。
为了准确地分析NADH的分子振动模式和频率, DFT计算中首先运用B3LYP/6-311+G(d, p)理论对NADH分子的基态结构进行了几何优化。 优化后的几何结构为势能表面的最低点, 计算结果没有产生虚频。
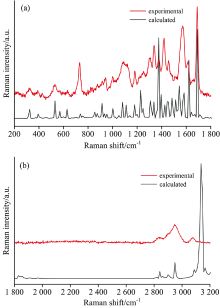
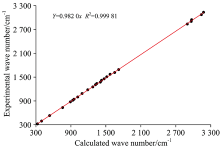
为了使DFT计算结果与拉曼散射实验结果很好的吻合, 即计算所得振动模式波数与实验观测拉曼峰波数差别小而且有很好线性相关性, 运用波数线性标度方法对所有计算所得振动模式波数重新进行了标度。 波数线性标度方法中, 考虑到DFT计算中非谐性, 计算所得波数应乘以一个略小于1的比例因子, 通常不同光谱范围内比例因子会有小的差别。 本文发现NADH分子在200~3 300 cm-1范围内计算所得波数都可以用同一比例因子0.982 0很好的标度。 该比例因子也和文献常用比例因子0.961 3很接近[14]。 重新标度后, 计算所得振动模式波数与实验观测拉曼峰波数都吻合的很好, 差别大部分小于5 cm-1, 仅峰强存在一定差异。 图3(a)和(b)分别比较了200~1 800和1 800~3 300 cm-1光谱范围内拉曼实验和DFT计算的结果。 图4具体的比较了拉曼实验观测到的24个拉曼峰与DFT计算所得振动波数的关系。 如图4所示, 在200~3 300 cm-1整个光谱范围内拉曼实验和DFT计算结果之间都具有很好的线性相关性, R2为0.999 81。
表1详细对比了拉曼散射实验、 DFT计算、 及文献中NADH分子的拉曼峰, 并对图1中所观测到的24个拉曼峰所代表的振动模式对应的分子基团做了归属。 为了便于分析, 同时找到NADH分子的特征振动模式, 从而用于拉曼光谱法实现NADH的快速准确无创在体检测; NADH分子分为了三个部分, 即腺嘌呤、 烟酰胺和二核苷酸, 分别标记为A、 N和D, 如图2所示。 根据NADH分子的三个部分, 图1中所观测到的24个拉曼峰被分为了三组。 NADH分子中三个部分的振动频率与实际三个基团独立存在时的振动频率存在一些差异, 这些差异是由于每个基团之间的相互作用造成了峰的偏移。
| 表1 实验观察和理论计算的NADH拉曼峰及它们的振动模式 Table 1 Experimental and calculated Raman modes of NADH and vibrational assignment |
NADH分子中腺嘌呤(A)是一个含氮杂环, 其中包含多个碳氮双键及一个氨基。 图1中位于531, 732, 1 309, 1 339, 1 374, 1 507及3 073 cm-1等处的拉曼峰与腺嘌呤的振动模式相关。 其中位于732 cm-1处的拉曼峰散射信号强度强, 而且该峰在高频和低频方向受其他拉曼峰的干扰都较小。 同时该峰不仅与腺嘌呤分子呼吸振动相关, 还与腺嘌呤和二核苷酸的相互作用相关。 因而位于732 cm-1处的拉曼峰可以选为NADH分子的一个最特征的振动模式, 用来实现拉曼光谱法的NADH快速准确无创在体检测。
NADH分子中烟酰胺(N)包含一个酰胺及一个吡啶, 存在一个含氮六元环以及一个碳氧双键。 图1中位于390, 943, 999, 1 086, 1 181, 1 252, 1 615和1 690 cm-1等处的拉曼峰与烟酰胺的振动模式相关。 其中位于1 690 cm-1处的拉曼峰散射信号强度最强, 而且该峰在高频方向没有其他拉曼峰的干扰, 同时该峰与吡啶中特征的C=C双键的振动相关, 且是整个NADH分子中强度最强的拉曼峰。 因而位于1 690 cm-1处的拉曼峰可以选为NADH分子的另一个特征振动模式, 用来实现拉曼光谱法的NADH快速准确无创在体检测。
NADH分子中二核苷酸(D)包含两个核苷酸, 其中有两个五碳糖和两个磷酸分子。 图1中位于324, 876, 916, 1 086, 1 339, 1 457和3 073 cm-1等处的拉曼峰与二核苷酸的振动模式相关。 其中位于1 086和1 339 cm-1两处的拉曼峰散射信号强度强, 1 086 cm-1处的拉曼峰与二核苷酸中磷酸分子的振动相关, 1 339 cm-1处的拉曼峰与二核苷酸基团和腺嘌呤基团的相互作用相关。 这两个拉曼峰在高频和低频方向都受到其他拉曼峰的干扰, 为了更准确的实现拉曼光谱法的NADH无创在体检测, 可以将1 086和1 339 cm-1两处的拉曼峰作为一个组合特征振动模式。
运用拉曼光谱法检测某种物质时, 仅采用该物质的某一个特征的拉曼振动模式很难实现准确分析。 为了运用拉曼光谱法实现NADH快速准确无创在体检测, 可以首先运用位于732 cm-1处NADH分子的最特征振动模式进行快速检测, 然后再运用位于1 690 cm-1及1 086和1 339 cm-1的组合等特征振动模式进行准确的分析。
研究了还原态烟酰胺腺嘌呤二核苷酸的激光拉曼散射实验光谱和DFT理论计算光谱, 对200~3 300 cm-1光谱范围内的拉曼峰所对应的振动模式进行了初步的归属。 实验与计算结果符合得很好: 大部分振动模式计算与实验之间偏差都小于5 cm-1, 而且在200~3 300 cm-1整个光谱范围内, 计算与实验结果都有非常好的线性相关性, R2为0.999 81。 同时本文分析了NADH分子中腺嘌呤、 烟酰胺、 及二核苷酸的特征振动模式, 为未来运用激光拉曼光谱方法实现NADH的无创在体检测提供了基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|