作者简介: 王 军, 1978年生, 许昌学院食品与药学院讲师 e-mail: wangjun780301@126.com
采用荧光光谱法、 同步荧光光谱法、 三维荧光光谱法、 紫外光谱法以及分子对接法研究了柠檬黄与牛血清白蛋白(BSA)的相互作用。 柠檬黄与BSA相互作用的荧光光谱分析表明柠檬黄能有效猝灭BSA的内源荧光, 根据Stern-Volmer方程计算得到柠檬黄对BSA的荧光猝灭常数 KSV随着温度的升高而逐渐降低, 表明柠檬黄对BSA的荧光猝灭过程属于静态猝灭; 通过静态猝灭双对数公式计算结合常数 KA为4.335×107 L·mol-1(293 K), 结合位点数 n约为1, 说明柠檬黄与BSA有很强的结合能力, 且形成了一个结合位点; 根据Van’t Hoff方程确定柠檬黄与BSA结合过程中的热力学参数Δ H=-154.5 kJ·mol-1, Δ S=-387.8 J·mol-1·K-1, Δ G<0, 两者之间的作用力主要为氢键和范德华力, 且该结合过程是自发进行的; 根据Förster非辐射能量转移理论计算得到结合距离 r为3.310 nm, 说明柠檬黄与BSA相互作用过程中发生了非辐射能量转移; 同步荧光光谱分析表明, 随着柠檬黄浓度的增加, Tyr残基和Trp残基的荧光强度都逐渐降低, 表明Tyr残基和Trp残基均参与了柠檬黄与BSA的作用过程; 三维荧光光谱分析表明柠檬黄的加入引起peak 1和peak 2的峰强度显著降低, 同时peak 2的发射波长发生了变化, 表明BSA的肽链结构发生了改变; 随着柠檬黄浓度的增加, BSA的紫外吸收峰峰值逐渐增大; 光谱分析结果表明柠檬黄与BSA的结合使BSA的构象发生改变, 从而改变Trp残基和Tyr残基周围微环境, 导致其发光效率降低; 分子对接表明柠檬黄结合在BSA的Ⅲb亚域, 柠檬黄周围的氨基酸残基主要包括: Phe506, Thr507, Ala527, Leu528, Met547, Gly571, Pro572, Leu574, Val575, Thr578。 柠檬黄与BSA间主要通过范德华力与极性不带电荷的Thr507, Thr578残基作用。 苯环磺酸基O与Thr507残基侧链—OH的H形成氢键。 柠檬黄周围也存在非极性氨基酸残基, 因此, 疏水作用也可能是柠檬黄与BSA间非共价作用方式之一。 该研究有助于了解柠檬黄与BSA的作用机制, 为揭示柠檬黄在生物体内的分布、 代谢及毒理作用机制等提供参考。
The interaction between tartrazine and bovine serum albumin (BSA) was investigated by fluorescence spectrometry, synchronous fluorescence spectrometry, three-dimensional fluorescence spectrometry, ultraviolet spectrometry and molecular docking. The analysis of fluorescence spectrum of tartrazine-BSA showed that tartrazine could effectively quench the endogenous fluorescence of BSA, and the fluorescence quenching constant KSV decreased with the increase of temperature, so the quenching mechanism was static quenching on the basis of stern-volmer equation; According to the static quenching double logarithm formula, the binding constant ( KA) was calculated to be 4.335×107 L·mol-1 (293 K) and the number of binding point ( n) was approximately equal to 1, which indicated that tartrazine had a strong binding ability with BSA and formed a binding site; The thermodynamic parameters obtained by van’t Hoff’s law (Δ H=-154.5 kJ·mol-1, Δ S=-387.8 J·mol-1·K-1, Δ G<0) revealed that the main forces between tartrazine and BSA were hydrogen bond and van der Waals force, and the binding process was spontaneous; The binding distance ( r) between tartrazine and BSA was calculated to be 3.310 nm based on the theory of Förster’s non-radiation energy transfer, which indicated that energy was likely to be transfered from BSA to tartrazine; With the increase of the concentration of tartrazine, the synchronous fluorescence intensity of Tyr and Trp residues decreased; The three-dimensional fluorescence spectra analysis showed that the intensities of peak 1 and peak 2 decreased significantly with the addition of tartrazine, and the emission wavelength of peak 2 changed, indicating that the peptide chain structure of BSA changed, and at the same time, the UV absorption peak of BSA increased gradually; The results of spectral analysis showed that the combination of tartrazine and BSA changed the conformation of BSA, thus changed the microenvironment around Trp and Tyr residues, resulting in the decrease of luminous efficiency; The results of molecular docking further illustrated that tartrazine was interacted with amino acid residues on subdomain Ⅲb of BSA and the amino acid residues around tartrazine mainly included: Phe506, Thr507, Ala527, Leu528, Met547, Gly571, Pro572, Leu574, Val575, Thr578; Tartrazine could interact with Thr507 and Thr578 residues by van der Waals force, with Thr507 by hydrogen bond and with other nonpolar amino acid residues by hydrophobic force. This research was helpful to understand the mechanism of interaction between tartrazine and BSA and reveal the distribution, metabolism and toxicological mechanism of tartrazine in vivo.
柠檬黄(tartrazine), 又称酒石黄、 肼黄, 为人工合成色素。 柠檬黄呈鲜艳的嫩黄色, 可用于饮料、 糖果、 果冻等食品, 但其安全性一直备受争议[1]。
血清白蛋白是生物体内重要的载体蛋白, 能与小分子化合物结合, 起到储存的作用[2]。 牛血清白蛋白(BSA)与人血清白蛋白(HSA)具有高度的同源性, 常用BSA来研究血清白蛋白与小分子的相互作用。
荧光光谱技术是研究溶液中蛋白质分子构象的一种有效方法, 也是研究蛋白质与各种小分子相互作用的重要手段[3]。 随着计算机模拟技术的快速发展, 分子对接技术已经成为研究蛋白质与小分子相互作用的有效手段[4]。 近年来, 光谱技术和分子对接已被广泛用于研究蛋白质与小分子的相互作用机理。 有报道采用荧光光谱、 紫外光谱、 圆二色谱、 红外光谱以及分子对接技术研究了盐酸四环素与牛血清白蛋白的相互作用, 该研究可以从分子水平上了解盐酸四环素分子在体内的传输与分布, 为盐酸四环素的广泛应用提供参考。 本实验采用荧光光谱、 紫外光谱以及分子对接技术, 研究柠檬黄与BSA之间的相互作用, 以揭示柠檬黄在生物体内的分布、 代谢及毒理作用机制等。
荧光光谱仪(F4600, 日本日立公司); 紫外-可见光谱仪(Cary5000, 美国安捷伦公司)。
柠檬黄(tartrazine), 质量分数98%, 上海源叶生物科技有限公司, 用超纯水配制成浓度为1× 10-6 mol· L-1的溶液; 牛血清白蛋白(bovine serum albumin, BSA), 质量分数98%, 上海源叶生物科技有限公司, 用超纯水配制成浓度为5× 10-6 mol· L-1的溶液。
1.2.1 荧光光谱及同步荧光光谱分析
移取配制好的柠檬黄溶液0, 1, 2, 3, 4, 5 mL于10 mL比色管中, 每支比色管中各加入1 mL BSA溶液, 超纯水定容, 水浴10 min, 温度为293, 300, 307和314 K。 参数设置为: 激发波长280 nm, 发射波长290~450 nm, 狭缝宽度均为5.0 nm, 扫描速度1 200 nm· min-1。 同步荧光光谱扫描中, 激发波长200~350 nm, Δ λ =15 nm和Δ λ =60 nm, 温度为307 K。
1.2.2 三维荧光光谱分析
分别移取1 mL BSA溶液于2支10 mL比色管中, 其中1支比色管加入柠檬黄溶液5 mL, 超纯水定容。 参数设置为: 激发波长200~300 nm, 间隔5 nm, 发射波长250~450 nm, 间隔2 nm, 狭缝宽度均为5.0 nm, 扫描速度为12 000 nm· min-1, 温度为307 K。
1.2.3 紫外光谱分析
样品准备同荧光光谱分析, 温度为307 K, 扫描波长为190~400 nm, 用超纯水做参比。
1.2.4 结合距离的测定
分别移取1 mL BSA溶液于2支10 mL比色管中, 其中1支比色管加入柠檬黄溶液5 mL, 超纯水定容。 另取1支比色管加入柠檬黄溶液5 mL, 超纯水定容。 对柠檬黄溶液进行紫外光谱分析, 对BSA溶液和BSA-柠檬黄混合溶液进行荧光光谱分析, 参数设置同前。
1.2.5 分子对接
BSA的晶体结构取自蛋白质数据库RCSB Protein Data Bank(蛋白质编码: 4f5s)。 由ChemBio3D Pro 14.0软件画出色素的分子结构图, 利用ZDOCK 3.0.2软件进行分子对接, 利用PyMOL 2.2.0软件对分子对接结果进行分析。
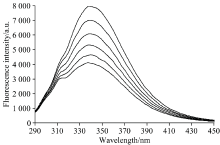
BSA中含有Phe, Tyr和Trp, 这些残基的存在使得BSA具有较强的内源荧光[5]。 柠檬黄与BSA相互作用的荧光光谱图见图1(293 K)。 由图1可知, BSA在激发波长为280 nm时, 在发射波长338 nm处产生最大荧光发射峰。 在不同温度下, 增大柠檬黄的浓度, BSA的荧光强度逐渐降低, 荧光峰的位置基本不变。 荧光猝灭有两种类型: 静态猝灭和动态猝灭。 可采用Stern-Volmer[6]方程确定柠檬黄对BSA的猝灭作用机制
式(1)中, F0, F, Kq, τ 0, KSV的物理意义见文献[7], [Q]为柠檬黄的浓度。 以F0/F对[Q]作图, 得到不同温度下柠檬黄对BSA的Stern-Volmer方程曲线图(见图2), 所得直线斜率即为KSV, 结果见表1。 由表1可知, 随着温度升高, 柠檬黄对BSA的荧光猝灭常数KSV下降, 表明柠檬黄对BSA的荧光猝灭过程属于静态猝灭。 柠檬黄对BSA的双分子猝灭速率常数Kq远大于猝灭剂对荧光分子最大动态扩散猝灭常数阈值(2.0× 1010 L· mol-1· s-1), 进一步证明柠檬黄对BSA的荧光猝灭方式是静态猝灭。
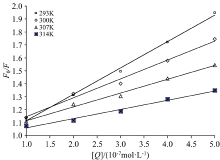 | 图2 不同温度下柠檬黄对BSA荧光猝灭的Stern-Volmer方程曲线图Fig.2 Stern-Volmer curve for the fluorescence quenching of BSA by tartrazine |
| 表1 Stern-Volmer线性方程和相关系数 Table 1 Stern-Volmer linear equations and correlation coefficients |
由于柠檬黄对BSA的荧光猝灭方式为静态猝灭, 利用静态猝灭双对数公式计算结合常数和结合位点数[8]
式(2)中, F0, F, KA, n的物理意义见文献[7], [Q]为柠檬黄的浓度。 以lg[(F0-F)/F]对lg[Q]作图得不同温度下的对数曲线图(见图3), 根据曲线的斜率和截距计算得出结合常数KA及结合位点数n, 结果见表2。 由表2可知, 柠檬黄与BSA的结合常数KA达到107数量级(293 K), 结合位点数n约为1, 说明柠檬黄与BSA有很强的结合能力, 且形成了一个结合位点。
| 表2 不同温度下结合常数KA和结合位点数n Table 2 Binding constant KA at different temperatures and number of binding point |
小分子与蛋白质之间的结合作用力包括静电作用、 氢键作用、 范德华力和疏水作用等[8]。 依据热力学公式[式(3)和式(4)]
计算得到不同温度下Δ G, Δ H和Δ S, 结果见表3。 从表3可知, Δ H< 0, Δ S< 0, 根据Ross等[9]归纳出判断小分子与生物大分子结合作用力性质的规律, 柠檬黄与BSA之间结合作用力主要为氢键和范德华力, Δ G< 0表明该结合是自发进行的。
| 表3 不同温度下相互作用的热力学参数 Table 3 Thermodynamic parameters of tartrazine-BSA interaction at different temperatures |
根据Fö rster非辐射能量转移理论, 一个分子(供体)与另一个分子(受体)之间发生非辐射能量转移要满足以下条件: 供体能发出荧光, 受体紫外光谱与供体荧光发射光谱发生重叠以及供体与受体的结合距离小于7 nm[10]。 能量转移效率(E)、 结合距离(r)、 临界能量转移距离(R0)及光谱的重叠积分(J)之间的关系可用式(5)— 式(7)表示
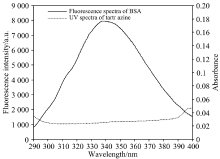
式(5)— 式(7)中, K2, φ , n, F(λ ), ε (λ )的物理意义及取值见文献[10]。 柠檬黄的紫外光谱可与BSA的荧光光谱发生重叠, 见图4。 计算得到光谱重叠积分J为5.695× 10-14 cm3· L· mol-1, 能量转移效率E为48.45%, 临界能量转移距离R0为3.276 nm, 结合距离r为3.310 nm。 r< 7 nm, 0.5R0< r< 2.0R0, 说明柠檬黄与BSA相互作用过程中发生了非辐射能量转移。
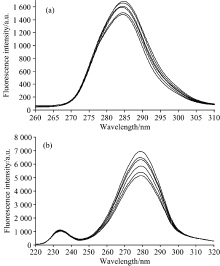
同步荧光光谱可同时扫描激发与发射两个单色器波长, 其灵敏度高, 选择性好且干扰少, 常被用来检测蛋白质构象变化[11]。 在同步荧光光谱中, 当Δ λ =15 nm时只显示Tyr残基的荧光, 见图5(a), 当Δ λ =60 nm时只显示Trp残基的荧光[12][见图5(b)]。 同步荧光光谱分析结果见图5(a, b), 图中横坐标为激发光谱。 由图5可知, Tyr残基和Trp残基分别在激发波长为284和279 nm处出现荧光峰, 随着柠檬黄浓度的增加, Tyr残基和Trp残基的荧光强度都逐渐降低, 表明Tyr残基和Trp残基均参与了柠檬黄与BSA的作用过程。
BSA和柠檬黄-BSA体系的三维荧光光谱见图6(a, b), 三维荧光参数见表4。 图中, peak a和peak b为瑞利散射峰, peak 1为Trp和Tyr残基的荧光峰, peak 2为多肽骨架的特征峰。 由表4可知, 柠檬黄的加入引起peak 1和peak 2的峰强度显著降低, 同时peak 2的发射波长发生了变化, 表明BSA的肽链结构发生了改变。 以上分析表明柠檬黄与BSA的作用导致BSA的空间构象发生了变化, 从而改变分子内部微环境, Trp和Tyr残基的发光效率降低。
| 表4 三维荧光光谱特征参数 Table 4 Characteristic parameters of three-dimensional fluorescence spectra |
多数蛋白质含有酪氨酸、 色氨酸残基, 因此, 蛋白质在近紫外区(280 nm)也有吸收峰, 紫外光谱可用来研究小分子对蛋白质结构的影响[13]。 图7为柠檬黄与BSA的紫外光谱图。 从图7可以看出, 柠檬黄与BSA体系在278 nm处有明显的吸收峰, 且随着柠檬黄浓度的增加, 吸收峰峰值逐渐增大, 吸收波长变化不大。 BSA肽链上的酪氨酸、 色氨酸残基芳杂环的π → π * 和n→ π * 跃迁使其在280 nm附近存在吸收峰。 柠檬黄与BSA的作用使BSA分子内部的酪氨酸、 色氨酸残基侧链逐渐裸露于水相中, 疏水作用增强, 芳杂环中电子的相互作用更有利于紫外吸收, 导致柠檬黄与BSA体系紫外吸收增强。 这一结果表明, 柠檬黄与BSA的作用导致BSA的空间构象改变, 发色基团所处的微环境发生了变化。
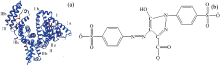
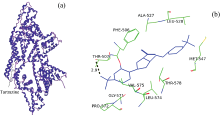
分子对接技术应用于小分子与蛋白质相互作用的研究可以直观了解小分子与蛋白质的结合位点和作用力类型[14]。 BSA由3个相似的结构域组成, 每个结构域含有a, b两个亚域[见图8(a)]。 从图9(a)可以看出, 柠檬黄结合于BSA的Ⅲ b亚域, 两分子BSA形成了一个二聚体。 图9(b)显示柠檬黄周围的氨基酸残基主要包括: Phe506, Thr507, Ala527, Leu528, Met547, Gly571, Pro572, Leu574, Val575, Thr578。 柠檬黄与BSA间主要通过范德华力与极性不带电荷的Thr507, Thr578残基相互作用。 柠檬黄分子中有12个氢键受体[8个O原子, 4个N原子, 见图8(b)], 能与周围的氨基酸残基以氢键结合。 苯环磺酸基O与Thr507残基侧链— OH的H形成氢键[图9(b)中黑色虚线]。 柠檬黄周围也存在非极性氨基酸残基, 因此, 疏水作用力也可能是柠檬黄与BSA间作用方式之一。
利用多光谱法以及分子对接法研究了柠檬黄与BSA之间的相互作用。 柠檬黄能有效猝灭BSA的内源荧光, 属静态猝灭, 且与BSA之间具有较强的结合作用力; Δ H< 0, Δ S< 0, Δ G< 0, 两者之间的作用力主要为氢键和范德华力, 该结合过程是自发进行的; 结合距离r< 7 nm, 柠檬黄与BSA相互作用过程中发生了非辐射能量转移; 光谱分析表明柠檬黄与BSA的结合使BSA的构象发生改变, 改变分子内部Trp和Tyr残基周围的微环境, 使其发光效率降低; 柠檬黄结合于BSA的Ⅲ b亚域, 柠檬黄与BSA间主要通过范德华力、 氢键和疏水作用力相互作用。 本研究有助于了解柠檬黄与BSA的作用机制, 为揭示柠檬黄在体内的运输、 代谢及毒理作用机制等提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|