作者简介: 艾比拜罕·麦提如则, 女, 1996年生, 新疆医科大学中医学院硕士研究生 e-mail: 2629770741@qq.com
罗布麻作为新疆的特色常用药材, 主要用于肝阳眩晕、 心悸失眠、 浮肿尿少以及高血压、 抑郁症的治疗。 为保证临床用药安全稳定, 常用传统的四大鉴别方法和现代的色谱、 波谱技术分析中药材的质量差异。 采用傅里叶变换红外光谱(FTIR)法对收集的17份新疆不同产地罗布麻药材进行分析, 红外光谱扫描范围为4 000~400 cm-1, 二阶导数范围为1 800~600 cm-1, 得到图谱后进行图谱解析; 采用谱带较密集的指纹区(1 800~400 cm-1)计算红外光谱图的相关系数; 然后结合红外光谱吸收峰系统聚类、 共有峰率和变异峰率双指标序列分析法对不同产地罗布麻药材的红外指纹图谱进行分类和异同点比较。 结果表明, 不同产地罗布麻药材红外光谱的峰形、 峰位相似, 在3 336, 2 920, 1 443, 1 375, 1 247, 1 103, 1 070, 833和601 cm-1附近均有吸收, 在1 103, 1 070和1 656~1 609 cm-1处均存在特征宽强峰。 892和717 cm-1处为C
Apocynum venetum L. was a commonly used medicinal material in Xinjiang, mainly used for hepatic yang vertigo, palpitation and insomnia, oedema and oliourine, and it also had a good therapeutic effect on hypertension and depression. In order to ensure safety and stability of clinical medication, four traditional identification methods and modern chromatographic and spectral techniques were commonly used to identify the quality differences of Chinese medicinal materials. In this study, 17 batches of A. venetum collected from different regions in Xinjiang were analyzed by Fourier transform infrared spectroscopy (FTIR ). The range of infrared spectrum was 4 000~400 cm-1, the range of secondary derivative spectra was 1 800~600 cm-1. After obtaining these fingerprints, the correlation coefficients were calculated by using the fingerprint spectrum (1 800~400 cm-1) with dense spectral bands. Then, the infrared fingerprints of A. venetum from different habitats were classified and compared by combining the infrared spectral absorption peak system clustering, the common peak rate and the variation peak rate double index sequence analysis. The results showed that the infrared spectra of A. venetum from different regions in Xinjiang were similar in shape and position of peaks, and all of them had absorption in wavenumber of 3 336, 2 920, 1 443, 1 375, 1 247, 1 103, 1 070, 833 and 601 cm-1. There were characteristic and strong peaks at 1 103, 1 070 and 1 656~1 609 cm-1. And the C
罗布麻是药食兼用、 可保护生态和极具开发潜力的药用植物资源, 因罗布泊而得名, 以新疆地区的野生资源蕴藏量最为丰富。《中华人民共和国药典》记载罗布麻叶(Apocyniveneti Folium)为夹竹桃科植物罗布麻Apocynumvenetum L.的干燥叶, 有平肝安神、 清热利水功效, 主要用于治疗肝阳眩晕、 心悸失眠、 浮肿尿少, 并对高血压、 抑郁症有良好的治疗效果[1]。 现代药理学研究表明, 罗布麻具有抗氧化、 抗糖尿病、 抗癌、 治疗心血管疾病、 保肝和抑菌等活性[2, 3, 4, 5]。 罗布麻药材中含有黄酮、 苯丙素、 多糖、 萜类、 有机酸和香豆素等化学成分。 罗布麻在新疆分布较广, 主要分布在阿勒泰、 和田、 博乐、 塔什库尔干、 玛纳斯和塔城等地区[6], 阿勒泰地区存在大面积的种植区域[7]。 本研究采收的17批药材均来自以上产地, 来源广泛且具有代表性。 为保证临床用药的安全稳定, 已有文献采用传统的来源、 性状、 显微、 理化鉴别和现代色谱、 波谱技术结合化学计量学方法评价了罗布麻药材的质量[8, 9], 但结合傅里叶变换红外光谱(FTIR)和双指标序列分析法分析罗布麻药材质量差异的研究未见报道。
当有机物分子振动频率与照射的红外区域电磁波频率一致时, 分子中的化学键或官能团发生吸收, 用红外光谱可记录这些化学键或官能团不同的吸收频率曲线。 红外光谱法分析速度快, 信噪比高, 样品用量少, 因此广泛应用于鉴定、 分子结构测定和定性定量研究中。 双指标序列法采用两个药材共有峰和相对于共有峰存在的非共有吸收峰表示这两个药材之间的异同程度。 每个药材建立一个双指标空间, 共有峰率和变异峰率(非共有峰率)是两个相互独立的指标, 这种二维度鉴别较聚类分析和相关系数分析丰富了鉴别信息, 能够互相证明分析方法是否适用。 本研究采用红外光谱相似系数, 结合系统聚类分析和能够多维鉴别的双指标序列分析法对收集的新疆罗布麻药材红外指纹图谱进行了分析, 旨在为分析评价罗布麻药材质量差异提供参考依据。
Spectrum two型傅里叶变换红外光谱仪(美国Perkin Elmer公司); YP-2压片机(上海山岳科学仪器有限公司); AB265-S(1/10万)电子天平(瑞士梅特勒-托利多公司); 玛瑙研钵; KBr光谱纯(北京化学试剂公司)。
17批药材于2019年7月上旬采收, 除去杂质后阴干; 样品来源于罗布麻在新疆的所有分布产区, 并将同一产地的所有样品混合后分成3个重复, 使药材取样均匀且具有代表性。 所有样品经新疆维吾尔自治区中药民族药研究所王果平研究员鉴定, 为罗布麻Apocynumvenetum L.的干燥叶。 药材信息见表1。
| 表1 药材信息 Table 1 Information of medicinal materials |
1.3.1 样品的制备
样品充分干燥并粉碎过200目筛, 取2.0 mg样品粉末放入研钵, 再放入200 mg KBr粉末混匀研磨至无明显颗粒, 转移到模具中, 20 MPa下经1 min压成近透明薄片。
1.3.2 光谱测定
室内温度保持在20 ℃左右, 湿度保持在30%以下; 光谱范围4 000~400 cm-1, 分辨率为4 cm-1, 累计扫描16次, 扫描时实时扣除H2O和CO2的干扰。 以溴化钾为背景, 每个样品重复3次。
1.3.3 数据处理
每个样品获得的3幅红外光谱图, 进行加和运算取其平均图谱作为该样品的红外光谱图。 得到图谱后采用Spectrum 10.4.2软件进行基线自动校正, 13点平滑, 吸光度归一化为1.3。 二阶导数谱范围为1 800~600 cm-1。 用Spectrum 10.4.2软件中的compare软件, 以S1为设置参比, 计算红外光谱图谱带较密集的指纹区(1 800~400 cm-1)的相关系数。 采用SPSS 21.0软件进行系统聚类分析, 采用各个药材的吸收波数分别计算药材之间共有峰率和变异峰率并进行分析。
2.1.1精密度试验
取同一样品片(S1)连续测定5次, 计算红外光谱图之间的相关系数。 结果, 所得红外图谱一致, 相关系数分别为1.000 0, 0.999 9, 0.999 9, 0.999 9, 0.999 9, RSD=5.50× 10-5。
2.1.2 稳定性试验
取同一样品片(S1)放入真空干燥器内保存, 每隔1 h测定1次, 计算5 h内所得红外光谱图之间的相关系数。 结果, 图谱间相关系数分别为1.000 0, 0.999 9, 0.999 7, 0.999 8, 0.999 6, RSD=1.58× 10-4。
2.1.3 重复性试验
取同一样品(S1)粉沫5份, 称量, 分别压片测定, 计算红外光谱图之间的相关系数。 结果, 图谱间相关系数分别为1.000 0, 0.999 4, 0.996 0, 0.996 0, 0.997 9, RSD=1.87× 10-3。
17批罗布麻药材的FTIR图谱见图1, 纵坐标为吸光度(Absorbance)。 由图可知, 罗布麻药材红外光谱的峰形、 峰位相似, 在3 336, 2 920, 1 443, 1 375, 1 247, 1 103, 1 070, 833和601 cm-1附近均有吸收, 说明不同产地罗布麻药材化学组成具有相似性。 3 336 cm-1处有宽而强的吸收峰为O— H键伸缩振动, 2 920和2 853 cm-1处为亚甲基C— H键伸缩振动, 属于罗布麻中黄酮类和糖(苷)类物质的伸缩振动; 1 735 cm-1附近有中等强度环羰基伸缩振动谱带, 为C=O的伸缩振动吸收峰, 属于羧酸类和挥发油物质的伸缩振动; 1 646和1 615 cm-1附近为苯环上C— H伸缩振动, 1 546和1 443 cm-1为苯环骨架C=C伸缩振动谱带, 与罗布麻药材所含的黄酮类和芳香族化合物有关[10]; 1 375和1 320 cm-1处为甲基C— H键面内弯曲振动, 1 247 cm-1处为醇、 酚及氨基酸物质O— H键面内弯曲振动吸收峰[11, 12]; 1 103和1 070 cm-1处均存在特征宽强峰[13], 为糖及糖苷类物质C— O伸缩振动吸收峰, 与1 656~1 609 cm-1范围内存在的一个或两个吸收峰, 峰强和峰宽与其相似, 分析认为1 656~1 609 cm-1处吸收峰可作为鉴别罗布麻与其他药材的参考依据之一。 892 cm-1附近为碳酸钙盐分子面外变形振动峰, 717 cm-1附近为C— O面内变形振动峰, 并且仅在克拉玛依独山子区药材S4和产地相邻的乌苏市甘家湖保护区药材S5出现此吸收峰, 与钙土盐碱化程度有关[14]。 833和801 cm-1处属多糖及糖环C— H变形振动峰, 657 cm-1处属醇和酚O— H面外弯曲振动峰, 601和535 cm-1处分别属于黄酮类物质C— C伸缩振动峰和C— H面外弯曲振动峰。 compare软件计算相关系数, 发现除了S5, 其余16批罗布麻药材的相关系数均大于0.960, 整体相似度较高。
为了获得更多细微的差异信息, 在一维红外指纹图谱的基础上建立了二阶导数光谱, 见图2(S1— S17), 纵坐标为10-3 A。 由图2可知, 罗布麻药材二阶导数光谱的峰形仍具有较大的相似性, 但在1 444~1 738和833~1 030 cm-1范围内峰数明显增加。 1 634 cm-1处为酚羟基芳环的骨架伸缩振动峰, 1 149, 1 125和1 028 cm-1附近为糖类的特征吸收峰, 950, 921和730 cm-1处为糖环振动特征吸收峰, 都进一步提示罗布麻中含有糖(苷)类化合物[15, 16]。 1 414和617~889 cm-1范围为苯环取代基类的C— H面外弯曲振动的特征峰[17], 不同产地样品特征峰强弱的差异可能与其黄酮类和芳香族化合物含量存在差异有关。
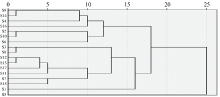
将17批罗布麻药材的吸收峰波数导入SPSS 21.0统计学软件, 采用平均联接(组间)法, 以欧式距离平方(SED)为测度进行聚类分析, 见图3。 结果表明, S9与S14, S2与S10, S3与S8, S12与S13最先聚为一类, 说明这些药材内部分子结构较相似; 当欧式距离为15时, 可将药材分为四大类, 即在1 615 cm-1处有吸收峰的药材为一类, 在1 646 cm-1处有吸收峰的药材为一类, 1 646和1 615 cm-1处均有吸收峰的药材S1为一类, 在2 962 cm-1处唯有吸收的药材S5为一类; 当欧式距离为20时, 可将药材分为S5和其他药材两大类。 分类结果与相关系数结果一致, 波数相似性高样品聚在一起, 说明欧式距离较近的药材之间化学成分的种类和含量也比较接近。
2.5.1 共有峰的确定方法
对于一组吸收峰, 若组内吸收峰的波数最大差值小于该组峰与其相邻组之间的平均波数之差, 确定该组峰是一组共有峰。 如1 102, 1 102, 1 102, 1 103, 1 102, 1 101, 1 104, 1 104, 1 103, 1 104, 1 103, 1 104, 1 103, 1 103, 1 103, 1 103和1 102 cm-1, 这组峰平均波数为1 103 cm-1, 该组内最大波数差为2 cm-1; 该组峰前后相邻组峰的平均波数值分别为1 202和1 068 cm-1, 与其前后相邻组峰的平均波数值差分别是99和35 cm-1, 明显大于组内最大波数差2 cm-1, 可判断该组峰是共有峰。
2.5.2 罗布麻药材红外指纹图谱共有峰率和变异峰率双指标序列
根据共有峰率公式P=Ng/Nd× 100%(其中Ng为共有峰数, Nd为独立峰数)和变异峰率公式Pva=na/Ng× 100%, Pvb=nb/Ng× 100%(其中na和nb分别为图谱a和b中相对于共有峰存在的非共有峰数), 计算红外光谱指纹图谱共有峰率和变异(非共有)峰率[18]。 建立不同产地罗布麻药材红外光谱指纹图谱双指标分析序列后, 根据共有峰率P和变异峰率Pva, Pvb大小对双指标序列结果进行近似对、 近似组划分, 从而判断药材间异同程度。
A组S2:S10(100; 0, 0), S3:S8(100; 0, 0), S9:S14(100; 0, 0), S12:S13(100; 0, 0)
B组S1:S11(94.9; 21.4, 7.1), S1:S15 S16(88.9; 6.3, 6.3), S2:S6 S9 S14(87.5; 7.1, 7.1), S2:S16(87.5; 0, 14.3), S3:S12 S13(87.5; 0, 14.3), S5:S6(88.2; 13.3, 0), S6:S5 S16(88.2; 0, 13.3), S6:S2 S9 S10 S14(87.5; 7.1, 7.1), S7:S15(94.1; 0, 6.3), S7:S12 S13(88.2; 6.7, 6.7), S8:S11 S13(93.3; 0, 7.1), S8:S12(87.5; 0, 14.3), S9:S16(88.2; 0, 13.3), S9:S2 S6 S10 S11(87.5; 7.1, 7.1), S10:S16(88.2; 0, 13.3), S10:S6 S9 S14(87.5; 7.1, 7.1), S11:S12 S13(93.8; 0, 6.7), S11:S15 S16(88.2; 0, 13.3), S11:S9 S14(87.5; 7.1, 7.1), S12:S15 S16 (94.1; 0, 6.3), S12:S11(93.8; 6.7, 0), S12:S7(88.2; 6.7, 6.7), S12:S3 S8(87.5, 14.3, 0), S13:S15 S16(94.1; 0, 6.3), S13:S11(93.8; 6.7, 0), S13:S8(93.3; 7.1, 0), S13:S7(88.2; 6.7, 6.7), S13:S3(87.5, 14.3, 0), S14:S2 S6 S10 S11(87.5; 7.1, 7.1), S15:S7 S12 S13(94.1; 6.3, 0), S15:S1 S16(88.9; 6.3, 6.3), S15:S11(88.2; 13.3, 0), S16:S12 S13(94.1; 6.3, 0), S16:S1 S15(88.9; 6.3, 6.3), S16:S6 S9 S10 S11(88.2; 13.3, 0), S16:S2(87.5; 14.3, 0)
C组S11:S3(61.9; 53.8, 7.7), S11:S17(66.7; 7.1, 42.9), S5:S3 S8(63.2; 41.7, 16.7)
其中S1:S11(94.9; 21.4, 7.1)表示S1和S11的共有峰率为94.9%, S1中相对于共有峰的非共有峰率(变异峰率)为21.4%, S11中相对于共有峰的非共有峰率为7.1%。 S2:S6 S9 S14(87.5; 7.1, 7.1)表示S2与S6, S9和S14分别计算出来的共有峰率均为77.8%, S1变异峰率为7.1%, S6, S9和S14分别计算出来的变异峰率均为7.1%。 在A组中S2:S10, S3:S8, S9:S14和S12:S13序列共有峰率为100%, 说明药材内部信息高度一致。 B组序列共有峰率相对较高, 而C组序列变异峰率达53.8%, 分析认为未表现出明显的产地差异性。
建立了新疆不同产地罗布麻药材的指纹图谱, 其中各药材红外光谱的峰形、 峰位相似。 一维红外光谱与二阶导数分析方法相结合, 获得不同产地罗布麻药材的化学成分结构信息, 证明该鉴定方法在药材鉴别上具有可行性。 本实验所采用的红外光谱法简便灵敏, 检测出液相实验中直接检测不到的钙盐离子。 指纹图谱强调整体性, 红外光谱相关系数考察样品之间的相似性, 两种分析结果均说明不同产地罗布麻药材具有一定的相似性。 聚类分析将波数相似程度大的药材聚为一类, 结果与相关系数一致。 共有峰率和变异峰率双指标序列法分别根据相似性和差异性两个方面对各药材间的关系进行整体评价。 红外光谱相关系数分析、 聚类分析和双指标序列分析结果相互补充和印证, 可为今后新疆罗布麻药材质量评价体系的建立提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|