作者简介: 徐杨彪, 1992年生, 华南理工大学化学与化工学院硕士研究生 e-mail: 2393165519@qq.com
研究蛋白质水溶液的红外光谱(IR)谱时, 由于溶剂水的强吸收与蛋白质的吸收峰会发生严重重叠, 极大地干扰对蛋白质吸收峰的识别、 定性、 定量和结构分析。 尝试利用杂化光谱法扣除溶剂水峰。 采用双背景方法, 用空白ATR晶体(背景样品1)与ATR水层(背景样品2)合成了单光束杂化背景谱, 通过控制对背景样品1和背景样品2的扫描次数, 合成的单光束杂化背景谱中水的信号强度可任意调节, 成功实现了牛血清白蛋白(BSA)水溶液中溶剂峰的在线扣除。 与光谱差减技术比较, 杂化光谱扣除法具有显著的优势: 水3 400 cm-1峰强度接近于零, 1 700~1 800 cm-1区间得到近似平滑直线, 水1 640 cm-1峰彻底扣除, 观察到了高质量的酰胺I带吸收峰。 将杂化谱法获得BSA红外光谱二次微分, 得到蛋白质二级结构大量信息, 与文献报道高度吻合。 杂化光谱法应用到蛋白质热变性研究中, 成功获得没有溶剂水峰干扰的蛋白质红外光谱, 变性前后, 酰胺Ⅰ带光谱发生明显改变, 峰形变化显著, 吸收峰往低波数方向移动, 吸收强度显著减小。 杂化光谱ATR法扣除溶剂水峰简单、 易操作、 效果令人满意。
In the infrared spectroscopic study of aqueous protein solution, the characteristic peaks of solvent water and protein overlap partially or completely, which seriously affects the quantitative and structural analysis of protein. In this study, the solvent single beam spectra with arbitrary intensity were successfully synthesized by using two background samples. Therefore the solvent peaks in protein solution can be removed completely. The results of the hybrid spectrum were compared with those of the subtraction spectrum, and it was found that the hybrid spectrum has obvious advantages. The secondary structure information obtained from the second derivative of the hybrid spectra of BSA is in good agreement with that reported in the literature. Hybrid spectroscopy has also been used to study the thermal behavior of aqueous protein solutions. Without the interference of water peaks, the resolution of the amide Ⅰ and amide Ⅱ bands become easier. As the temperature increased, the peak position of the protein shifted. After high-temperature treatment, the bioactivity of BSA is lost.
蛋白质是细胞和各类组织的重要组成部分[1]。 大多数蛋白质的疏水端聚集成核而亲水端位于外表面, 因此, 多数蛋白质可以溶解于水中[2]。 红外光谱是研究蛋白质分子的常用方法, 可以提供蛋白质的重要结构信息[3]。 水的红外吸收峰主要集中在3 400 cm-1(O— H伸缩振动)与1 640 cm-1(剪式振动)处。 其中3 400 cm-1处的伸缩振动峰宽而强。 1 640 cm-1附近的剪式振动峰则会与蛋白质的酰胺Ⅰ 带(1 650 cm-1)几乎完全重叠, 甚至会部分掩盖酰胺Ⅱ 带(1 545 cm-1)的吸收峰。 蛋白质酰胺Ⅰ 带的红外光谱包含了众多二级结构信息, 例如α -螺旋、 β -折叠、 β -转角以及无规则卷曲等。 但是水吸收峰与蛋白质吸收峰的重叠会对酰胺Ⅰ 带的光谱识别造成严重干扰。 扣除蛋白质水溶液中溶剂水峰, 获得高质量蛋白质的IR谱, 是研究蛋白质结构的关键问题之一[4]。
消除水溶液中溶剂水峰的干扰研究中, 目前主要有重水法, 光谱差减技术和化学计量学方法等。 用D2O作溶剂, 由于同位素效应, D2O的伸缩振动峰与弯曲振动峰分别出现在2 500与1 200 cm-1, 不会和蛋白质酰胺Ⅰ 带发生重叠[5, 6]。 然而, IR研究蛋白质重水溶液也存在问题, 如果同时含有微量水, 就会导致光谱中同时出现H— O— H, D— O— H以及D— O— D的吸收峰[7], 使问题进一步复杂化。 其次, 蛋白质中的活性氢会与重水中氘进行交换, 氘代蛋白质与原蛋白质结构和构象可能存在差异, 会对一些光谱识别和结构分析造成不利影响。 随着化学计量学的兴起, 人们开发了化学计量学结合光谱差减技术进行水峰的扣除[8], 但是水与蛋白质之间存在着许多复杂相互作用, 导致其扣除效果存在一定局限性[9]。 人们又将光谱区域选择在蛋白质酰胺Ⅲ 带上, 酰胺Ⅲ 带的光谱区域在1 305~1 200 cm-1, 这个区域受水的干扰小并且也包含了蛋白质的二级结构信息。 酰胺Ⅲ 带的吸收峰信号相对于酰胺Ⅰ 带要弱很多, 一些浓度低的蛋白质水溶液在红外光谱上很难观察到清晰的酰胺Ⅲ 带吸收峰[10]。
强极性水有很强的红外吸收峰, 减小样品的厚度, 可以降低溶剂水的吸收峰强度。 然而, 即使是3~6 μm厚度的液体池, 水的吸收峰依然很强[11], IR测量需要极薄的水层, 给液体池制样技术带来很大挑战。 ATR是测量液体样品特别是水溶液的便捷方法[12]。 ATR的穿透深度dp仅为红外辐射在晶体表面波长的1/10左右[13], 其样品的穿透厚度很小, 适合对吸收峰极强的水溶液测量。 牛血清白蛋白(BSA)包含581个氨基酸残基, 分子量为66.446 kDa, 是目前在生化实验中应用最广泛的蛋白之一。 研究中尝试利用双背景法结合ATR技术来进行BSA水溶液中溶剂水峰的扣除, 希望能够获得无水峰干扰的BSA的高质量红外光谱。 对BSA进行热变性处理, 探究蛋白质变性过程中光谱的变化也是研究的内容。
BSA的水溶液为样品, 空的ATR晶体做背景, 则得到的IR谱中水峰信号为正, 水峰很强。 如果以纯水层ATR晶体做背景, 则得到的IR谱中水峰信号为负, 水峰并不能完全扣除。 研究中将尝试双背景法, 先用空ATR晶体做背景, 扫描N次后, 暂停扫描, ATR晶体上滴加纯水层, 继续扫描水层ATR, 观测水峰信号, 随扫描次数增加水峰信号逐渐变小, 直至水峰信号弱至可忽略, 停止扫描, 就可获得BSA的光谱。
牛血清白蛋白(BSA, Bio Reagent, 纯度≥ 98%)购于Adamas-beta, 浓盐酸(HCl, AR, 37%)与氢氧化钠(NaOH, AR, ≥ 96%)均购于General-Reagent, 使用前未经过处理。 超纯水用Milli-Q水净化系统制备得到。 BSA水溶液的配制, 先将500 mg的BSA加入到9.5 mL超纯水中, 轻轻摇动直至完全溶解, 然后加水定容到10 mL, 得到50 mg· mL-1的BSA水溶液。 最后将配制好的BSA水溶液放于4 ℃冰箱中保存, 防止蛋白质变性。
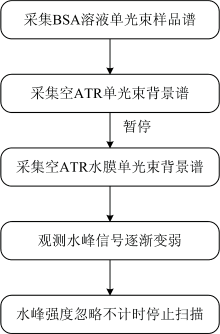
红外光谱仪为Thermo Fisher Scientific公司的Nicolet IS 50, DTGS检测器, 光谱分辨率为4 cm-1, 在25 ℃条件下测量, 红外光谱室湿度维持在60%左右。 ATR晶体为金刚石。 每次测量前, 用75%乙醇清洗ATR晶体, 干燥待用。 图1为双背景法进行溶剂峰扣除的过程示意图。
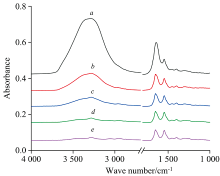
图2是50 mg· mL-1的BSA水溶液红外光谱图。 采集完BSA水溶液样品谱后, 再采集背景谱。 背景谱采集分两阶段, 对空ATR晶体(背景样品1)扫描32次, 暂停扫描, 将纯水滴加到ATR晶体上形成薄水层, 制备背景样品2, 继续扫描ATR水层背景。 扫描空ATR晶体32次, 得图谱(a)。 扫描空ATR晶体背景32次后, 暂停, 制备背景样品2(ATR水层), 继续扫描96, 224, 480和596次后的结果见图2(b— e)。 背景单光束谱即含空ATR晶体信息又含水信息, 可称为杂化背景单光束谱, 比如图2(b)中, 杂化背景单光束谱可表达为Φ =0.25Φ 1+0.75Φ 2, Φ 1为空ATR晶体的贡献, Φ 2为ATR晶体水层的贡献, 0.25由32÷ (32+96)得来。 图2(a)中在3 700~2 800 cm-1波段出现一个宽且强的溶剂水的伸缩振动吸收峰。 溶剂水在3 400 cm-1处的吸收峰很强, 又相对独立, 因此将其选作参考峰。 光谱采集时3 400 cm-1吸收峰强度接近零时, 就认为已经扣除了BSA水溶液中溶剂的吸收峰。 由图2(a)可看出, 水的1 640 cm-1吸收峰遮盖了酰胺Ⅰ 带。 从(b)到(e), 随着对背景样品2扫描次数增加, 水的吸收峰逐渐变弱, 酰胺Ⅰ 带逐渐显现, 证明了双背景法是有效的。 背景样品2扫描596次时, 水的3 400 cm-1吸收峰强度接近零, 1 800~1 700 cm-1附近的基线近似平滑直线, 表明水峰被彻底扣除了, 强制停止扫描, 就获得了无溶剂峰干扰的BSA水溶液的红外光谱图, 见图2(e)。 图2(e)中, 3 400 cm-1峰信号几乎看不到, 1 640 cm-1峰比3 400 cm-1峰更弱, 扣除应该更彻底。 图2(e)中, 已经可以清楚识别酰胺Ⅰ 带。
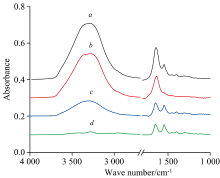
为了验证双背景法的扣除效果, 与光谱差减技术进行了对比。 将BSA水溶液的ATR红外光谱与溶剂水的ATR光谱(均以空白ATR晶体作背景)进行差减, 结果见图3。 图3(a)为BSA水溶液光谱, 图3(b)是纯水的光谱。
将图3(a)与图3(b)光谱进行差减, 得到图3(c), 差减系数为0.93。 差减之后得到的图3(c)并不理想。 一方面, 溶剂水在3 700~2 800 cm-1波段的伸缩振动峰有明显残留; 另一方面, 在1 700 cm-1附近, 出现了一个负的吸收峰, 这是水峰在1 700 cm-1区域被过度差减的结果。 图3(c)表明, 利用差减技术同时扣除水的1 640和3 400 cm-1峰很困难。 通常差减技术要求以1 800~1 700 cm-1附近的基线近似平滑直线为水峰完全扣除标准, 而不考虑水的3 400 cm-1峰扣除效果。 图3(d)是通过双背景法获得的扣除溶剂峰之后的BSA水溶液的红外光谱。 图3(d)表明, 3 400 cm-1峰扣除较彻底, 1 800~1 700 cm-1附近的基线近似平滑直线, 双背景法对溶剂吸收峰的扣除效果显著优于光谱差减技术。
为了进一步验证双背景法的有效性, 对图3(d)进行了二阶导数处理。 处理的波段为BSA水溶液中的酰胺Ⅰ 带所在的1 700~1 600 cm-1区域, 选取Savitsky-Golay导数, 点数为7, 多项式项数为3。 需要注意, 二阶导数处理后的负峰对应原始谱图的吸收峰。 二阶导数处理后的多个吸收峰列入表1。 与Dong[14]等报道的BSA吸收峰吻合很好。 这一结果再次证明, 双背景法扣除溶剂峰的干扰可靠的、 有效并令人满意的。
| 表1 二阶导数谱的吸收峰归属与文献值比较 Table 1 The origins of the peaks for the second-order differential spectrum |
蛋白质容易受到外界因素的影响而发生构象的变化, 从而丧失其生物活性。 通过加热使蛋白质发生变性是最常见的方式。 BSA的变性温度大约是72 ℃。 对BSA水溶液加热, 蛋白质变性之后再降低温度, BSA活性不能复原。 进行BSA水溶液热变性实验, 先对BSA水溶液加热恒温一段时间, 溶液冷却至室温后(25 ℃)进行红外光谱的测定。
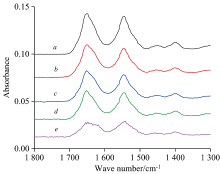
将五个BSA溶液样品分别经过25, 40, 55, 70和85 ℃恒温水浴处理30 min, 溶液冷却至室温后, ATR附件测量BSA水溶液的IR谱。 双背景法获得的IR谱见图4。
图4中, 曲线a对应于扫描空ATR晶体32次, 曲线b, c和d分别对应扫描空ATR晶体32次+扫描ATR水层N次。 b→ c→ d, 随着N增加, 水峰逐渐减弱, d为扣除溶剂水峰后的图谱。 当BSA水溶液进行85 ℃恒温水浴30 min后, BSA完全变性, 图4(e)与图4(a— d)有明显区别, 反映了BSA变性的实际状况。
为了更好地观察BSA热处理的影响, 将不同温度时扣除了水峰的谱图绘制在一起[图4(a— e)中d线], 见图5。 如果以1 800~1 700 cm-1附近的基线近似平滑直线为标准, 图5再次表明, 双背景法扣除水峰是成功的, 扣除效果令人满意。
随着温度的升高, BSA酰胺Ⅰ 带与酰胺Ⅱ 带的峰强度相应地减小。 当BSA变性后, 如曲线图5e所示, 酰胺Ⅰ 带的峰型显著不同于变性前的图谱。 蛋白质的变性破坏的是蛋白质的二级结构, 而酰胺Ⅰ 带包含了蛋白质二级结构的信息, 这是BSA的酰胺Ⅰ 带变性前后光谱发生较大变化的原因。
表2给出了图5中温度对BSA酰胺Ⅰ 带与Ⅱ 带的吸收峰位置及吸光度的影响。 随着温度的升高, BSA的酰胺Ⅰ 带与Ⅱ 带的吸收峰发生了红移, 吸光度逐渐减弱。 比较图5d图5e, 蛋白变性后, 酰胺Ⅰ 带峰形峰位置和峰强度发生了明显变化。 表2结果也验证了这一结果。
| 表2 温度对BSA酰胺Ⅰ 带与Ⅱ 带的影响 Table 2 Effect of temperature on amide band Ⅰ and amide band Ⅱ of BSA in the aqueous solutions |
研究了杂化光谱法水溶液中溶剂水峰的扣除。 采用双背景方法, 用空ATR晶体(背景样品1)与ATR水层(背景样品2)合成了单光束杂化背景谱, 通过控制对背景样品1和背景样品2的扫描次数, 合成的单光束杂化背景谱中水的信号强度可任意调节, 成功实现了BSA水溶液中溶剂峰的扣除。 与光谱差减技术比较, 双背景样品法具有明显优势, 简单、 易操作, 扣除效果令人满意。 对双背景法得到的BSA光谱二次微分, 得到了蛋白质β -转角、 α -螺旋和β -折叠等二级结构信息。 成功地利用杂化光谱法对BSA的热变性进行了研究, 揭示了变性过程中酰胺Ⅰ 带的峰形、 峰位置以及吸光度的显著变化。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|