作者简介: 付 娟, 女, 1982年生, 中国科学院广州能源研究所高级实验师 e-mail: fujuan@ms.giec.ac.cn
天然气水合物是蕴含着巨大能源潜力的非常规能源, 2017年和2020年两次我国南海探索性试采的成功, 加快了天然气水合物项目的进展。 二氧化碳置换开采法, 既能开发CH4, 又能封存CO2。 同时水合物法分离烟气中CO2具有很好的应用前景, 而CO2在气体水合物的微观结构和特性尚不明确, 实际应用存在一定的未知影响。 为了考察其特性, 利用13C固体核磁技术(NMR)和拉曼光谱(Raman)进行CO2置换CH4水合物、 合成13CO2-H2-CP混合水合物实验表征, 讨论CO2在水合物中的定量问题, 研究CO2分子在笼型结构中的分布, 探讨CO2分子在气体水合物中的结构类型和特性。 结果表明: (1)利用Raman费米低频共振1 277.5 cm-1峰积分得到CO2在I型大笼(51262笼)的占有率为0.978 2, CH4在Ⅰ型小笼(512笼)和大笼(51262笼)的占有率为0.059 3和0.009 5, 水合数7.61, Raman费米高频共振1 381.3 m-1峰积分得到CO2在51262笼的占有率为0.984 3, CH4在512笼和51262笼的占有率为0.023 7和0.003 3, 水合数7.70, CO2几乎占满了大笼, CO2气体的加入会导致水合物中, CH4的大、 小笼占有率均大幅度降低, 置换后水合数略低于纯甲烷水合物, 未标记的CO2水合物在核磁中较难测出信号, CO2气体置换后CH4在小笼的占有率仅0.097 5, 大笼占有率为0.317 2, 两种方法差异主要原因为核磁的CO2未出峰。 (2)利用拉曼费米低频共振1 273.4 cm-1峰积分得到H2、 CO2在512笼、 CP在51262的占有率分别为0.124 8, 0.304 2和0.997 8, 水合数9.16; Raman费米高频共振1 380.6 cm-1峰积分得到H2、 CO2在512笼、 CP在51262的占有率分别为0.123 6, 0.577 1和0.985 1, 水合数7.12。13C标记CO2分子在水合物中达到较好的固体核磁分辨率, 首次确认CO2在Ⅱ型小笼中的化学位移为124.8 ppm, 计算得到CO2的小笼占有率为0.783 1, CP的大笼占有率为0.971 8, 水合数6.70, Raman高频频费米共振峰(1 380.6 cm-1)定量计算与13C NMR结果更接近。 (3)对CO2的13C NMR化学位移进行了归属, 并结合Raman与13C NMR的对比分析, 为CO2水合物的13C NMR研究和拉曼定量提供参考。
Natural gas hydrate is unconventional energy with huge energy and source potential. In 2017 and 2020, two exploratory trials of marine hydrate in the South China Sea were successful. The incident accelerated the development of China's natural gas hydrate project. Carbon dioxide replacement and recovery technology can develop natural gas energy sources in a dense solid phase stored in natural gas hydrates and store CO2 greenhouse gases in the ocean. The separation of CO2 from flue gas by forming hydrates is becoming a promising new separation technology. The microstructure and properties of CO2 molecules in gas hydrates are still unclear, and the practical application of CO2 technology has certain unknown effects. In this paper,13C solid-state nuclear magnetic technology (NMR) and Raman spectroscopy (Raman) technology were used to characterize CO2 molecules from CH4 hydrates replaced by CO2 gas and the synthesized13CO2-H2-CP hydrates. The content of CO2 molecules stored in hydrate crystals was tested, the distribution of CO2 molecules stored in the hydrate cage was analyzed, and the structureal characteristics of CO2 molecules in gas hydrates were obtained. The results show that: (1) The 1 277.5 cm-1 peak integration of the Raman Fermi low-frequency resonance is used in CH4 hydrates replaced by CO2 gas to obtain CO2 molecules occupied in the 51262 cages and CH4 molecules occupied in the 512 and 51262 cages. They are 0.978 2, 0.059 3, and 0.009 5, respectively. The hydration number of the hydrate formed is 7.61. The 1 381.3 cm-1 peak integration of the Raman Fermi high-frequency resonance is also used to obtain CO2 molecules occupied in the 51262 cages and CH4 molecules occupied in the 512and 51262 cages. They are 0.984 3, 0.023 7, and 0.003 3, respectively. The hydration number of the hydrate formed is 7.70. The large cages (51262 cages) of the CO2 hydrate formed are almost filled with CO2 molecules. After the replacement, the addition of CO2 molecules in hydrate crystals will cause occupancies of CH4 in the large cages and small cages (512 cages) of the CH4 hydrate crystals formed by replacement to be greatly reduced. The hydration number of the CH4 hydrate formed by replacement is slightly lower than that of methane hydrate before the replacement. NMR is difficult to detect that the CO2 molecular signal was coming from the CO2 hydrate formed by unlabeled CO2 molecules. After CO2 gas replacement, the occupancy rate of CH4 in the small cage and the large cage is only 0.097 5 and 0.317 2, respectively. The occupancy rates obtained by the above two peak integration methods are not the same. The main reason for this difference is that NMR detected no unlabeled CO2 molecular signal. (2) The Raman Fermi low-frequency resonance 1 273.4 cm-1 peak integration method was used the synthesized13CO2-H2-CP hydrates and the occupancy rates of H2, CO2 in 512 cages, and CP in 51262 cages were obtained with results of 0.124 8, 0.304 2, and 0.997 8, respectively. The hydration number from the hydrate formed is 9.16. The Raman Fermi high-frequency resonance peak integration method of 1 380.6 cm-1 was also used, and the occupancy rates of H2, CO2 in 512 cages, and CP in 51262 were obtained, respectively, which were 0.123 6, 0.577 1, and 0.985 1, respectively. The hydration number from the hydrate formed was 7.12. The results show that13C-labeled CO2 molecules can obtain better solid-state NMR resolution in the synthesized hydrates. This paper confirms for the first time that the chemical shift of CO2 molecules from type Ⅱ small cages is 124.8 ppm, and it is calculated that the small cage occupancy rate of CO2 is 0.783 1, the large cage occupancy rate of CP is 0.971 8, and the hydration number is 6.70. The results show that the Raman high-frequency Fermi resonance peak (1 380.6 cm-1) is closer to the13C-labeled NMR result. (3) This paper assigns the13C NMR chemical shift of CO2. The results in this paper provide a reference for CO2 hydrate research used by13C NMR technology. In addition, combined with the comparative analysis of Raman and13C NMR, it provides another reference for the quantitative study of CO2 hydrate used by Raman technology.
近年来, 我国天然气水合物试开采取得历史性突破[1], 水合物开采与储存的技术研究成为国内外气体水合物研究领域的一个热点, CO2置换CH4水合物是一种开发CH4的方法, 既可以开发CH4, 又可以永久储存CO2[2, 3, 4, 5]。 在水合物制备过程中, 通过添加环戊烷(Cyclopentane, CP)等热力学促进剂可以快速生成水合物, 能够促进烟气混合物的CO2回收和燃料气体混合物(CO2-H2)的回收, 并一定程度上影响客体分子的笼型分布和气体储气量的大小[6]。
气体水合物是由水和气体分子在一定温度和压力条件下形成的一种形态似冰、 非化学计量性的笼形化合物。 气体水合物常见笼型结构为512 (小笼)、 51262 (大笼)、 51264(大笼)、 435663(中笼)和51268 (大笼), 这5种常见笼型结构主要构成有I型、 Ⅱ 型和H型三种常见的结构类型。 CO2分子直径约为0.512 nm, 纯二氧化碳形成I型水合物, 二氧化碳分子填充大笼和一些小笼[7]。 与分子直径小的CH4、 H2形成Ⅰ 型水合物, CO2分子更倾向填充51262(大笼), 512 (小笼)略有填充[3]; 与分子直径大的丙烷、 环戊烷、 四氢呋喃等形成Ⅱ 型水合物, CO2分子更倾向于填充512 (小笼)[8]。 与四丁基溴化铵形成半笼型水合物[9]。 与填充客体分子所在笼型不同, 所处的化学环境不同, 化学位移有差异, 因而固体核磁能提供气体水合物结构类型、 笼占有率、 客体组分组成等定性和定量特性[10], CO2水合物比较多使用Raman, XRD和FTIR在水合物的结构表征, CO2有4个Raman峰, 其定量研究较少, 本文利用13C固体NMR技术和Raman进行CO2置换CH4水合物、 合成13CO2-H2-CP水合物实验表征, 讨论CO2在水合物中的定量问题, 分析CO2分子在笼型结构中的分布, 探讨CO2分子对水合物结构特征的影响。
所用仪器设备主要包括300 MHz AVANCEⅢ 宽腔固体NMR谱仪(瑞士Bruker)、 LabRAM HR800 激光共焦拉曼光谱仪(HORIBA JY)配备LinkamTHMS 600 冷台、 S-4800(HORIBA)配备 QUORUM 冷冻扫描电镜系统、 Direct-Q3 纯水系统(法国MILLIPORE)、 FD-1C-50真空冷冻干燥机(西安太康)。
所用试剂主要包括高纯CH4, CO2, H2(购自广州盛盈气体有限公司)、 金刚烷(纯度为99%, 购自美国Sigma 公司)、 13CO2气体标记(购自广州谱源气体有限公司)、 CP(纯度为99%, 购自麦克林试剂)。
1.2.1 水合物样品制备
水合物样品的制备由自制可视化气体水合物低温高压合成装置合成。 表1列出了合成不同混合水合物样品的制备条件。 制备完成后, 快速取出样品, 并置于液氮中保存待用。
| 表1 水合物样品制备条件 Table 1 Experimental preparation conditions of hydrate samples |
1.2.2 13C固体核磁共振测试
在液氮保护下取出水合物, 将合成的水合物于液氮中研磨后, 用自制NMR装样工具在液氮中将样品均匀填入转子, 并在液氮中装好盖子, 将装好样品的定子保存于液氮中待测。 水合物样品的13C NMR测试使用7 mm DVT双共振固体NMR 高分辨探头和ZrO2转子, 工作频率为75.5 MHz。 为了适应水合物测试的要求, 对7 mm探头进行了改造。 采用1HPDEC 脉冲程序, 去耦的序列为tppm15, 脉冲重复延迟时间为20 s。 使用空转子旋转, 将探头温度降低至170 K, 将空转子取出, 放入装有样品的转子, 魔角旋转速度为3 kHz, 扫描次数128。 以金刚烷为外标对化学位移进行定标(δ 38.48), 测试温度维持在170 K左右。
1.2.3 激光拉曼共振测试
将保存在液氮中的水合物样品敲碎, 置于装满液氮的研钵进行研磨, 尽量让切面裸露出来。 待低温台降至设置的温度, 迅速开盖, 取小块水合物样品快速放置于样品槽中, 迅速盖上石英盖, 接上氮气管吹盖表面。 利用显微镜观察调节选取样品测试点, 移动光源凭经验寻找有水合物特征的点进行预扫, 然后再进行点扫。 上下左右, 中间不断的进行移动光源来寻找最佳的水合物, 进行扫描。 采用532 nm激光作为激发光源, 光栅刻度为2 400 线· mm-1, 50倍长焦镜头, 狭缝宽度为100 μm。 曝光时间为20 s(100~4 000 cm-1全扫描)。 每次测试前用单晶硅(520 cm-1) 对激光拉曼光谱进行校正。 每个谱图累计扫描2次。
1.2.4 冷冻扫描电镜测试
将水合物在液氮中碎成小颗粒, 颗粒过大容易在样品室抽真空过程中飞出, 测试不到样品且污染样品室。 样品台预冷完成后, 在液氮下将水合物样品装入锡纸并包住, 将样品台样品在液氮中快速取出放入冷冻传输装置预冷中, 将冷冻传输管接上样品台, 在真空条件下, 将样品转移到安装在扫描电镜样品舱端口上的制样舱中的冷台上, 用操作杆将锡箔纸打开将水合物样品暴露出来, 便于观察。 在真空条件下, 将样品通过传输管从冷冻传输装置转移至扫描电镜样品舱中的冷台上, 进行超微结构观测。
冰粉在高压甲烷下生成CH4水合物, 从图1微观形貌图可见, A球形松散状冰粉, 反应后微观形貌已从球状松散状, 转化为致密结构B, 水分子与甲烷分子形成笼型水合物结构, 表面呈现致密的脉冲形貌, 而分解后可见200 nm左右的孔状结构C, 表明随着温度升高, 结构内部有大量气体从笼型中逃逸出来, 形成孔状结构。
 | 图1 反应前冰粉(A)、 置换前甲烷水合物(B)、 甲烷水合物分解后(C)SEM图Fig.1 SEM photograph of ice (A), methane hydrate before replacement (B), after the decomposition of methane hydrate (C) |
将高压CH4置换为高压CO2, 反应结束后取出水合物进行NMR表征。 由于CO2中13C天然丰度为1.11%, 16O和18O的自旋量子数为0, 无法进行NMR观测, 17O的自旋量子数为5/2, 天然丰度为0.04%, 天然丰度低, 因此C-O相互作用NMR能观测到的信号也较弱, CO2水合物在NMR中的信号较弱[11, 12], CH4-CO2水合物只出现CH4的共振峰。 由于不同客体分子填充在水合物不同笼型中的化学环境不同, 其对应13C NMR化学位移也不同, CH4、 CO2、 CP气体水合物的13C NMR化学位移(表2), 可通过实验中观测到的谱图中样品的化学位移, 与已知结构样品或相近样品的13C谱化学位移对比来鉴定水合物的结构。 随着笼型孔穴尺寸的减小, 拥有更为紧凑局限的环境[13], CH4分子化学位移影响越大。
| 表2 常见气体水合物晶体结构及13C NMR化学位移[11, 12, 13, 14, 15] Table 2 Crystal structure and 13C NMR chemical shifts of common gas hydrate |
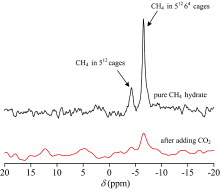
图2为CO2置换CH4前后的13CNMR谱图, -6.51和-4.25 ppm为CH4分子在Ⅰ 型水合物大、 小笼中的峰, 置换前大小笼峰面积比为3.97∶ 1, 生成后CH4气体水合物后, 反应釜内气体置换为高纯CO2后, 生成水合物存在CH4水合物, 化学位移为-6.54和-4.23 ppm, 对应Ⅰ 型水合物化学位移, 对比置换前, 大、 小笼峰均有所减弱, 大笼面积为置换前的0.32, 小笼面积为置换前的0.13, 大、 小笼峰面积比为7.03∶ 1。 根据化学势方程[15], 计算出置换前, CH4在小笼占有率为0.749 7, 在大笼中占有率为0.992 1, 水合数6.17。 置换后CH4在小笼占有率为0.097 5, 大笼占有率0.317 2, 没有观测到CO2的峰, 无法准确计算水合数。 CO2的加入导致CH4水合物的分解, CH4在水合物中的量大幅度减小, CH4在大笼中的填充明显大于小笼, 这可能大笼数量多, 笼型中CO2分子与CH4分子达到一定的平衡有关。
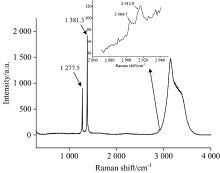
为了进一步确认CO2进入水合物的情况, 用Raman对置换后水合物进行表征。 置换后Raman谱图见图3, 1 277.5和1 381.3 cm-1 CO2水合物的特征峰, Chen等提出77 K时Ⅰ 型CO2水合物小笼的低频费米共振峰为1 274.8 cm-1, 高频费米共振峰为1 382.1 cm-1; 大笼中低频费米共振峰为1 276.7 cm-1, 高频费米共振峰为1 379.6 cm-1; Ⅱ 型THF+CO2水合物中, CO2在小笼的低频费米共振为1 273.7 cm-1, 高频费米共振峰为1 379.5 cm-1 [7]。 本工作1 277.5和1 381.3 cm-1为CO2在Ⅰ 型大笼中的低频费米共振峰和高频费米共振峰。 2 904.7和2 915.8 cm-1为CH4在Ⅰ 型小笼、 大笼共振峰, 信号比较弱, 大、 小笼峰面积比2.08∶ 1, 1 382.2 cm-1峰高是2 915.8 cm-1峰高的73.4倍。 化学势方程[15], 利用费米低频共振峰计算得到, CH4在小笼中的占有率为0.059 3, 大笼占有率为0.009 5, CO2在大笼的占有率为0.978 2, 水合数7.61; 利用费米高频共振峰计算得到, CH4在小笼中的占有率为0.023 7, 大笼占有率为0.003 3, CO2在大笼的占有率为0.984 2, 水合数7.70。 Raman计算的CH4在大笼小笼中的占有率均低于13C NMR。 这可能与CO2在13C NMR中未出峰有关。 从拉曼的结果来看, 置换后, CO2大量进入水合物大笼中, 而CH4大量逃逸出来, 仍有一小部分分子残留在笼型中, 水合数增大, 水合物饱和度降低。 从置换后大、 小笼比例的变化来看, 不严格按照大笼、 小笼的数量比3∶ 1的规律逃逸。
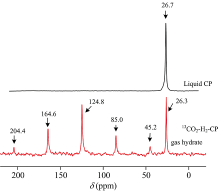
在前期测试过程中, 发现水合物中CO2信号十分微弱甚至观察不到。 为了获得高强度的CO2固体核磁信号, 使用13CO2气体标记合成13CO2-H2-CP水合物。 图4是使用13CO2气体标记的13CO2-H2-CP水合物的13C NMR谱图。 图中δ 124.8是CO2共振谱线, δ 204.4, 164.6, 85.03和45.2属于旋转边带峰。 气相CO2的化学位移为125 ppm[10], Ⅰ 型大笼CO2水合物相化学位移仍为125.6 ppm[14]。 纯CP(液相)的化学位移为26.7 ppm, CP水合物为结构Ⅱ 型, CP进入51264的大笼, 化学位移为26.3 ppm, 在水合物相, CP分子受拘束, 化学位移向低场移动了0.4 ppm。 CH4-CP混合水合物的化学位移为26.3 ppm, CP与气体分子形成Ⅱ 型水合物, CP客体分子填充在大笼(51264), 因而化学位移不会有变化[6]。 本文13CO2-H2-CP水合物中, CP的化学位移为26.3 ppm, 结构为Ⅱ 型, CP进入51264的大笼, H2和CO2进入512的小笼。 Ⅱ 型水合物512笼型中CO2的化学位移为124.8 ppm, 与Ⅰ 型大笼的125.6 ppm[14], 气体CO2的125 ppm[10]不一致, Ⅰ 型大笼的孔径为4.33 Å , Ⅱ 型小笼的孔径为3.91 Å , CO2在Ⅰ 型大笼中化学位移向高场移动0.6 ppm, CO2在Ⅱ 型小笼中化学位移向低场移动0.2 ppm, 这与松笼-紧笼理论不一致, Chen等利用Raman研究CO2水合物发现了这一现象, 线性分子CO2在笼型中围绕笼轴旋转, 不在非对称笼子的全部区域运行, 因而C=O伸缩振动频率与笼子直径无关, 不遵从松笼-紧笼理论[7]。
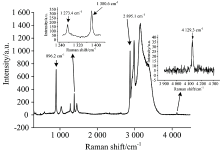
为进一步确认13CO2-H2-CP水合物结构, Raman对水合物进行分析(图5), 1 273.4和1 380.6 cm-1为CO2在Ⅱ 型水合物小笼中的低频费米共振峰和高频费米共振峰。 896.2和2 895.1 cm-1为CP在水合物相的伸缩振动峰。 4 129.3 cm-1为H2在小笼中的伸缩振动峰, H2的伸缩振动信号较弱, 说明H2进入小笼较少。 其中CP的2 895.1 cm-1峰因与OH振动峰有重叠, 选择896.2 cm-1进行计算, CO2的1 273.4和1 380.6 cm-1共振峰分别进行积分, CP中因有5个C— H键需折算成单个分子。 Ⅱ 型水合物中小笼数量是大笼数量的2倍, 512小笼中CO2、 H2与51264大笼CP的笼占有率为[6]
在没有客体分子间相互作用和主体晶格扭曲, Ⅱ 型结构水合物的水分子在空晶格中与冰之间的化学势能差Δ
其中Ⅱ 型水合物Δ
CO2按低频费米共振峰积分由式(1), 式(2)和式(3)可计算出绝对笼占有率θ L, CP,
假设H2进入小笼的量较小忽略不计, 对图413C NMR谱进行积分26.3 ppm为CP在51264中C— C信号, 124.8 ppm为CO2在512中C信号。 5%13CO2的CO2气体为未标记CO2的信号的4.55倍, 而CP中有5个CH2需折算成单个分子, 512小笼中CO2与51264大笼CP的笼占有率为
由式(2), 式(3)和式(4)可计算出绝对笼占有率θ L, CP,
对比Raman与13CNMR计算的笼占有率, 利用低频共振峰1 273.4 cm-1计算CO2的笼占有率相差较大达到61.15%, CP笼占有率相差2.5%, 高频共振峰1 380.6 cm-1计算CO2的笼占有率相差26.31%, CP笼占有率相差1.37%。 利用CO2高频共振峰更接近13C NMR计算结果。 CP几乎占满大笼(> 98%), CO2在小笼中未完成占满, H2笼占有率低。 Lee等CP(5.6 mol%)与CH4混合水合物利用13C NMR谱图, 计算得到CP在Ⅱ 型大笼的占有率为0.99, CH4在Ⅱ 型小笼中的占有率为0.60[6]。 可见CP能够促进CH4和CO2水合物的生成, 但不能提高CH4和CO2在笼型中的占有率。
| 表3 13C NMR和获得的笼占有率 Table 3 Cage occupancy value obtained by 13C NMR and Raman |
利用低温13C NMR对混合CO2水合物进行了表征, 结合Raman讨论了置换后CH4水合物、 13CO2-H2-CP水合物的组成、 笼占有率和水合数, 结果表明:
(1)纯CH4水合物中CH4几乎填满大笼(笼占有率0.992 1), 小笼占有率0.749 7、 水合数6.17。 CO2气体置换后CH4的小笼占有率仅0.097 5, 大笼占有率0.317 2, 未标记的CO2在13C NMR中测不到信号。 利用Raman费米低频共振1 277.5 cm-1峰积分得到CO2在51262笼的占有率为0.978 2, CH4在512笼和51262笼的占有率为0.059 3和0.009 5, 水合数7.61。 Raman费米高频共振1 381.3 m-1峰积分得到CO2在51262笼的占有率为0.984 3, CH4在512笼和51262笼的占有率为0.023 7和0.003 3, 水合数7.70, CO2几乎占满了大笼, CO2气体的加入会导致水合物中, CH4的大、 小笼占有率均大幅度降低。
(2)13C标记CO2水合物达到较好的分辨率, CO2在Ⅱ 型小笼中的化学位移为124.8 ppm, 计算得到CO2的小笼占有率为0.783 1, CP的大笼占有率为0.971 8, 水合数6.70。 利用Raman费米低频共振1 273.4 cm-1峰积分得到H2和CO2在512笼、 CP在51262的占有率分别为0.124 8, 0.304 2和0.997 8, 水合数9.16; Raman费米高频共振1 380.6 m-1峰积分得到H2、 CO2在512笼、 CP在51262的占有率分别为0.123 6, 0.577 1和0.985 1, 水合数7.12, Raman高频费米共振峰定量计算与NMR结果更接近。
(3)对CO2水合物的13C NMR化学位移进行了归属, 为CO2水合物13C NMR研究提供了参考, 同时结合Raman与13C NMR的对比分析, 可为CO2水合物拉曼定量分析作参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|