作者简介: 惠云婷, 女, 1992年生, 中国农业大学工学院博士后 e-mail: HYT1556521354@163.com
高丹草中粗蛋白质以及碳水化合物的含量丰富, 适合青贮处理。 优质的高丹草种子是发展畜牧业十分重要的前提, 发芽率是检验种子质量最常规的指标之一, 播前种子发芽率检测与筛选十分必要。 现阶段采用发芽试验法进行种子发芽率的检测, 周期长、 成本高。 基于此, 提出利用近红外光谱对高丹草种子进行发芽率的快速、 无损检测。 选择适量的高丹草种子样品, 采集近红外漫反射光谱, 进行一阶导和二阶导预处理以及对比分析$R^{2}_{c},R^{2}_{p}$, RESEC和RMSEP。 采用支持向量机(SVM)建模, 使用MATLAB中调用的LIBSVM软件包来实现SVM训练和检测过程, 以检测不同发芽率的高丹草种子。 对来自不同省份的100组高丹草种子先剔除种子内的杂物、 破损以及不能满足试验条件的种子后, 用人工气候培养箱进行种子发芽试验, 获得100组种子样本的发芽率, 其发芽率分布在41%~64%的范围。 采用美国Unity Scientific 2600XT近红外光谱仪对样本进行光谱扫描。 随机分成校正集70份和检验集30份。 分别采用一阶导和二阶导进行了高丹草种子光谱的预处理, 将预处理之后的数据采用支持向量机的方法建模, 并对其参数进行了分析和讨论。 结果表明, 近红外光谱预测模型训练集相关系数($R^{2}_{c}$)和测试集相关系数($R^{2}_{p}$)分别为0.94和0.92, 校正均方根误差(RMSEC)、 预测均方根误差(RMSEP)分别为0.21和0.25, 两个产地的高丹草种子数据采用一阶导预处理时模型最优。 支持向量机的方法建模采用Rbf核函数, 当支持向量机惩罚因子 c=2 896.309 4和核函数 g=0.5时, 测试集种子发芽率的检测准确率为96.666 7%(29/30)。 该模型预测种子发芽率是可行的, 可以作为初步检测高丹草种子发芽率快速无损检测的手段之一, 能够有效的促进种子生产。
Sorghum-Sudan Grass is rich in crude protein and carbohydrate, suitable for silage treatment. High-quality seeds are a prerequisite for animal husbandry development, and germination rate is one of the most conventional indicators to test the seed quality. Therefore, testing and screening the germination rate of the seeds prior to sowing is essential. The germination test method is currently used to detect seed germination rate, which has a long cycle and high cost. In this study, a rapid and non-destructive method based on NIR was proposed to detect the germination rate of sorghum-sudangrass seeds. The near-infrared diffuse reflectance spectra of the seed samples were collected with 1-Der and 2-Der processing. Moreover, comparative analysis of the parameter values obtained for $R^{2}_{c},R^{2}_{p}$, RESEC and RMSEP was also performed. The support vector machine (SVM) was used for modeling, and the LIBSVM software package in Matlab was used to realize the SVM training and detection process to detect the seeds of sorghum-sudangrass seed with different germination rates. Using the Unity scientific 2600 XT Near-infrared spectrometer, 100 groups of sorghum-sudangrass seeds from different provinces were selected as samples. Before the experiment, the broken seeds and seeds that did not germinate were removed, and the germination test was carried out in the incubator. The germination rate of 100 samples was obtained, and the germination rate ranged from 41% to 64%. The seed samples were spectroscopically scanned and were randomly divided into calibration set (70 samples) and test set (30 samples). In this paper, the 1-Der and 2-Der method was used to preprocess the spectrum of sorghum-sudangrass seeds. SVM modeled the preprocessed data, and its parameters were analyzed. The results showed that the correlation coefficients of the training set ($R^{2}_{c}$) and test set ($R^{2}_{p}$) were 0.94 and 0.92 respectively, and the root mean square error of correction (RMSEC) and root mean square error of prediction (RMSEP) were 0.21 and 0.25 respectively, which reflected that the model was the best when the 1-Der was used to preprocess the seed data. When c=2 896.309 4, g=0.5, the detection accuracy of the test set was 96.666 7% (29/30) by using Rbf core functions of SVM modeling. These results suggested that the model was feasible to predict the seed germination rate, and could be used as one of the rapid and non-destructive detection methods for the preliminary detection of seed germination rate of sorghum-sudangrass could effectively promote the seed production.
近年来, 随着畜牧业的快速发展, 饲草料的需求也急剧增加, 饲草料的短缺已经成为制约畜牧业发展的重要因素之一, 亟待解。 高丹草(sorghum-sudan grass)作为一种新品种, 是由高粱(sorghum bicolor)和苏丹草杂交培育而成, 它结合了二者的优良特性, 富含粗蛋白及碳水化合物, 适合青贮, 且在干旱、 寒冷、 盐碱地等环境下抵抗能力强[1]。 高丹草的优良特性使其成为许多地区的家畜首选饲料。 高丹草的种植改变了一些地区的农业结构, 对于地区发展畜牧业有着突出的贡献。 优质的高丹草种子可有效促进畜牧业的发展, 发芽率是衡量种子质量的常规指标之一[2]。 研究表明, 长时间贮藏高丹草种子会影响种子活力, 发芽率也随之变化。 因此高效判断高丹草种子质量可有效促进畜牧业发展。
现阶段实验室检测种子发芽率多采用发芽试验法[8], 在人工气候培养箱内严格按照种子发芽技术规定的条件(包括湿度、 光照、 时间等)进行试验, 试验条件要求较高, 一般需要10~15 d, 周期较长, 且发芽试验对种子具有破坏性, 试验后的种子不能重复使用, 试验投入的人工成本及时间成本较高, 不能满足快速、 准确、 无损测试的要求, 也不能适应快速发展的畜牧业需求。 因此, 为降低成本, 提高检测速度及精度亟需一种无损、 快速且准确的发芽率的检测方法[3, 4]。 近红外光谱技术的应用广泛, 可以得到有关物质的特征信息[5], 可以不破坏样品且无需利用化学试剂, 更高效、 成本更加低的进行样品分析[6]。 故而, 许多研究人员开始将这一技术应用到种子领域。
在农作物的营养检测方面, 近红外光谱技术[7]也展现出了独特优势, 如评估高粱内部成份含量[8]、 预测植物叶片含水率[9]、 小麦内在品质的无损检测[10, 11]; 戴子云等利用近红外光谱技术对结缕草种子的标准发芽率进行分析, 并利用定量偏最小二乘法进行数据分析; 李毅念等为检测不同老化程度的杂交水稻种子的发芽率, 采集数据并进行建模, 校正预处理时采用了全波段和标准化+正交信号这种方法; 金文玲等设计并搭建了一套投射式近红外光谱检测系统, 结合光谱特性建立了主成分分析模型, 同时通过偏最小二乘法建立了不同年份水稻种子的活力判别模型, 研究结果表明, 水稻种子的活力梯度与其近红外吸收光谱的吸收峰值相关[12]。 国内外现有活力检测分析的研究对象主要是针对小麦和水稻, 鲜有高丹草种子发芽率分析的报道。 本工作针对高丹草种子检测发芽率存在的问题, 提出一种利用近红外光谱技术快速检测高丹草种子发芽率的方法。
采集2个品种的高丹草种子的近红外光谱, 同时进行种子发芽试验; 利用导数法对采集的光谱数据进行预处理, 并将预处理之后的数据采用支持向量机(SVM)建立高丹草种子发芽率检测模型, 以期分析高丹草种子发芽率的光谱特征, 提高发芽率检测的速度及精度, 从而为基于近红外光谱技术检测高丹草种子发芽率提供依据。
高丹草种子100份, 分别来自内蒙(50份)、 山东(50份), 随机选择相同粒数的种子进行发芽试验, 试验地点为中国农业大学牧草机械实验室。
图1所示为美国Unity Scientific 2600XT近红外光谱仪, 波长范围: 680~2 600 nm, 分辨率: 1 nm; 该仪器内含二极管阵列检测器检测固体样品的近红外光谱, 检测范围宽; 在食品、 农业、 医药领域得到广泛应用。
在测试样品前, 剔除杂物、 破损粒、 霉变粒等坏种粒; 称取相同质量[(8± 0.1) g]的高丹草种子样品置于样品杯中, 倒入时, 高丹草的种子样品至样品杯的10 mL刻度处, 并通过旋转顶窗设计和漫反射的方式进行扫描。 重复扫描24次求取平均光谱。
根据农业部《农作物种子检验规程— 发芽试验》(GB/T 2930.4— 2001)标准, 进行高丹草种子发芽试验。 将培养皿清洗、 烘干, 然后在其中平铺两层滤纸, 将去离子水沿壁缓慢的滴入培养皿, 使滤纸完全浸湿, 并将筛选出的100粒高丹草种子均匀的放置在浸湿的滤纸上。 种子之间保持适当的距离, 避免过于紧密或者距离太大影响种子发芽率。 每组试验重复3次; 将培养皿放入培养箱(型号: BD-PRX, 南京贝帝实验仪器有限公司), 每天观察种子生长情况, 当芽长超过种子自身长度1/2视为发芽, 并记录发芽情况, 及时补充水分, 且对发芽数进行记录, 当实验进行至12 d时, 统计高丹草种子的总发芽数。
种子发芽率的计算如式(1)所示
式(1)中, GR为种子发芽率; N为供试种子粒数; n为发芽种子粒数。
采用仪器所带的UScanTM软件及美国Unity科学公司SpectraStar系列第二代仪器的日常定量分析软件, 使用matlabR2020a软件调用LIBSVM软件包。 预处理: 将采集样品的光谱数据利用导数法进行分析, 并将预处理之后的数据采用支持向量机(SVM)建立高丹草种子发芽率检测模型, 并且通过该模型对高丹草种子的发芽率进行快速检测与验证。
通过种子发芽试验得到的100份样品的发芽率分布于41%~64%之间(表1), 平均值为52.86%; 将试验的100份种子根据发芽率进行分类, 发芽率41%~52%属于第一类(类标签: 0), 52%~100%为第二类(类标签: 1); 按照7∶ 3的比例划分训练集和测试集, 可得训练集样本70份, 测试集30份。
| 表1 样本发芽率 Table 1 Germination rate of sample |
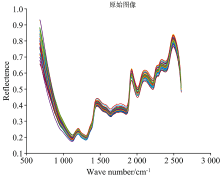
近红外漫反射光谱如图2, 从图中可以看出, 不同种类的高丹草种子样品的光谱图像相似, 样品的漫反射吸光度值范围是0.19~0.94。 光谱图像有重叠, 在1 110, 1 200, 1 300, 1 460, 1 900, 2 000, 2 100, 2 200和2 500 nm附近有明显的吸收峰、 吸收谷存在。
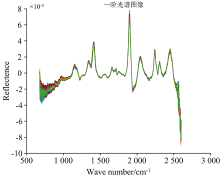
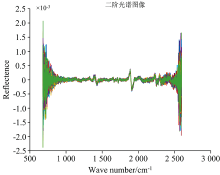
采集样品光谱信息的目的是采集该样品所包含的化学组成信息, 然而一些其他无关信息也有可能被采集, 因此对采集到的光谱进行预处理以去除电噪声、 样品背景和杂散光无关信息的干扰, 降低模型的复杂程度, 从而提高模型的稳定[13]。 在多种预处理方法[14]中, 使用导数光谱导数法来消除由于背景色或其他因素引起的光谱基线漂移或位移, 以区分重叠的波峰和波谷, 提高分辨率, 降低系统所带来的误差以及基线校正。 在本研究中, 由于采集的高丹草种子光谱段波长样点多且分辨率较高, 采用直接差分法求导, 以此减少误差。
根据光谱特性, 对9个近红外的光谱波段1 000~1 200, 1 200~1 300, 1 300~1 400, 1 400~1 800, 1 800~2 000, 2 000~2 100, 2 100~2 200, 2 200~2 300, 2 300~2 600和全波段1 000~2 600进行光谱预处理, 对9个近红外波段建模, 比较分析
| 表2 高丹草种子的光谱预处理结果 Table 2 Spectral pretreatment results of the sorghum-sudan grass seed |
支持向量机(support vector machines, SVM) 在解决小样本问题时有其独特之处[15], 其在优化问题时, 将训练误差作为约束条件, 相较于一些传统的分析样本的方法来说, 具有不可替代的优势性。 在对高丹草种子发芽率检测时, 该方法十分适用。 标记所有通过导数方法预处理的样本, 在训练SVM核函数及其参数时, 随机选取标记好的高丹草种子样本总量的十分之七, 剩下的数据样本用作测试集。 在本研究中, 使用MATLAB中调用的LIBSVM软件包来实现SVM训练和预测过程。
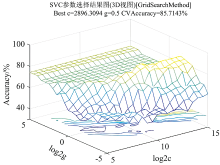
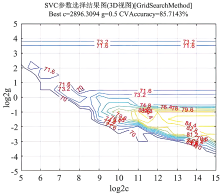
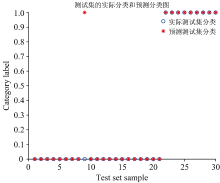
通过使用3折和10折交叉验证方法进行对比, 首先选择核函数类型为Rbf, 采用网格寻优的方法寻找支持向量机惩罚因子c和核函数g的最优值。 参数g定义了单个训练样本的影响大小, 值越小影响越大, 参数c在误分类样本和分界面简单性之间进行权衡。 在试验时选择随机抽样, 使参数c和g在[2-5, 215]的范围内进行网格优化, 并确定最佳参数, 如图5(3D视图)所示和图6(等高线图)所示。 准确率是指被分对的样本数除以所有的样本数, 错分率与正确率相反, 描述被错分的比例; 用准确率和错分率来评价分类模型。 结果表明, 3折和10折交叉验证对比, 折线对比区别较小, 检验准确率相同, 3折检验效率较高, 所以使用3折交叉验证。 参数c和g最优分别为2 896.309 4和0.5, 并将这两个最优参数训练支持向量机。 3折交叉验证下的最佳检测准确率为96.666 7%(29/30), 如图7所示分类情况检测的性能已经可以满足一定的要求。 结合预处理和3折交叉验证法, 建立导数法-支持向量机高丹草种子检测模型。
以高丹草种子为研究对象, 选取1 000~2 600 nm波段近红外光谱结合支持向量机(SVM)建立高丹草种子发芽率检测的数学模型, 实现了高丹草种子发芽率的快速检测。 通过采用一阶导和二阶导的预处理, 得到近红外光谱预测数学模型
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|