作者简介: 金王君, 1997年生, 中国科学院深海科学与工程研究所硕士研究生 e-mail: jinwangjun18@mails.ucas.ac.cn;李 艳, 女, 1995年生, 中国科学院深海科学与工程研究所博士研究生 e-mail: liy@idsse.ac.cn;金王君, 李 艳: 并列第一作者
随着社会经济的飞速发展, 能源短缺问题在世界范围内日益突显。 目前, 开发利用可再生能源已被我国列为能源发展的优先领域。 藻类植物蕴含丰富的生物质能, 同时又具有光合效率高、 固碳能力强、 生长速度快、 来源分布广等优势, 是公认的可持续绿色清洁能源的发展方向。 甘氨酸是藻类水热液化过程中的重要过程反应物, 其液化过程中的热动力学性质是认识和优化藻类水热液化技术的基础要素, 通过研究甘氨酸水热液化过程可为分析复杂的生物质水热液化反应奠定基础。 研究基于熔融石英毛细管反应器(FSCR)高温高压可视反应腔, 结合Linkam FTIR600控温台与Andor激光拉曼光谱仪联用, 对甘氨酸水溶液在270~290 ℃(压力同于实验环境温度下水饱和蒸气压)条件下的液化过程运用拉曼光谱分析技术开展了原位研究。 通过观测5 Wt%甘氨酸溶液中C—C伸缩振动峰(897 cm-1)、 C—N 伸缩振动峰(1 031 cm-1)和COO-反对称伸缩峰(1 413 cm-1)在液化过程中的相对拉曼强度变化, 深入分析了温度及反应时间对甘氨酸溶液各官能团热分解的影响。 运用Avrami的反应动力学模型分析, 获取了量化温度对甘氨酸分子中骨架碳链 ν(C—C)的特征振动模式热解过程影响的活化能, 357 kJ·mol-1, 和不同实验温度下的反应速率常数 k等一系列相关参数, 定量地揭示了甘氨酸液化过程的热动力学性质。 实验中发现, 在设定相同的液化反应时间(10 min)内, 当温度低于290 ℃时, 降温后反应腔内能观测到甘氨酸水溶液中 ν(C—C), ν(C—N), νas(COO-)的特征峰, 而温度高于290 ℃时则不然, 表明甘氨酸的完全液化温度约为290 ℃。 该研究运用高温高压可视化实验技术, 结合原位拉曼光谱分析技术, 厘清了甘氨酸水热液化过程中的不同温度下特征官能团拉曼峰强的变化规律, 为深入了解藻类水热液化过程机理、 推进生物质能的开发利用提供必要的实验依据, 具有重要的科学意义和现实意义。
JIN Wang-jun and LI Yan: joint first authors
With the rapid development of social economy, the problem of energy shortage is becoming more and more prominent in the world. At present, the development and utilization of renewable energy has been listed as the priority area of energy development in China. Algae plants contain abundant biomass energy, and have advantages such as high photosynthetic efficiency, strong carbon fixation capacity, fast growth rate, and wide distribution of sources, which is recognized as the development direction of sustainable green and clean energy. Glycine is an important derivative product in the process of algal hydrothermal liquefaction. The thermomechanical properties of glycine during liquefaction are the basic elements to understand and optimize the technology of algal hydrothermal liquefaction. The study of glycine hydrothermal liquefaction process can lay a foundation for the analysis of complex biomass hydrothermal liquefaction reaction. In this study, based on the high temperature and high pressure visible reactor of fused silicon capillary reactor (FSCR), combined with Linkam FTIR600 temperature control platform and Andor laser Raman spectrometer, the liquefaction process of glycine aqueous solution at 270~290 ℃ (pressures approximate to the saturated vapor pressure of water at ambient temperatures) was studied in situ by Raman spectroscopy. The effects of temperature and reaction time on the thermal decomposition of functional groups of glycine solution were analyzed by observing the relative Raman intensity changes of C—C stretching vibration peak (897 cm-1), C—N stretching vibration peak (1 031 cm-1) and C—O—O antisymmetric peak (1 413 cm-1) during liquefaction. The activation energy, 357 kJ·mol-1, and reaction rate constant k at different temperatures were obtained by using Avrami kinetic model. The thermodynamic properties of glycine liquefaction process were quantitatively determined. It is found that within the same liquefaction reaction time (10 min), when the temperature is lower than 290 ℃, the ν(C—C), ν(C—N), νas(COO-) characteristic peak of glycine aqueous solution can be observed in the reaction chamber after cooling, but not when the temperature is higher than 290 ℃, indicating that the complete liquefaction temperature of glycine is about 290 ℃. The present study, based on the high-temperature and high-pressure visualization technology combined with in-situ Raman spectroscopy analyses, reveals the variation of the Raman peak intensities of characteristic functional groups of glycine at different temperatures during the hydrothermal liquefaction and provides deep insights into the pathway of hydrothermal liquefaction of algae. It is of great scientific and practical significance to understand the mechanism of algal hydrothermal liquefaction and promote the development and utilization of biomass energy.
生物质能的萃取和利用已成为各国绿色能源的研发热点, 藻类的水热液化研究位列其中。 由于水热液化技术具有无需预处理、 对设备条件要求较低等优势, 可实现更高的经济效益, 是将微藻转化为液体燃料的主要途径[1, 2]。 生物质中蛋白质是生物油的主要来源之一, 水解易产生小分子的氨基酸, 进一步发生脱氨、 脱羧等反应[3]。
氨基酸降解主要途径包括脱氨(生成氨和有机酸)和脱羧(生成碳酸和胺), 主要降解产物有烃类、 胺类、 醛类和酸类[6], 具体反应随氨基酸的种类和反应环境不同而变化。 Klingler等[7]研究了以甘氨酸在亚水和超临界水分解过程(1.0和2.0 Wt%, 250~450 ℃, 24~34 MPa, 2.5~35 s), 构建了以氨基酸脱羧和脱氨为主要降解途径的反应网络。
蛋白质模型化合物甘氨酸作为重要中间反应物之一, 其结构较为简单, 通过研究甘氨酸水热液化过程可为分析复杂的生物质水热液化反应奠定基础[4, 5]。 然而关于甘氨酸在高温高压水中分解过程的基础研究工作尚不完善[8, 9, 10], 有必要深入地了解其水热反应过程的动力学特征。 原位拉曼是表征有机反应机理的有效方法, 本文拟利用拉曼光谱分析方法, 观测反应过程中甘氨酸官能团的拉曼峰强变化, 以确定甘氨酸热分解进行的程度。 同时根据Avrami的反应动力学模型获取甘氨酸液化过程中的反应动力学参数。
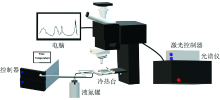
实验使用的原位拉曼测试平台(图1)包括: Andor激光显微拉曼光谱仪(Andor RTS2)和FTIR600控温台(Linkam)。 实验中使用的样品为分析纯(AR)甘氨酸粉末(国药试剂集团), 超纯水配制5 Wt%甘氨酸溶液, 其中超纯水通过超纯水机(四川优普超纯科技有限公司)制备。
将配制的5 Wt%甘氨酸溶液注射置入一端焊封的熔融石英毛细管反应器(fused silica capillary reactor, FSCR), 溶液端浸于冰水中用氢氧焰将另一端焊封, 显微镜下确认, 最终制样效果如图2所示。 将FSCR放入Linkam FTIR600控温台中置于配备Andor激光显微拉曼光谱仪的显微镜下, 激光器波长为532 nm, 激光功率约为305 mW, 物镜倍率为20倍。 初始温度为室温30 ℃, 控制器设定为50和100 ℃· min-1的升温速率加热到实验温度(270~290 ℃), 压力值与反应温度下溶液的饱和蒸气压相对应, 反应时间设置为10 min。 从加热开始连续采集拉曼光谱, 谱图采集曝光时间为5 s, 原位研究升温过程以及恒温条件下模型化合物水热液化过程中的结构变化特征。 实验完成后, 将实验温度以100℃· min-1的降温速率降回室温, 采集反应后产物的拉曼光谱。 在数据分析过程中, 使用Origin软件对采集的拉曼光谱图进行Savitzky-Golay平滑及归一化处理。
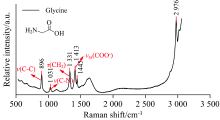
常温下, 5 Wt%甘氨酸水溶液的拉曼光谱如图3所示。 参考文献报道及模拟计算[11, 12, 13], 图3中(896± 5) cm-1处为C— C伸缩振动峰, (1 031± 5) cm-1处为C— N伸缩振动峰, (1 331± 5) cm-1处为CH2摇摆振动峰, (1 413± 5) cm-1处为COO-反对称伸缩峰, (2 976± 5) cm-1处为CH2伸缩振动峰。
按照所述实验方法, 以50 ℃· min-1分别升温至270, 280和290 ℃等不同温度条件下开展实验。 在每一设定的温度下, 实验时间为10 min, 期间通过拉曼光谱观测740~1 460 cm-1波数段内的特征峰变化, 每隔2 min采一张谱, 记录的拉曼谱图示于图4— 图6。
 | 图4 不同温度下甘氨酸特征拉曼峰ν (C— C)随时间变化 (a): 270 ℃; (b): 280 ℃; (c): 290 ℃Fig.4 The characteristic Raman peak of glycine, ν (C— C), changes with time at different temperatures (a): 270 ℃; (b): 280 ℃; (c): 290 ℃ |
 | 图5 不同温度下甘氨酸特征拉曼峰ν (C— N)随时间变化 (a): 270 ℃; (b): 280 ℃; (c): 290 ℃Fig.5 The characteristic Raman peak of glycine, ν (C— N), changes with time at different temperatures (a): 270 ℃; (b): 280 ℃; (c): 290 ℃ |
水热液化过程中, 甘氨酸特征拉曼峰的强度随热解反应时间的增加而降低。 不同官能团的特征峰强度随时间变化的规律总结在图7中。 如图7所示, 在固定温度的水热反应过程中, 各键的峰值强度随反应时间的延长不断减弱。 对于同一种振动模式, 水热反应的温度越高, 峰值强度随时间衰减越快, 其中C— C伸缩振动衰减最明显, 290 ℃反应10 min后, C— C伸缩振动强度衰减迅速直到基本消失, 表示溶液中此官能团基本全部分解。 相比较而言, ν (C— N)和ν as(COO-)峰强随时间的衰减速率较缓。 在290 ℃温度下, 由于荧光的影响ν (C— N)拉曼峰无法采集, 但ν as(COO-)拉曼峰强衰减明显加速, 说明290 ℃是趋于将此官能团热解的临界温度。
 | 图7 甘氨酸特征拉曼峰强度随时间的变化 (a): ν (C— C); (b): ν (C— N); (c): ν as(COO-)Fig.7 The intensity of characteristic Raman peaks of glycine change with time (a): ν (C— C); (b): ν (C— N); (c): ν as(COO-) |
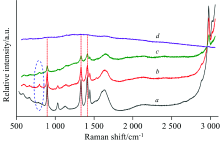
在完成每段试验后, 降温至室温再运用拉曼光谱分析反应腔内是否有未分解的甘氨酸产物。 图8b— d中分别示出了经过270, 280和290 ℃实验后检测产物的拉曼光谱, 为了更好地比较, 反应前室温下甘氨酸溶液拉曼光谱也包括其中(图8a)。 从图8中可以看到, 在经过270和280 ℃反应10 min后的产物中, 依旧可以检测到甘氨酸的三组特征峰(图中虚线示出), 说明甘氨酸未得到充分热解。 明显地, 特征峰的强度随着温度的升高而降低(图8b, c), 到290 ℃时则完全消失(图8d)。 说明温度升高会加速甘氨酸的液化过程, 290 ℃条件下反应10 min后, 甘氨酸已趋于完全热解。
为进一步认识甘氨酸液化反应的动力学过程, 选取甘氨酸骨架碳链的特征振动模式, ν (C— C), 进行定量分析。 大量的研究指出, 拉曼散射的强度(I)在一定条件下与入射光强和待测样品浓度(c)成正比[14]。
在水热液化反应过程中, 待测样品的浓度是反应时间的函数。 根据Avrami模型[15]可进一步描述为
其中, It为反应中某时刻的拉曼强度, I0为恒温状态下的初始拉曼强度, k为反应速率, n为反应级数, t表示反应时间(s), Q是反应活化能(kJ· mol-1), R表示摩尔气体常数[8.314 J· (mol· K)-1], T为温度(K), A为物质相关的指前系数。
假定反应为二级反应(n=2), 对式(2)和式(3)分别进行对数运算, 得到
运用实验中测得的It/I0~t数据, 通过式(4)进行线性回归拟合(图9), 得到k值。 相关数据示于表1中。
| 表1 不同温度下ν (C— C)的拟合数据 Table 1 Fitting reaction constants of ν (C— C) at different temperatures |
通过式(5), 将获取的不同温度下的反应速率数据进行lnk~1/RT拟合(图10), 其曲线斜率便是反应过程的反应活化能, 拟合计算的结果为357 kJ· mol-1, R2=0.92。
 | 图10 C— C振动拉曼峰的lnk-1/RT拟合曲线, 曲线斜率即为此官能团的水热液化反应活化能Fig.10 lnk-1/RT fitting curve of C— C stretching Raman peak. The slope of the curve is the activation energy for its hydrothermal liquefaction |
这里需要指出的是, 在将样品封装在密封反应管的这类实验研究中, 实验压力会随着温度的提升而升高。 而压力对于官能团水热液化的影响会以活化体积乘积的形式包含在测定的活化能之中。 由于实验中的压力值无法准确地度量, 压力的影响效应难以定量地予以估计。
(1)运用原位拉曼光谱分析技术, 获取了5 Wt% 甘氨酸溶液在270, 280和290 ℃水热反应过程中的相关官能团变化的拉曼光谱, 通过分析不同温度下ν (C— C), ν (C— N), ν as(COO-)拉曼峰强度随时间的衰减, 深入了解藻类生物质能水热液化中的转化速率。
(2)进一步地分析了甘氨酸水热液化反应的动力学过程, 通过C— C伸缩振动拉曼峰值强度定量计算出270~290 ℃温度下反应速率常数k值, 并通过k值随温度变化的规律, 计算得到该官能团液化分解的活化能为357 kJ· mol-1。 通过分析甘氨酸水热反应后产物的拉曼光谱, 发现甘氨酸的完全水热液化温度约为290 ℃。
致谢: 衷心感谢高悦、 赵霞在实验过程中的技术指导, 陈姜智、 熊梦君关于文章提出的宝贵建议。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|