作者简介: 范丹阳, 1996年生, 福州大学材料科学与工程学院硕士研究生 e-mail: 401964770@qq.com
上转换纳米粒子(UCNPs)因其具有强生物穿透性、 大斯托克位移、 良好的光稳定性和生物相容性等优点而被广泛应用于生物医药分析领域。 通过聚丙烯酸(PAA)对油酸(OA)配体的上转换纳米粒子(OA-UCNPs)进行表面改性得到亲水性纳米粒子 PAA-UCNPs, 再通过酰胺化反应将适配体(Apt)共价偶联到PAA-UCNPs表面得到Apt-UCNPs并将其作为能量供体, 以黑洞猝灭剂(BHQ1)作为能量受体, 构建了一种基于荧光共振能量转移特异性检测磺胺二甲氧嘧啶(SDM)的方法。 通过红外光谱(FTIR)及扫描电镜(SEM)对OA-UCNPs、 PAA以及PAA-UCNPs的结构和性能进行了表征。 从红外光谱中可以看出, 相比较于OA-UCNPs, PAA-UCNPs于1 722 cm-1处出现了新峰, 可能为PAA的-C=O伸缩振动峰, 且在3 400 cm-1附近存在的宽带可能归因于PAA中O—H伸缩振动; 从扫描电镜实验结果可以看出, PAA修饰前分散在环己烷中的OA-UCNPs尺寸约为31 nm, 而PAA修饰后分散在水溶液中的UCNPs直径约为49 nm。 分析认为长链的PAA分子体积比油酸分子大, 因此包覆在UCNPs表面会使其尺寸增加, 以上结果均表明PAA可能已被修饰到UCNPs表面。 通过紫外可见光谱对Apt-UCNPs、 Apt及PAA-UCNPs的结构进行了表征。 结果发现相对于PAA-UCNPs, Apt-UCNPs的紫外吸收光谱在260 nm处出现了较明显的Apt特征吸收峰, 这表明适配体可能已被修饰到UCNPs表面。 对Apt-UCNPs用于检测SDM的机理进行了初步探讨, 结果发现Apt-UCNPs在540 nm的发射峰与BHQ1的吸收峰发生重叠, 表明Apt-UCNPs上的能量可通过共振能量转移效应转移到BHQ1使得Apt-UCNPs的荧光被猝灭。 对猝灭剂BHQ1的浓度进行了优化, 结果表明当BHQ1浓度为15 μmol·L-1时, 荧光猝灭效率为55%。 在最佳实验条件下, 相对荧光强度与SDM浓度(150~1 000 ng·mL-1)之间具有良好的线性关系, 选取与SDM 结构相似的磺胺吡啶和磺胺醋酰作对照实验, 发现尽管磺胺吡啶和磺胺醋酰的浓度达到了 500 ng·mL-1, 但其检测体系中相较于加入SDM后的荧光强度恢复程度仍然较低, 这说明该检测方法可对SDM有特异性识别作用。
Due to the strong biological penetration, large stoke shift, good photostability and biocompatibility, up-conversion nanoparticles (UCNPs) were widely used in biomedical analysis. In this study, OA-UCNPs, which are UCNPs with oleic acid (OA) as ligand, were modified by polyacrylic acid (PAA)in order to prepare hydrophilic nanoparticles PAA-UCNPs, and then aptamers (Apt) were covalently coupled to the surface of PAA-UCNPs by amidation reaction to obtain Apt-UCNPs. A method for specific detection of sulfadimethoxine (SDM)was constructed by using Apt-UCNPs as energy donors and black hole quencher (BHQ1) as an energy acceptor fluorescence resonance energy transfer. The structure and performance of UCNPs, PAA and PAA-UCNPs were characterized by infrared spectroscopy (FTIR) and scanning electron microscope (SEM). The results of FTIRshowed that compared with UCNPs, PAA-UCNPs appeared at a new peak at 1 722 cm-1 which was attributed to the -C=O stretching vibration peak of PAA, and the wide band around 3 400 cm-1 attributed to the O—H stretching vibration of PAA; the results of the SEM test indicated that the size of UCNPs and PAA-UCNPs was 31 and 49 nm, respectively. It may be because the molecular volume of long-chain PAA is larger than that of oleic acid, so coating on the surface of UCNPs will increase its size, and the above results indicated PAA may have had been modified to the surface of UCNPs. The structure and properties of Apt-UCNPs, Apt and PAA-UCNPs, were characterized by ultraviolet-visible spectroscopy. It was found that compared with PAA-UCNPs, Apt-UCNPs had a more obvious Apt characteristic absorption peak at 260 nm, which showed that the aptamer could have been modified to the surface of UCNPs. In addition, the mechanism of using Apt-UCNPs to detect SDM was also discussed. The results showed that the emission peak of Apt-UCNPs at 540 nm overlapped with the absorption peak of BHQ1, which indicated that the energy on Apt-UCNPs can be transferred to BHQ1 through the fluorescence resonance energy transfer effect so that the fluorescence of Apt-UCNPs could be quenched. The concentration of BHQ1 in the detection system was optimized and the results showed that when the concentration of BHQ1 was 15 μmol·L-1, the fluorescence quenching efficiency was as high as 55%. Under the best experimental conditions, there was a good linear relationship between the relative fluorescence intensity and the SDM concentration (150~1 000 ng·mL-1).The analogues of SDM (sulfapyridine and sulfacetamide)were selected as control experiments. It was found that although the concentration of sulfapyridine and sulfacetamide reached 500 ng·mL-1, the fluorescence intensity recovery in the system was less, which indicated that the detection method could specifically recognize SDM.
磺胺二甲氧嘧啶(SDM)是一种常见的抗菌感染药物, 在世界各地广泛用于预防或治疗家禽疾病。 由于过度使用, 其在环境中的残留可能会对人体造成危害。 较为常用的检测磺胺二甲氧嘧啶的方法有高效液相色谱(HPLC)[1]、 高效毛细管电泳(CE)[2]和液相色谱-电喷雾电离-串联质谱(LC-ESI-MS)[3]等, 虽然现有方法具有一定的可靠性与准确性, 但大多具有仪器较昂贵、 难操作、 耗时久或样品预处理繁琐等缺点, 限制了在SDM检测上的应用, 因此有必要开发新的检测方法克服现有检测技术上的不足。
近年来, 荧光探针由于其低检测限、 检测速度快、 不依赖复杂仪器而在检测领域受到广泛应用。 Chen[4]等采用一种基于适配体与量子点用于检测SDM的荧光传感器, 通过静电作用, 使适配体(Aptamer)和聚二烯丙基二甲基氯化铵(PDDA)形成双链, 阻碍了PDDA对量子点荧光的猝灭, 但适配体与SDM的特异性结合可能导致游离的PDDA释放, 导致荧光被淬灭, 从而实现对水样和鱼类样品中残留SDM的快速检测。 然而现有用于检测SDM的方法大部分使用有机染料或量子点, 通常具有光化学稳定性差和光漂白等缺点, 且在紫外可见光激发下还会受到生物样品基质的背景干扰, 限制了其在复杂样品基质中的使用。 与传统的荧光团相比, 上转换纳米粒子(UCNPs)具有独特的优势, 例如高的生物穿透性、 窄的发射峰、 大的斯托克位移[5]等优点, 因此具有用作荧光探针的巨大潜力, 进而被广泛用于各种物质的检测, 例如毒素[6]、 细菌[7]、 农药[8]及抗生素[9]等, 但目前有关于UCNPs用于SDM检测的研究仅见Liu等[10]利用沉积在适配体功能化后的磁性纳米粒子的表面上的UCNPs与SDM间的亲和性及磁性纳米粒子易于分离的优点, 构建了一种对SDM的特异性且高灵敏度复合荧光探针, 但该复合探针的制备及检测过程较为繁琐, 因此开发出简便易于操作用于检测SDM的上转换纳米材料探针仍是一项挑战。
针对现有检测 SDM 的技术问题, 合成了氯化镱、 氯化钇、 氯化铒作为稀土原料, 油酸(OA)作为配体的上转换纳米粒子(OA-UCNPs), 对其进行表面羧基功能化后得到亲水性上转换纳米粒子 PAA-UCNPs, 再将其进行适配体功能化得到偶联适配体的上转换纳米粒子(Apt-UCNPs), 构建了基于Apt-UCNPs的检测体系, 并针对共振能量转移效应(FRET)与碱基互补配对原则对检测机理进行了探讨, 验证了检测方法的可行性; 该检测体系克服了传统方法的不足, 具有操作简便、 耗时少且不依赖昂贵仪器的优点, 并对于磺胺二甲氧嘧啶的检测具有特异性, 实现了对SDM的特异性检测, 为磺胺二甲氧嘧啶的检测提供了简便且有效的方法。
FluoroMax-4型荧光光谱仪(法国HORIBA Jobin Yvon公司); 2450型紫外-分光光度计(日本岛津公司); Nicolet 5700型傅里叶红外光谱仪(美国热电公司); SUPRA 55型场发射扫描电子显微镜(德国卡尔蔡司有限公司)。
氢氧化钠(NaOH)、 无水乙醇(C2H5OH)、 环己烷(C6H12)、 六水氯化钇(YCl3· 6H2O)、 六水氯化镱(YbCl3· 6H2O)、 六水氯化铒(ErCl3· 6H2O)、 油酸(OA)、 1-十八烯(ODE)、 甲醇(CH3OH)、 氟化铵(NH4F)、 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、 N-羟基硫代琥珀酰亚胺钠盐(sulfo-NHS)、 二甲基亚砜(DMSO)均购于阿拉丁化学试剂有限公司; 氩气(Ar2)购于福州华鑫达气体有限公司; 聚丙烯酸(PAA)、 一缩二乙二醇(DEG)、 甲苯(C7H8)、 氯化钠(NaCl)、 氯化钾(KCl)、 氯化镁(MgCl2)均购于国药集团化学试剂有限公司; SDM适配体(序列: NH2-GAG GGC AAC GAG TGT TTA TAG A-3)、 黑洞猝灭剂cDNA-BHQ1(序列: 5'-CGT TGC CCT C-BHQ1)均购于上海生工生物工程股份有限公司, 无特殊说明, 试剂纯度为分析纯。
实验所用水为超纯水, 所用缓冲液配制: 20 mmol· L-1 Tris-HCl, 50 mmol· L-1 NaCl, 5 mmol· L-1 KCl, 5 mmol· L-1 MgCl2, pH 8.0。
根据文献[11]合成了PAA-UCNPs, 并做了少量修改: 将0.78 mmol的YCl3· 6H2O、 0.2 mmol的YbCl3· 6H2O和0.02 mmol的ErCl3· 6H2O加入至100 mL三口烧瓶中, 再加入21 mL的OA/ODE为6∶ 15的溶液, 通入氩气后在磁力搅拌下缓慢升温至110 ℃除水10 min, 然后加热至160 ℃保温30 min, 直到稀土氯化盐完全溶解。 冷却后加入10 mL溶有4 mmol NH4F和2.5 mmol NaOH的甲醇, 于50 ℃保温30 min, 再升温至80 ℃除去甲醇溶液, 然后将混合溶液快速加热到300 ℃下保温1.5 h。 加入乙醇沉降后, 离心收集得到OA-UCNPs纳米粒子。
在100 mL三口瓶中加入200 mg的PAA, 再倒入30 mL的DEG, 将混合物加热至110 ℃, 形成澄清溶液。 缓慢加入分散有50 mg 的OA-UCNPs纳米晶体的2 mL甲苯溶液, 并在氩气保护下将温度升高至130 ℃保持10 min除去甲苯, 然后将溶液升高至一定温度回流保温一段时间。 反应完后将所得溶液冷却至室温, 并加入0.2 mol· L-1的NaCl溶液以使粒子沉淀。 最后将粒子离心出来, 得到PAA-UCNPs。
将200 μ L EDC(0.2 mol· L-1)和400 μ L sulfo-NHS(0.2 mol· L-1)添加到2.5 mL含有4 mg PAA-UCNPs的DMSO中。 将10 μ L 100 μ mol· L-1的适配体加到该分散液中, 并在室温下搅拌18 h。 将分散液离心并用DMSO洗涤两次以去除未结合的适配体, 然后分散在4 mL的Tris缓冲液中。
分别向浓度为0.5 mg· mL-1 的Apt-UCNPs溶液中加入不同浓度的cDNA-BHQ1(2.5, 5, 7.5, 10, 15 μ mol· L-1), 于30 ℃下孵育过夜, 然后在980 nm激发光下测试其荧光强度。
分别向分散在Tris缓冲液中的Apt-UCNPs加入不同浓度的SDM(150, 300, 600, 1000 ng· mL-1), 于30 ℃孵育3 h, 然后分别加入cDNA-BHQ1, 继续孵育3 h, 并在980 nm激发光下测试其荧光强度。 为了考察Apt-UCNPs对SDM的特异性识别作用, 在不改变其他实验条件的情况下, 将SDM替换成磺胺醋酰和磺胺吡啶, 并在980 nm激发光下测试其荧光强度。
2.1.1 UCNPs与PAA-UCNPs的表征
对PAA(图1a)、 OA-UCNPs(图1b)与PAA-UCNPs(图1c)进行了红外光谱分析。 从图中可以看到, 由于油酸的存在, 2 925和2 856 cm-1处对应于油酸链— CH2的对称和不对称伸缩振动峰, 在1 561和1 456 cm-1出现的红外峰, 被确定为— COO— 的对称和不对称伸缩振动[12], 而1 110 cm-1处的峰则对应于羧基的C— O伸缩振动峰。 在PAA配体交换后, 3 400 cm-1附近的宽带表征了PAA中羧基的O— H强伸缩振动, 2 925和2 856 cm-1对应于油酸基团的峰强度变小, 且于1 722 cm-1处出现了新的峰, 属于PAA的-C=O伸缩振动, 并且1 110 cm-1对应于羧基C— O的峰强度也随之增强。 根据这些实验结果, 推测可能已经完成了PAA对OA-UCNPs的交换配体改性。
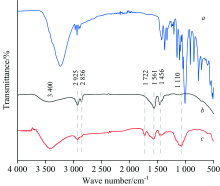 | 图1 PAA, OA-UCNPs和PAA-UCNPs的红外光谱图 a: PAA; b: OA-UCNPs; c: PAA-UCNPsFig.1 FTIR spectra of PAA, OA-UCNPs and PAA-UCNPs a: PAA; b: OA-UCNPs; c: PAA-UCNPs |
对OA-UCNPs[图2(a)]和PAA-UCNPs[图2(b)]进行了扫描电镜测试。 从图中可以看出, PAA修饰前分散在环己烷中的OA-UCNPs尺寸约为31 nm, 而PAA修饰后分散在水溶液中的UCNPs直径约为49 nm。 这可能是由于长链的PAA分子体积比油酸分子大, 因此包覆在UCNPs表面会使其尺寸增加, PAA的修饰使得UCNPs具有较好的水分散性, 良好的水分散性及经过PAA改性后UCNPs表面带有的基团为后续的应用提供了条件。
2.1.2 Apt-UCNPs的表征
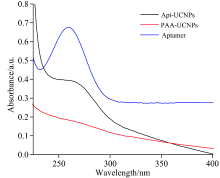
为了验证适配体已经结合至PAA-UCNPs表面, 分别测试了PAA-UCNPs、 Apt-UCNPs和Aptamer在220~400 nm范围内的紫外吸收光谱, 结果如图3所示。 从图3可以看出, Aptamer在260 nm附近有一个吸收峰, 为适配体的特征吸收。 而PAA-UCNPs的曲线在该范围内无明显吸收峰, 与适配体反应后所得的Apt-UCNPs于260 nm处也出现了较明显的吸收峰, 这个峰可以归属于适配体的特征吸收, 证明了SDM适配体已偶联到UCNPs上。
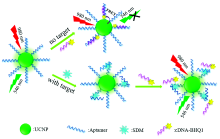
Apt-UCNPs用于检测SDM的机理如图4所示。 上转换纳米粒子用作产生信号的能量供体, BHQ1用作接收信号的能量受体, 适配体用作识别剂。 在没有SDM的情况下, Apt-UCNPs表面的适配体链和带有猝灭荧光基团的互补DNA(cDNA)由于碱基互补配对原则互相结合, 使BHQ1与Apt-UCNPs的距离很近[13], 从而进行荧光猝灭, 而当环境中存在SDM时, 适配体优先与其结合, 导致cDNA-BHQ1远离Apt-UCNPs, 使得Apt-UCNPs的荧光恢复。 根据Apt-UCNPs荧光的恢复程度可以用于定量检测SDM的浓度。
为了证实检测方案的可行性, 考察了SDM的检测机理, 由图5可知Apt-UCNPs在540 nm处有明显发射峰, 使其在980 nm激发光下肉眼可见明显绿光, 并且发射峰与BHQ1的吸收峰重叠, 这表示Apt-UCNPs上的能量通过共振能量转移效应转移到BHQ1上是具有可行性的[14], 而Apt-UCNPs位于660 nm处的发射峰与BHQ1的吸收峰几乎没有重叠, 所以BHQ1对660 nm处的荧光发射影响很小。
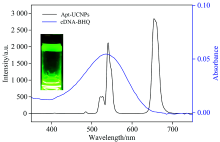 | 图5 Apt-UCNPs的荧光光谱和cDNA-BHQ1的吸收光谱Fig.5 Fluorescence spectra of Apt-UCNPs and absorption spectra of cDNA-BHQ1 |
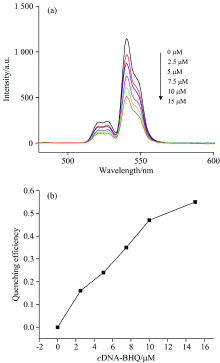
为使检测条件达到最优, 优化了检测体系中猝灭剂的浓度。 在相同浓度的Apt-UCNPs中加入不同浓度cDNA-BHQ1, 孵育一段时间后, 使用980 nm的激发光分别检测其荧光强度, 并考察cDNA-BHQ1浓度对Apt-UCNPs荧光猝灭的影响。 如图6(a)可知, 随着cDNA-BHQ1浓度的增大, Apt-UCNPs位于540 nm处的发射峰强度不断减小, 而660 nm处的峰变化不大; 反之, Apt-UCNPs的荧光猝灭效率随着cDNA-BHQ1浓度的增加而增加[图6(b)]。 当cDNA-BHQ1浓度达到15 μ mol· L-1时, 荧光强度猝灭达55%, 此时猝灭效率的趋势已经逐渐平缓, 这可能是由于UCNPs表面的适配体已基本与cDNA-BHQ1结合, 因此继续增加cDNA-BHQ1的量对其荧光强度的猝灭效果减小。 综合上述原因, 选用浓度为15 μ mol· L-1的cDNA-BHQ1进行后续的实验。
2.3.1 检测体系用于SDM的识别
考察了传感器检测SDM的灵敏度, 其结果如图7(a)所示, 在一定的浓度范围内(150~1 000 ng· mL-1), SDM的浓度与Apt-UCNPs位于540 nm处发射峰的强度为正相关。 根据540 nm处Apt-UCNPs荧光强度的恢复程度, 得到相对荧光强度(F-F0)/F0与SDM浓度的线性关系, 其结果如图7(b)所示, 其中F0和F分别代表不存在和存在SDM情况下Apt-UCNPs的荧光强度。 从图中可以看出, SDM的浓度与相对荧光强度在150~1 000 ng· mL-1范围内具有较好的线性关系, 线性相关系数拟合结果为R2=0.917 28。
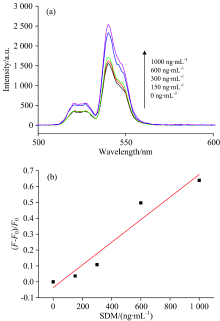 | 图7 不同浓度SDM下Apt-UCNPs的(a)荧光光谱和(b)标准曲线Fig.7 (a) Fluorescence spectra and (b) standard curve of Apt-UCNPs under different concentrations of SDM system |
2.3.2 特异性分析
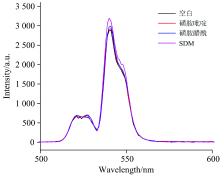
选取了与SDM结构相似的磺胺吡啶和磺胺醋酰作为对照实验测试Apt-UCNPs的特异性识别功能, 结果如图8所示, 尽管磺胺吡啶和磺胺醋酰的浓度达到了500 ng· mL-1, 体系中的荧光强度恢复仍然较少, 分析认为SDM适配体对SDM的高度亲和力, 能阻止Apt-UCNPs与cDNA-BHQ1之间FRET的发生, 而对其他结构类似物, 适配体的亲和力相对较低, 因此荧光强度变化较小, 证明了Apt-UCNPs传感器对SDM具有较高的特异性识别作用。
以适配体功能化上转换纳米粒子(Apt-UCNPs)作为能量供体, 以黑洞猝灭剂(BHQ1)作为能量受体, 构建了一种基于荧光共振能量转移的特异性检测磺胺二甲氧嘧啶(SDM)的方法。 通过FTIR, 和SEM对PAA-UCNPs和Apt-UCNPs的结构和性能进行了表征; 使用紫外分光光度计对PAA-UCNPs, Apt-UCNPs和Aptamer进行了表征。 对猝灭剂BHQ1的浓度进行了优化, 结果表明当BHQ1浓度为15 μ mol· L-1时, 荧光猝灭效率为55%且基本达到平衡, 且当SDM 浓度为150~1 000 ng· mL-1时, Apt-UCNPs于540 nm处发射峰的相对荧光强度与SDM浓度线性相关(R2=0.917 28)。 为了考察Apt-UCNPs对SDM特异性识别作用, 选取与SDM结构相似的磺胺吡啶和磺胺醋酰作为研究对象做对照实验。 结果发现, 当磺胺吡啶和磺胺醋酰的浓度为500 ng· mL-1时, 体系中的荧光强度仍恢复较少, 而当浓度为300 ng· mL-1 SDM加入到体系中时, Apt-UCNPs的荧光信号增强更多, 说明Apt-UCNPs检测体系对SDM具有较好的特异性识别作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|