作者简介: 陈家敏, 1994年生, 贵州医科大学公共卫生与健康学院硕士研究生 e-mail: cjm9969@163.com
刺梨是蔷薇科蔷薇属多年生落叶灌木, 其果实富含多种生物活性物质, 具有重要的药食用价值。 采用近红外、 紫外-可见、 激发发射三维荧光光谱技术系统性表征刺梨鲜果提取物化学组成, 探讨不同产地的301个批次刺梨果中总酚、 总黄酮、 总三萜类物质的含量与自由基清除能力、 铁离子还原能力等抗氧化活性的分布特征。 结果显示刺梨果中具有高含量的酚类、 黄酮类、 三萜类物质, 分别为9.23~37.45, 8.80~27.96和6.91~22.62 mg·g-1 FW(新鲜刺梨果的重量)。 刺梨果具有较好的自由基清除活性和还原能力, 对1,1-二苯基-2-三硝基苯肼(DPPH)清除率为14.39%~83.19%、 2,2'-联氮基-双-(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(ABTS)清除率18.50%~68.45%、 对铁离子还原能力(FRAP)0.08~0.44 mmol·L-1 TE·g-1 FW。 这些物质含量与活性指标数据均服从正态分布, 表明实验用的多批次刺梨样本具有多样性、 代表性、 随机性, 并且不同产地的样本提取物的活性成分含量及抗氧化活性没有显著的统计学差异性。 提取物样本的紫外-可见、 近红外、 荧光光谱都具有明显的谱带特征, 其光谱数据的主判别变量模型可有效鉴别八个不同产地的刺梨样本。 研究表明多光谱技术能够表征提取物的物质组成, 可对刺梨鲜果进行快速检测、 品质差异判别与产地溯源, 为刺梨质量评价、 选种和资源开发提供参考。 植物提取物的总酚、 总黄酮等活性成分含量、 抗氧化活性等指标不能准确反映样本的活性物质组成特征性, 不能用于样本产地溯源分析。
Rosa roxburghii Tratt. (RRT) is a perennial deciduous shrub of Rosa genus in Rosaceae. Its fruit has specific nutritional and medicinal values due to a variety of bioactive ingredients present in a substantial amount. This study used NIR, UV-Vis and fluorescence spectroscopies to characterize the chemical composites of the RRT fruit extracts in 301 batches from different planting origins. Meanwhile, the distribution characteristics of the contents of total phenols (TPC), total flavonoids (TFC), and total triterpenoids (TTC) in the extracts were not only discussed, but also the antioxidant activities concerning free radical scavenging capacity and ferric reducing antioxidant power, concerning the DPPH, ABTS and FRAP assays. Results showed high TPC, TFC and TTC in RRT fruit, as were 9.23~37.45, 8.80~27.96 and 6.91~22.62 mg·g-1 FW, respectively, which possibly led to a pretty good free radical scavenging capacity and reducing power. The scavenging rate of DPPH ranged between 14.39%~83.19%, the scavenging rate of ABTS was 18.50%~68.45%, and FRAP varied in 0.08~0.44 mmol·L-1 TE·g-1 FW. The statistical analysis indicated that all the individual TPC, TFC, TTC, DPPH, ABTS, and FRAP values from 301 batches were normally distributed. The samples used in the study might be pooled from the population and thus diverse, representative, and random. There was no significant statistical difference in the contents of active composites and antioxidant activities of the extracts regardless of the planting origins. All the UV-Vis-NIR and fluorescence spectra had characteristic bands. The resultant principal discriminant variate (PDV) models were able to identify the samples from eight planting origins from each other. When combined with the PDV models the UV-Vis, NIR and fluorescence spectroscopies could be used for compositional characterization, rapid detection and discrimination of the extracts. This work provided a new idea for the quality evaluation, strain selection and resource development of RRT, among other medicinal-edible plants. However, it was neither reliable at all through testing the contents of active constituents and antioxidant activities of RRT samples to determine the compositional information of plant extracts, nor possible for the origin traceability purpose.
刺梨(Rosa roxburghii Tratt.)又名山王果、 木梨子, 属于蔷薇科蔷薇属多年生落叶灌木, 主要分布在我国云贵川高原地区, 以贵州省资源最为丰富, 年产量最高[1]。 刺梨为药食同源类植物, 其果实富含维生素 C、 超氧化物歧化酶、 过氧化物酶、 多酚、 黄酮、 多糖、 三萜、 氨基酸以及微量元素等多种活性成分[2, 3]。 其中, 多酚含量高达15.93 mg· g-1, 黄酮含量平均约为6.80 mg· g-1, 主要包括(表)没食子儿茶素、 槲皮素、 山萘酚、 及其衍生物等。 这些物质具有多种药理活性, 使得刺梨具有很高的食品与临床药用价值和良好的应用前景, 也是植物化学的研究热点[1, 4]。 目前, 刺梨产业是贵州全省重点发展产业之一。 挖掘其潜在价值, 助推脱贫攻坚, 使刺梨产业发展迎来新的浪潮。
近红外光谱是一种绿色快速无损的检测技术, 已成功应用于食品药品质量分析。 三维荧光光谱能够提供荧光强度随激发或发射波长变化的图谱信息, 是一种较为成熟的分析技术, 在食品安全、 环境检测等方面得到了广泛的应用。 气候、 水分、 土壤等环境生长条件以及种植方法对植物的活性成分有着重要的影响。 产地不同的刺梨果活性成分含量不同, 品质亦存在差异[5]。 刺梨果中的很多活性成分具有荧光特征与近红外区域的吸收。 目前刺梨的光谱研究仅有紫外-可见、 红外光谱的相关报道[3]。 但有关的近红外、 荧光光谱技术检测多批次刺梨的应用研究仍处于空白。
通过测定刺梨果中总酚(total phenolic content, TPC)、 总黄酮(total flavonoid content, TFC)、 总三萜(total triterpenoid content, TTC)的活性成分含量, 以及1, 1-二苯基-2-三硝基苯肼(DPPH)、 2, 2'-联氮基-双-(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(ABTS)自由基清除率、 铁离子还原能力(ferric reducing antioxidant power, FRAP), 统计分析不同产地刺梨样本的活性成分含量及抗氧化活性的差异, 探讨活性数据的分布特征。 采用紫外-可见、 近红外、 激发发射荧光光谱技术表征刺梨提取物样本物质组成, 并建立样本差异性判别模型, 实现不同产地不同批次刺梨样本的快速溯源与品质鉴别, 为刺梨的优选、 培育提供借鉴与参考。
原料: 301个不同批次的成熟刺梨鲜果分别采摘或购买于贵州安顺(AS)、 龙里(LL)、 六盘水(LPS)、 毕节(BJ)、 铜仁(TR)、 黔西(QX)、 贵定(GD)、 贵阳(GY)八个刺梨种植基地或产地(表1)。 品种主要为贵农5号刺梨, 以及10个安顺金刺梨(ASJ)样本。
| 表1 实验所用的刺梨样本信息 Table 1 Sample information of RRT fruits used in this study |
试剂: 福林-酚试剂(北京索莱宝科技有限公司); 2, 4, 6-三吡啶基三嗪(TPTZ)、 1, 1-二苯基-2-三硝基苯肼(DPPH)、 2, 2'-联氮基-双-(3-乙基-苯并噻唑啉-6-磺酸)(ABTS)(上海源叶生物科技有限公司); 水溶性维E(Trolox)(阿拉丁试剂有限公司); 没食子酸、 芦丁、 熊果酸(HPLC≥ 98%)(南京草本元生物科技有限公司)。
紫外-分光光度计(UV-1700pls, 上海美析仪器有限公司); 荧光分光光度计(F97pro, 上海棱光技术有限公司); 近红外光谱仪(IAS-3120, 无锡迅杰光远科技有限公司); 酶标仪(1510, 芬兰Thermo Fisher公司); 超声波清洗器(KM-500DE, 昆山美美超声仪器有限公司); 榨汁机(MIUI, 宁波采臣电器有限公司)。
1.3.1 样本制备
刺梨鲜果样本, 洗净、 风干、 去除不可食用部分, 切碎混匀称取100 g, 用榨汁机打碎、 渣汁混匀备用。 称取刺梨匀浆样本20 g, 置于烧杯中, 加入甲醇提取, 超声功率500 W、 30 ℃条件下提取60 min。 用甲醇分别以料液比1∶ 2, 1∶ 2, 1∶ 1提取三次, 合并提取液, 得刺梨甲醇提取物样本。 刺梨提取液使用前过0.45 μ m有机滤膜。
1.3.2 成分与活性测定
总酚含量测定: 分别取50 μ L九个浓度水平的没食子酸标准液(0.00~0.20 mg· mL-1)以及提取物稀释液, 置于棕色EP管中, 加入50 μ L福林-酚试剂反应10 min, 再与200 μ L的20% NaCO3溶液反应20 min。 取200 μ L反应液置于酶标板上, 以色谱纯甲醇为空白, 765 nm波长处测定吸光度[6]。 没食子酸计总酚的含量, 以鲜重表示, 单位为 mg· g-1 FW。
总黄酮含量测定: 分别取25 μ L八个浓度水平的芦丁标准液(0.00~1.00 mg· mL-1)以及样品稀释液置于棕色EP管中, 加入110 μ L 0.066 mol· L-1的NaNO2溶液混匀反应5 min, 再加15 μ L 0.75 mol· L-1的氯化铝溶液反应6 min, 加入100 μ L 0.5 mol· L-1的NaOH溶液, 静置10 min后, 取200 μ L反应液置于酶标板上, 以色谱纯甲醇为空白, 510 nm处测定吸光度[7]。 总黄酮含量以芦丁计, 以鲜重表示, 单位为 mg· g-1 FW。
总三萜含量测定: 取50 μ L的样品稀释液或梯度量(0, 100, 200, 300, 400, 500和600 μ L)熊果酸标准液(0.1 mg· mL-1)于棕色EP管中, 90 ℃水浴挥发溶剂, 60 ℃烘箱烘干试管, 加入0.2 mL 5%香草醛-冰醋酸溶液、 0.6 mL高氯酸60 ℃水浴反应15 min, 冷却后加2.2 mL冰醋酸混匀, 移取200 μ L反应液于酶标板上, 以甲醇溶液为空白, 548 nm处测定吸光度[8]。 总三萜酸含量以熊果酸计, 以鲜重表示, 单位为 mg· g-1 FW。
DPPH自由基清除能力测定[6]: 制备0.00~0.08 mg· mL-1八个浓度水平的Trolox标准液与样品稀释液。 分别取50 μ L置于棕色EP管中, 加入400 μ L DPPH-甲醇溶液(100 μ mol· L-1), 摇匀后在25 ℃条件下反应30 min。 移取200 L反应液于酶标板上, 517 nm处测量吸光度。
ABTS自由基清除能力测定: 制备七个浓度水平的Trolox标准液与样品稀释液, 分别取50 μ L置于棕色EP管中, 加入400 μ L的ABTS· +工作液, 充分混合后在室温下避光反应30 min, 在734 nm处测量吸光度[9]。
用式(1)分别计算样品对DPPH, ABTS· +自由基的清除率。 式(1)中Ai为样品溶液加DPPH或ABTS· +工作液的吸光度; Aj为样品溶液加甲醇的吸光度; Ac为甲醇加DPPH或ABTS· +工作液的吸光度。
FRAP测定[7]: 制备九个浓度水平的Trolox标准液与样品稀释液, 分别取30 μ L置于棕色EP管中, 加入900 mL新配置的FRAP试剂混匀, 在室温下避光孵育30 min后, 在593 nm处测定反应混合物的吸光度, 结果以鲜重表示, 即mmol· L-1 TE· g-1 FW。
近红外光谱: 光谱仪预热1 h后, 以空白比色皿为参比扣除背景后, 取适量提取液于1 mm石英比色皿中。 光谱采集波长范围900~1 700 nm; 光学分辨率为12.87 nm; 每个样本扫描100次取平均光谱。
激发发射荧光光谱: 激发波长240~750 nm, 波长扫描间隔2 nm; 发射波长260~750 nm, 波长间隔10 nm。 取提取液适量置于10 mm石英皿中, 扫描荧光光谱。
紫外-可见光谱: 光谱仪开机预热15 min后, UV-Vis光谱采集波长范围190~1 100 nm; 扫描间距1 nm; 精度50。 以纯甲醇为空白, 10 mm石英比色皿测定提取液的紫外-可见光谱。
各样本重复制样3次, 每次实验分别测定其活性成分含量、 抗氧化活性、 近红外、 紫外-可见及荧光光谱, 取3次实验所得数据平均值或平均光谱用于数据分析。
八个产地301个不同批次刺梨鲜果的甲醇提取物样本中富含酚类、 黄酮类、 三萜类物质, 其含量分别为9.23~37.45, 8.80~27.96和6.91~22.62 mg· g-1 FW(表1)。 不同产地不同批次的样本中活性成分含量差异较大, 最高含量几乎是最低含量的4倍。 样本的活性指标数据范围宽、 变化大: DPPH自由基清除率的范围是14.39%~83.19%, ABTS清除率为18.50%~68.45%, FRAP的当量范围0.08~0.44 mmol· L-1 TE· g-1 FW(表1)。
采用Kolmogorov-Smirnov方法检验提取物样本中总酚、 总黄酮、 总三萜含量和DPPH, ABTS, FRAP抗氧化活性指标数据的分布特征[10]。 以总酚含量为例进行讨论。 剔除10个金刺梨和5个刺梨异常值样本(采用正态分布四分位数法检测异常值), 对余下的286个样本的总酚含量进行正态性检验。 总酚含量的检验统计量对应的P值为0.20, 显著大于0.05的水平, 总酚含量的频数直方图与理论的正态分布曲线之间的Pearson相关系数(r)大于0.98, 表明提取物样本的总酚含量服从正态分布。 286个样本中的总酚含量的均值(mean)为18.99 mg· g-1 FW, 标准偏差(std)为3.51 mg· g-1 FW, 其相对变化程度达到18.46%, 如表2。
| 表2 刺梨提取物样本中活性成分及抗氧化活性的分布特征 Table 2 Description of phytochemicals and antioxidant activities of RRT extracts in terms of distributing characteristics |
实验证实了刺梨鲜果是较好的植物酚类物质来源。 检验其余5个指标数据的分布特征: 各统计量对应的P值均大于0.05的显著性水平, 基本上都服从正态分布, 它们的频数分布直方图均呈现出形状较为规则的或者近似的正态分布曲线(r≥ 0.97)(表2), 表明实验用的不同批次的刺梨样本具有多样性、 代表性、 随机性。
实验用刺梨鲜果主要来自贵州的五个种植基地: AS, BJ, GD, LL和LPS。 检验五个不同产地的刺梨样本提取物中活性成分含量与抗氧化活性的分布情况, 发现每个产地样本的每个指标数据均服从正态分布, 而且方差齐性。 例如, 五个产地的样本中总黄酮的平均含量约为15.00~16.00 mg· g-1FW, 其变化的偏差值不大, 毕节、 贵定、 龙里的刺梨黄酮含量略高些。 证明刺梨是较好的植物黄酮类物质来源。 t检验和方差分析结果表明不同产地的刺梨果提取物中总酚、 总黄酮、 总三萜含量及DPPH、 ABTS、 FRAP活性都没有统计学意义上的显著性差异。 即仅通过使用广泛用于定量测定植物提取物的总酚、 总黄酮、 总三萜、 DPPH、 ABTS、 FRAP等几个指标来衡量刺梨提取物的化学活性, 是不客观的, 也不够合适、 准确。
对301个样本提取物的六个含量与活性指标量测数据进行主成分分析。 5个主成分解释了100%的数据方差, 但主成分得分未能呈现出样本与地域相关的差异趋势, 甚至不能区别开10个属于不同品种的金刺梨样本, 即使它们的物质成分差异较大, 验证了这六个指标不能用于区别和判断不同产地样本的真实质量差别, 不能用于样本产地溯源分析。
总酚含量、 ABTS、 DPPH、 FRAP四个指标数据之间均有较大的相关性。 其中, 总酚含量与ABTS活性最相关(相关系数r=0.79), ABTS与FRAP 活性较好地正相关(r=0.72)。 总黄酮、 总三萜的含量与DPPH、 ABTS、 FRAP抗氧化活性的相关性不大。
理论上酚类物质含酚羟基数量越多, 其抗氧化活性越强。 研究认为物质的抗氧化活性取决于它们的整体结构, 以及侧基团的位置和类型[11]。 DPPH活性测定受OH数量影响大, 故福林酚法更适于测定抗氧化活性而并非总酚的含量, 这解释了福林酚法与抗氧化活性测定结果相关性较高的原因。 福林酚法与ABTS法测定结果相关性最强, 可能是由于ABTS与二氢查尔酮及黄烷酮也有良好的反应。
刺梨中富含(表)儿茶素、 槲皮素、 及山奈酚的衍生物等黄酮类成份。 总黄酮的测定结果与抗氧化活性的关联性不高(r≤ 0.26), 可能与总黄酮测定的影响因素有关。 刺梨中含有的原花青素、 有机酸等化合物具有邻苯二羟基, 会和铝离子络合显色影响测定结果; 槲皮素及衍生物等与铝离子络合, 在500 nm处没有最大吸收, 使测定结果偏小。 因此, 用亚硝酸钠-硝酸铝-氢氧化钠对物质成分复杂的刺梨提取物样本进行总黄酮含量测定, 专属性不强、 误差较大。 此外, 抗氧化活性测定结果还受到溶剂、 pH、 及其他化合物干扰等多种因素影响, 干扰过程复杂且具有不确定性, 因此, 难以评估真实的样本抗氧化活性。 总酚等测定方法也不能客观揭示样本中相关化合物的真实含量。
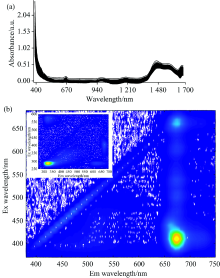
刺梨提取物样本的紫外-可见吸收光谱带主要在190~390 nm区域, 致使吸收强度超出仪器的量测范围, 出现饱和现象, 吸收光谱的选择性差、 缺乏组份的特征性, 如图1(a)。 故该区间的紫外-可见光谱不用作数据分析。 相比而言, 提取物的近红外光谱具有多个吸收谱带。 1 150~1 250和1 400~1 500 nm分别是由化学物质的C— H官能团的二阶倍频、 N— H的一阶倍频振动所致。 900~1 000和1 530~1 630 nm的吸收谱带主要归因于O— H官能团的一阶倍频、 C— H官能团的三阶倍频振动, 以及R— OH, Ar— OH官能团的吸收[图1(a)]。 多酚、 黄酮类物质本身含有较多酚羟基结构, 使得这些谱带都有较强的光谱吸收。 三萜类化合物中存在大量的C— H官能团, 亦导致较强的光谱吸收。
由于提取液样本的荧光光谱受到严重的一阶(和二阶)瑞利散射干扰[图1(b)], 因此, 在有效分析数据前使用平行因子法[12]消除瑞利散射的影响非常必要。 荧光信号主要在370~690 nm的激发波长与650~750 nm的发射波长区域内, 并且强度大。 可归因于样本中含有的多酚、 黄酮、 维生素、 氨基酸类具有荧光基团的化合物。 但是, 由于提取物原液中化学成分繁多而且浓度高, 使其发生复杂的荧光内滤效应。 从原液稀释50倍后测量的荧光光谱[图1(b)的内插图]看出, 荧光稀释效应非常明显: 提取物原液在370~690 nm的激发波长与650~750 nm的发射波长区域内的信号变弱或者基本消失不见, 而荧光信号强度最大的谱峰却在250~350 nm的激发波长与280~450 nm的发射波长区域内。 酚类化合物的激发波长约为275 nm, 发射波长约为300 nm[13]; 超氧化物歧化酶的激发与发射波长分别约为280和325 nm; 维生素类的激发波长大致在300~350 nm, 发射波长约为400 nm; 氨基酸类化合物的激发波长范围为230~290 nm, 发射波长分别为280, 330和445 nm。
2.3.1 紫外-可见与近红外融合光谱
紫外-可见与近红外光谱的融合数据(390~1 700 nm)可以提供更加丰富的样本物质组成信息, 对其进行稳健主成分分析, 有效剔除301个提取物中的30个异常量测样本。 剔除异常值后不同产地的样本分别具有较好的均匀性与一致性。
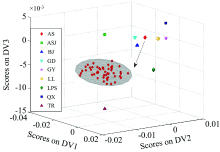
由于环境、 温度、 仪器状态等因素影响样本的光谱采集, 导致不可避免的光谱噪声、 散射效应、 以及基线漂移等干扰。 为减少或消除这些干扰, 应用二阶导数预处理紫外-可见与近红外光谱融合数据, 并对所得的数据进行主判别变量(principal discriminant variate, PDV)分析, 建立样本的判别模型(图2)。 其中, 用于优化模型分类能力与稳健性的关键参数λ 设置为10-5。 λ 的取值减小, 样本类间距离增大而类内距离减小, 模型的分类能力增强; 若λ 的取值过小, 模型则出现过拟合现象, 稳定性变差。 从图2中得分图看出, (1)不同产地的刺梨样本及金刺梨样本彼此间能够完全区分开, 即不同产地样本对应的判别变量得分类间方差足够大, 如51个AS样本与45个BJ样本的得分类间方差为1.58× 10-5; (2)同一产地的不同批次样本几乎完全聚集在一起, 即相同产地不同批次样本间的类内方差小, 如放大的内插图为51个AS样本的判别得分, 椭球形表示95%的置信区域, 其类内方差是1.60× 10-6, 而45个BJ样本的类内方差是1.69× 10-6; (3)不同产地样本的类间方差远大于相同产地不同批次样本间的类内方差, AS与BJ样本判别得分的类间方差几乎是其类内方差的10倍。
由于金刺梨样本与刺梨样本的化学成分存在较大差异性, 仅针对八个产地的257个刺梨样本即可进行消除瑞利散射影响后的荧光光谱数据判别分析及样本产地溯源。 同时, 比较中心化(mean-centering, MC)、 多元散射校正(multiplicative scatter correction, MSC)、 二阶导数(2nd Derivative)三种数据预处理对样本判别分析的影响。 在PDV方法中, 参数λ 设置为10-2时, 计算样本的主判别变量得分的类间方差(SSbetween)与类内方差(SSwithin)的比值(ratio), 衡量不同产地样本的分离效果(表3)。 从中能够观察到: (1)种植基地LL的刺梨与GD, GY样本的化学组成的荧光光谱信息更接近, 其各自的类间方差与类内方差的比值要小些, 可能的原因是这三个地域相邻、 刺梨生长环境因素相似; (2)AS与LPS的刺梨样本差异性较大(类间方差与类内方差的比值最大), 与BJ刺梨的区别也略为明显; (3)多元散射校正与中心化(MSC+MC)处理荧光光谱数据导致最好的样本判别分离效果, 对应的AS与LPS样本的类间方差与类内方差的比值达到2.03× 104。 可见, 荧光光谱经过适当的数据预处理后, 结合PDV模型, 能够有效识别不同产地来源的刺梨样本的差异性。
| 表3 不同产地的刺梨提取物样本的荧光光谱经过不同的数据预处理后的类间方差与类内方差分析 Table 3 Analysis of SSbetween to SSwithin of two RRT extract sample sets from typical regions resulted from the EEM spectra with different preprocessing |
刺梨是贵州特色的具有农业经济价值的药食两用植物, 其化学物质成分因产地不同而存在差异性。 通过化学方法测量该植物提取物的DPPH、 ABTS、 FRAP、 总酚、 总黄酮、 总三萜含量判断其活性是不准确的。 采用近红外、 紫外-可见、 荧光光谱技术整体表征刺梨果提取物的化学组成是可行的, PDV光谱模型能够对刺梨样本进行产地溯源分析, 为刺梨的质量评价以及选种工作等提供借鉴, 为研究其他的药食用植物提供方法学参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|