作者简介: 吕嘉楠, 1996年生, 广西科技大学生物与化学工程学院硕士研究生 e-mail: 1452603599@qq.com
利用紫外-可见吸收光谱和共振光散射法研究艹屈(chrysene, CHR)与鲱鱼精子DNA的相互作用, 通过计算其DNA结合饱和值来评估CHR对DNA的结合能力。 此外, 还分别考察了温度, pH, 氯化钠, 氯化钙, 维生素C, 十二烷基磺酸钠等环境因素对CHR与DNA相互作用的影响, 为下一步利用DNA构建消除CHR的方法奠定基础。 紫外可见光谱显示, 加入DNA后, CHR的最大吸收峰出现减色效应且伴随有红移现象, 这说明CHR与DNA的相互作用属于嵌插结合模式。 共振光散射光谱结果表明CHR在468 nm处出现稳定的共振光散射峰。 当CHR的浓度为2.59×10-6 mol·L-1时, 其饱和DNA浓度为3.08×10-6 mol·L-1, CHR的DNA结合饱和值在25 ℃时为0.84, 而当pH=7.40, 30 ℃时, CHR的DNA结合饱和值则达到0.94。 在此条件下, 氯化钠, 氯化钙, 维生素C, 十二烷基磺酸钠对CHR与DNA相互作用的影响也不同, 相应CHR的DNA结合饱和值分别为0.84, 0.76, 1.25和1.07。 以30 ℃时CHR的DNA结合饱和值为基准, 各环境共存物下的相应DNA结合饱和值变化率分别为-10%, -19%, 33%和14%, 说明阳离子的存在会抑制CHR与DNA的结合, 而一定浓度的维生素C和十二烷基磺酸钠则对CHR与DNA的结合有协同促进作用。 本研究结果可为建立新的基于DNA嵌插的CHR去除法提供参考。
The interaction between chrysene (CHR) and herring sperm DNA (hsDNA) was studied by UV-Visible absorption spectra (UV-Vis) and resonance light scattering (RLS) Spectrometry. Ability binding with DNA of CHR was evaluated by calculating the saturation value binding with DNA of CHR. In addition, the effects of temperature, pH, sodium chloride, calcium chloride, vitamin C, sodium dodecyl sulfate on the interaction between CHR and DNA respectively were respectively investigated, which laid the foundation for establishing a method to eliminate CHR by DNA in the future. UV-Vis spectra showed that after DNA was added, the maximum absorption peak of CHR appeared hypochromic effect and accompanied by a red-shift, suggesting that CHR interacted with DNA in an intercalation mode. The RLS spectra showed that CHR had a stable RLS peak at 468 nm. When the concentration of CHR was 2.59×10-6 mol·L-1, the saturated concentration of binding with DNA was 3.08×10-6 mol·L-1, saturation value binding with DNA of CHR was 0.84 at 25 ℃, and saturation value binding with DNA of CHR was 0.94 at pH 7.40 at 30 ℃. Under this condition, sodium chloride, calcium chloride, vitamin C, sodium dodecyl sulfate also had different effects on the interaction of CHR with DNA. Saturated value binding with DNA of CHR were 0.84, 0.76, 1.25, 1.07 respectively. Their change rate of saturation value binding with DNA with CHR-DNA-30 ℃ as a standard are -10%, -19%, 33% and 14%, which showed that the presence of cationic can inhibit the combination of CHR with DNA, while a certain concentration of vitamin C and sodium dodecyl sulfonate had a synergistic promotion effect on the interaction of CHR with DNA. This study could provide a reference for establishing a new CHR removal method via DNA based on DNA-intercalation.
艹屈(chrysene, CHR; 见图1)是一种多环芳烃类物质, 主要产生于生物燃烧、 垃圾焚烧等过程, 循环于水、 空气、 土壤和沉积物中, 是威胁人类生存与健康的持久性有机污染物, 在动物和细胞培养的研究中具有致癌、 致畸、 致突变和基因毒性作用[1]。 人们一直试图通过自然降解、 生物吸附或者光催化降解等传统方法来减少或者消除多环芳烃, 但这些方法在实际的应用中出现了针对性不强, 易造成二次污染等弊端, 所以探索更新颖有效的多环芳烃去除方法亟不可待。
DNA具有独特的双螺旋结构, 对许多芳香杂环有很强的亲和力。 Lerman早在1961年就提出具有平面芳香稠环结构的分子会以嵌入方式与DNA结合, 首先证明了嵌入作用是这种亲和力的来源。 后来陆续有学者提出通过嵌入作用原理, 利用双链DNA去除一些诸如溴化乙锭、 二噁英、 吖啶等有害成分物质。 这些构想为创建新型多环芳烃消除技术提供了新思路。 因此, 探索和揭示CHR与DNA体外条件下的相互作用及其影响因素, 对于创建利用DNA消除CHR的新方法至关重要。
研究平面刚性结构有机小分子与DNA相互作用的方法有很多, 其中, 紫外可见分光光度法最为经典, 而共振光散射法也因其对复合物的粒子体积变化高度敏感且能提供更丰富的信息等被研究者广泛应用。 王倩倩[2]等应用共振光散射法计算香柠檬烯的DNA结合饱和值, 根据其对DNA的结合能力分析其潜在毒性。 Gao[3]等通过共振光散射法计算获得了三羟基蒽醌的DNA结合饱和值, 并以大黄酚、 大黄酸、 茜素为参考, 建立了快速评估三羟基蒽醌毒性的方法。 Li[4]等也通过共振光散射法计算黄曲霉毒素B1的DNA结合饱和值, 说明其嵌入DNA的能力要小于溴化乙锭, 大于补骨脂素, 为判断黄曲霉毒素B1与DNA的相互作用提供了定量参考。 然而目前应用光谱法探索环境因素对CHR与DNA体外相互作用的影响, 从而创造最佳的环境结合条件以达到高效去除目的的研究还未见报道。 本文主要是利用紫外可见吸收光谱和共振光散射法研究CHR与鲱鱼精子DNA的体外相互作用, 并通过计算CHR与DNA结合饱和值判断其结合DNA的能力, 分析影响二者相互作用的一些外源因素以获得促进CHR和DNA相互作用的条件, 为设计高效去除环境中CHR的方法奠定基础。
荧光分光光度计(RF-5301PC, 日本岛津); 紫外可见分光光度计(Cary-60, 安捷伦科技); 漩涡混合器(XW-80A, 上海精科实业有限公司); 微机型精密酸度计(PHS-25CW, 上海思龙科学仪器有限公司); 数显恒温水浴锅(HH-4, 国画电器有限公司)。
CHR (Dr. Ehrenstorfer GmbH (Augsburg Germany), 纯度> 99.9%), 利用98%乙醇溶解后使用pH为7.40的Tris-HCl缓冲溶液稀释至所需浓度。 鲱鱼精子脱氧核糖核酸(hsDNA, Solarbio公司), 溶于超纯水后利用紫外分光光度计测得其260 nm处的吸光度值, 并根据朗伯比尔定律计算其浓度, 储存于4 ℃的冰箱中。 0.1 mol· L-1的三羟甲基氨基甲烷(Tris)与0.1 mol· L-1的盐酸按照比例配置成pH 7.40的Tris-HCl缓冲溶液, 探究pH影响因素时可利用pH计将其调配成不同pH的缓冲溶液。 所有试剂均为分析纯, 实验所用的水为超纯水。
1.2.1 CHR与DNA相互作用的紫外可见吸收光谱
在25 ℃, 向1.0 cm× 1.0 cm的石英比色皿中加入3 mL CHR溶液(9.96× 10-6 mol· L-1), 后逐渐向比色皿中滴加DNA溶液(4.12× 10-5 mol· L-1), 每次加入10 μL, 充分混匀后静置10 min使反应达到平衡, 以紫外-分光光度计进行扫描, 扫描范围200~400 nm。
1.2.2 CHR与DNA相互作用的共振光散射光谱
在25 ℃, 向1.0 cm× 1.0 cm的石英比色皿中加入3.5 mL CHR溶液(2.59× 10-6 mol· L-1), RF-5301PC荧光分光光度计设置λ em=λ ex进行同步扫描。 后逐渐向CHR溶液中滴加DNA溶液(1.23× 10-4 mol· L-1), 每次滴加10 μL, 充分混匀后静置10 min至反应达到平衡, 进行同步扫描并记录。
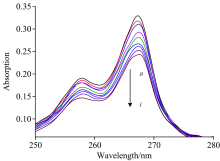
在没有或者有DNA存在的情况下, CHR的紫外光谱图如图2所示。 当没有加入DNA时, CHR的最大紫外吸收峰出现在267 nm处, 随着DNA的逐渐加入, CHR的最大吸收峰出现明显的减色效应, 且伴随有轻微的红移现象。 事实上减色效应和红移现象与小分子和DNA的嵌插结合密切相关, 这种结合是由于药物的稠环结构和DNA碱基对的平面环结构中π —π 芳香基团的强烈堆积作用造成的[5]。 因此由CHR的紫外光谱图变化可以推测出CHR与DNA之间为嵌插结合模式。
2.2.1 CHR与DNA相互作用的共振光散射光谱
DNA结合饱和值可以预测和评价药物分子与DNA结合能力强弱[6]。 因为任何一种药物分子是否具有嵌入DNA分子能力以及嵌入DNA分子能力大小是由该药物分子的分子结构决定。 在某一条件下, 一种药物分子与DNA的结合位点及位点数量都是先天决定。 因此, 在共振光散射光谱检测中, 待检测的药物分子浓度固定且过量时, 其共振光散射峰强度会随着DNA的加入而不断增强, 但是当药物分子与DNA的结合达到极限后, 即使再增加DNA, 其共振光散射峰强度达到最大后也不再增强, 继续增加DNA, 其共振光散射峰强度甚至反而减小。 共振光散射强度达到最大时对应的DNA浓度被称为饱和DNA浓度。 待测药物分子浓度/饱和DNA浓度, 即可得出该药物分子嵌入的DNA结合饱和值。 药物分子的DNA结合饱和值由式(1)求出
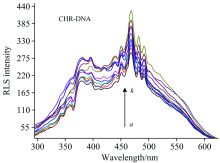
共振光散射强度主要与散射粒子的大小、 粒子浓度、 溶液中相界面的形成等因素有关, 相关变化通常能表示体系中相互作用的强度大小[7]。 在有无DNA存在的情况下, CHR的共振光散射光谱如图3所示, 可以清楚地看到CHR在468 nm处有稳定的共振光散射峰, 因此选择468 nm处的散射峰为观察对象。 由图3看出, 随着DNA的不断加入, CHR的共振光散射峰强度不断增加, 表明CHR与DNA之间发生了相互作用, 并不断形成更大体积的微粒物质。 当DNA浓度为3.08× 10-6 mol· L-1时, CHR的共振光散射强度达到最大。 继续增加DNA, 体系散射强度不再增大反而减小。 因此, 在25 ℃的条件下当CHR的浓度为2.59× 10-6 mol· L-1时, 其饱和DNA的浓度为3.08× 10-6 mol· L-1, 相应的CHR与DNA的结合饱和值则为0.84。 因此推测具有平面芳香环结构的CHR是以嵌插模式与DNA结合的。
2.2.2 环境因素的影响
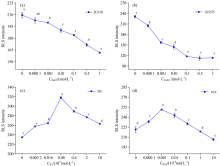
由图4(a)所示, 当温度从25 ℃上升至65 ℃时, RLS强度呈先增大后减小的趋势, 30 ℃时达到最大, 这种现象可能是因为温度较低时分子间相对运动较慢, 温度上升导致分子间相对运动加快。 随着温度继续升高, DNA分子结构破坏, 降低了CHR和DNA的结合作用力, 导致RLS强度的降低。 因此将30 ℃作为CHR-DNA体外相互作用的标准条件。
由图4(b)所示, 30 ℃时, 从酸性到碱性环境下RLS强度呈先增大后逐渐减小的趋势, 在pH为7.40时达到最大值。 分析认为在酸性条件下, DNA磷酸基团中的磷酸根负离子会与氢离子相互吸引, 使得碱基周围富集大量氢离子, 阻碍了CHR与DNA的结合。 碱性环境可能会诱发DNA变性甚至解旋, 直接导致CHR与DNA 分子之间的结合位点减少。 因此, 将pH 7.40作为CHR-DNA体外相互作用的标准条件。
在30 ℃, pH 7.40时, 由图5(a)可以看到CHR-DNA体系的散射峰强度随着氯化钠溶液浓度的逐渐增加而逐渐减弱。 分析认为钠离子会与DNA磷酸基团中的磷酸根负离子相互吸引, 使得DNA碱基周围富集大量钠离子, 磷酸骨架的电荷斥力降低[8], 导致DNA链紧缩, 一方面阻碍小分子与DNA的结合, 另一方面可能会使得已经被结合的小分子挤出DNA。 因此选择加入最低浓度的氯化钠来探讨其对CHR的DNA结合饱和值的影响。
在30 ℃, pH 7.40时, 从图5(b)可以看到CHR-DNA体系的散射峰强度随着氯化钙溶液浓度的逐渐增加而逐渐减弱。 氯化钙与氯化钠在体系中产生的作用相似, 且Ca2+所带电荷更多, 体积更大, 其影响也更显著。 因此同样选择加入最低浓度的氯化钙来探讨其对CHR的DNA结合饱和值的影响。
在30 ℃, pH 7.40时, 从图5(c)可看出CHR-DNA体系的散射峰强度随着维生素C溶液浓度的增加呈现先增强后减弱的趋势, 当维C浓度为8× 10-5 mol· L-1, 散射峰强度达到最大值。 维生素C通过OH和C—O基团与DNA磷酸、 碱基和脱氧核糖供体原子与DNA发生相互作用, 当其浓度较高时, 生物大分子的结构会出现轻微的螺旋失稳现象[9]。 因此选择加入8× 10-5 mol· L-1的维生素C来探讨其对CHR的DNA结合饱和值的影响。
在30 ℃, pH 7.40时, 从图5(d)可看出CHR-DNA体系的散射峰强度随着SLS浓度的逐渐增加呈现先增强后减弱的趋势。 在十二烷基磺酸钠(SLS)浓度为10-7 mol· L-1时, CHR-DNA相互作用后的散射峰强度达到最大。 SLS是一种阴离子表面活性剂, 低浓度时会使得体系中散射粒子分散且稳定, 导致共振散射峰强度的增大, 而当表面活性剂浓度过高时部分(SLS)会与DNA发生疏水作用形成胶束[10], 胶束体系中疏水性和粘性增强, DNA碱基通过氢键配对的能力被削弱, 从而减少或阻止CHR与DNA的结合。 因此选择加入10-7 mol· L-1的SLS溶液来探讨其对CHR的DNA结合饱和值的影响。
在30 ℃、 pH 7.40的条件下, 固定CHR的浓度为2.59× 10-6 mol· L-1, 此时CHR 的DNA结合饱和值计算为0.94, 分别加入氯化钠(0.000 1 mol· L-1), 氯化钙(0.000 1 mol· L-1), 维生素C(8× 10-5 mol· L-1), SLS(10-7mol· L-1)后, 各条件下的DNA结合饱和值总结于表1。 从表1可看出最低浓度的氯化钠、 氯化钙存在时, CHR的DNA结合饱和值均小于标准条件下CHR的DNA结合饱和值, 说明阳离子的存在对CHR与DNA的结合有削弱作用, 可能会直接导致去除率的降低。 而维生素C和SLS存在的情况下, CHR的DNA结合饱和值均大于标准条件下CHR的DNA结合饱和值, 说明一定浓度的维生素C和SLS对CHR与DNA的结合是起到促进作用的, 若向CHR-DNA的体系中加入这些环境因素, 则有助于提高污水中CHR的去除率。
| 表1 CHR的DNA结合饱和值 Table 1 Saturation value binding with DNA of CHR |
利用紫外可见吸收光谱与共振光散射法研究了CHR与DNA的相互作用, 结果表明两者之间为嵌插结合, 说明了建立新的基于DNA嵌插原理的CHR去除法具有可行性。 当CHR的浓度为2.59× 10-6 mol· L-1时, 25 ℃条件下CHR的DNA结合饱和值为0.84, 而30 ℃, pH 7.40下CHR的DNA结合饱和值则为0.94, 在此基础上探究了一些环境污水中可能存在的物质或者洗涤剂中的主要成分对CHR与DNA相互作用的影响, 发现CHR的DNA结合饱和值随环境共存物的不同而变化, 结果表明可以尝试着将氯化钠、 氯化钙、 维生素C、 SLS这几种因素应用于下一步的消除研究以测定其对污水中CHR去除率的影响。 综上所述, 研究CHR与DNA体外相互作用及其影响因素非常有意义, 相信本工作将会为很多领域中解决多环芳烃污染提供新的见解。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|