作者简介: 曾伟基, 1995年生, 暨南大学赤潮与海洋生物学研究中心硕士研究生 e-mail: 714763069@qq.com
利用三维荧光光谱技术, 研究了以微小亚历山大藻 (台湾株)(AMSY)、 塔玛亚历山大藻(大亚湾株)(ATDY)、 链状裸甲藻(防城港株)(GCFC)、 塔玛亚历山大藻(香港株)(ATHK)、 链状亚历山大藻(南海株)(ACSY)5株4种产麻痹性贝毒(PSP)微藻以及21株不产PSP藻在不同温度条件下培养微藻的各生长期产毒能力与三维荧光的关系。 研究结果表明, 在不同温度条件下, 产毒藻类单位藻细胞产毒量会发生显著变化, 低温可促进麻痹性贝毒的产生。 通过Db7小波分解, 选取Ca3尺度分量的联合荧光谱作为特征谱并利用Fisher判别发现, 产PSP藻与不产PSP藻荧光差异主要集中在 λex为400~425和450~545nm; λem为715~750 nm的波段, 利用判别函数建立判别式, 实现了对产麻痹性贝类毒素藻类的识别测定。 对产PSP毒素藻类的判别率达到93.7%, 不产PSP毒素藻类判别率达到93.3% , 综合判别率为93.5%。 该研究可实现对水体中活体产PSP微藻的快速识别, 为进一步开发产毒微藻识别仪提供理论基础。
Using three-dimensional fluorescence spectroscopy technology, the relationship between three-dimensional fluorescence and toxicity of 5 strains of 4 microalgae species producing paralytic shellfish poisoning(PSP), which were Alexandrium minutum (Taiwan strain, AMSY), Alexandrium tamarense (Daya Bay strain, ATDY), Gymnodinium catenatum (Fangcheng Lane strain, GCFC), Alexandrium tamarense (Hong Kong strain, ATHK), Alexandrium catenella (South China Sea strain, ACSY), and 21 non-producing PSP microalgae species under different temperature conditions culture was studied. The results show that the toxin content of toxic algae per cell would change significantly under different temperature culture conditions and low temperature could promote the PSP production of toxic microalgae. By Db7 wavelet decomposition, the combined fluorescence spectrum of Ca3 scale components was selected as the characteristic spectrum and was used to establish the Fisher discrimination models, The combined fluorescence spectrum differences between toxic and non- toxic microalgae focused mainly on λex 400~425, 450~545 nm and λem 715~750 nm bands. Using the Fisher discrimination models to dentification the toxic and non-toxic microalgae, the identification rate reached 93.7% and 93.3%, respectively, and the comprehensive discrimination rate was up to 93.5%. The method could be used to rapidly identify toxic microalgae in sea water and provide the theoretical basis for further developing toxic microalgae identification instruments.
麻痹性贝类毒素(paralytic shellfish poisoning, PSP)主要指石房蛤毒素(saxitoxin, STX)及其衍生物, 是一种神经毒素[1]。 至今已经发现的麻痹性贝毒毒素已有 57种, 主要由甲藻产生, 如膝沟藻属(Gonyaulax)、 亚历山大藻属(Alexandrium)、 裸甲藻属(Gymnodinium)等。 双壳贝类滤食产毒甲藻后, PSP可在贝类体内累积, 人类误食这类贝类可引起麻痹性贝类毒素中毒。 近年来, 我国沿海大部分海域频发贝类毒素中毒事件[2], 不仅带来十分严峻的食品安全问题, 还给近海养殖和海产加工业带来严重损失[3]。
目前PSP的检测方法有生物检测法[4]、 高效液相色谱法[5]等。 这些方法已经相对成熟, 但仍然存在时效性差、 成本高、 需要专业人员操作等缺点。 本课题组以前期建立的鱼毒性藻类快速识别为基础[6], 基于微藻的产毒特性与其生长周期[7]和培养条件如光照、 温度, 盐度[8, 9]等环境因子密切相关, 产麻痹性贝毒藻sxt基因与光合作用、 碳循环等具有密切联系[10, 11, 12]。 其中小波函数特征谱作为原始荧光光谱在小波空间的投影能从多尺度细化浮游植物的荧光信息更好地凸显目标样本的特征荧光值, Daubechies(db)小波系具有良好的正交性, 双正交性, 紧支撑性且近似对称等特点[13], 本文利用Db7小波函数提取实验藻的特征峰, 并通过fisher判别方法建立判别函数, 实现对产麻痹性贝毒藻类快速识别的目的, 为麻痹性贝类毒素的高效快速监测和管理提供技术支持。
荧光分光光度计(Hitachi F4600, 日本), OLYMPUS CKX41倒置显微镜(OLYMPUS 公司), 光照气候培养箱(上海一恒公司), 化学试剂均为国产分析纯。
实验选取微藻微小亚历山大藻(台湾株)(Alexandrium minimum, AMSY)、 塔玛亚历山大藻(大亚湾株)(Alexandrium tamarense, ATDY)、 链状裸甲藻(防城港株)(Gymnodinium catenatum, GCFC)、 塔玛亚历山大藻(香港株)(Alexandrium tamarense, ATHK)、 链状亚历山大藻(南海株)(Alexandrium catenella, ACSY)等5株产麻痹性贝毒藻为实验微藻和21种非PSTs产毒微藻为对照藻, 所选对照藻种分属甲藻门、 绿藻门、 硅藻门等7个门, 其中, 利马原甲藻(Prorocentrum.lima, CCMP685, PLCZ)由暨南大学生命科学技术学院杨维东教授提供, 链状裸甲藻产毒株(GCFC01, GCFC)和不产毒藻株(GCH01, GCCZ)由国家海洋局第三海洋研究所顾海峰研究员提供, 其他藻种由暨南大学赤潮与海洋生物学研究中心藻种室提供。 利用f/2改良配方配置培养液, 人工光照培养箱内设定温度分别为16, 22和28 ℃, 光暗循环L:D=12 h:12 h培养实验藻株。 实验共进行两个批次的培养, 每组设三个平行样。
将收集的藻液反复冻融后, 用超声破碎仪冰浴破碎藻细胞后低温离心(4 ℃, 7 200 g, 10 min)后, 取上清液, 经超滤离心管(10 000道尔顿)离心(4 ℃, 7 200 g, 10 min), 取超滤液用于毒素HPLC分析。 麻痹性贝毒的 HPLC检测分析参考Band-Schmidt等[15]等修改的HPLC柱后衍生法。
测量条件: 设置激发波长400~600 nm, 发射波长650~750 nm, 激发狭缝与发射狭缝均为10 nm, 扫描速度30 000 nm· min-1, 扫描间隔为5 nm, 信号积分时间0.004 s。 每隔一天定时取上述藻液进行光谱三维光谱扫描测定。 为了尽量避免荧光自吸现象, 在扫描前用f/2培养液分别对培养藻液稀释5, 10, 20, 30, 50, 70和100倍, 用三维荧光仪测定各密度的三维荧光光谱, 确定适于三维荧光分析的藻细胞密度。
将不同温度下各生长期隔天取得的藻液经不同稀释倍数后测得的藻类三维荧光光谱分为产毒藻类和非产毒藻类, 每类随机再分为等数量的两组, 一组为训练集, 用于判别函数的构建, 另一组为测试集, 用于对判别函数的识别率测定。
将扫描所得的文件(格式为* FD3)转化为TXT格式文件, 活体藻类的荧光信息为一个二维矩阵(21× 11), 对应400~600 nm的激发波长和650~750 nm的发射波长。 去瑞利散射采用Delaunay三角内插值法。 采用Matlab6.5及Spss17.0软件对数据进行最大值归一化处理和分析。
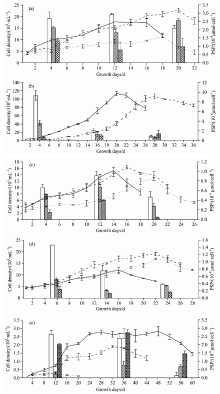
由图1可知, 5株产麻痹性贝毒藻类在温度22 ℃时, 生长速率和最大细胞密度普遍增加, 这与Band-Schmidt等在墨西哥湾分离出的Gymnodinium catenatum在21和25 ℃生长速率最大的结果一致[15]。 随着温度升高, 亚历山大藻单位藻细胞所产的PSP总量下降, 在28 ℃条件下, 4株藻在各个生长期单位藻细胞产PSP总量最低。 低温下, 亚历山大藻藻细胞的产毒总量升高, 与已有的研究结果一致[14]。 精氨酸是合成麻痹性贝类毒素的重要前体物质, 高温使得精氨酸用于藻细胞的生长, 所以合成PSP降低[13]。 可能是因为低温藻细胞的生长下降, 细胞中精氨酸得到积累而用于PSP的合成。 对于链状裸甲藻(GCFC)而言, 低温以及高温的PSP总量均高于22 ℃, 这与墨西哥湾发现的Gymnodinium catenatum在16和33 ℃时单位细胞PSP总量最高, 其中产生的C1、 C2毒素降低, GTX5、 GTX6毒素上升[15]与本实验结果一致。 说明不同属的产PSP藻, 在不同温度条件下产毒类型及含量不同, 有利于藻类生长的环境, 有毒藻产PSP毒素能力降低。
微小亚历山大藻(AMSY)三维荧光光谱进行4层层化后得到各层尺度分量(Ca1—Ca4), 如图2所示, 第一层尺度分量受噪声影响较明显, 难以有效地体现荧光特征, 第二、 三层分量能较好地避免噪声干扰, 但随着分层次数的增加, 信号频率降低, 光谱产生了失真。 经Fisher判别对比发现, 第三层尺度分量(Ca3)判别正确率较高(表1和表2), 因此选择Ca3-Ex和Ca3-Em的联合光谱作为识别特征谱。
| 表1 Db7小波Ca3分量判别结果 Table 1 The identification result of the algae species with Ca3 scale components of Db7 |
| 表2 Db7小波Ca2分量判别结果 Table 2 The identification result of the algae species with Ca2 scale components of Db7 |
实验分别测定了藻类(产毒藻和非产毒藻)在温度16, 22和28 ℃时对数期的三维荧光光谱特征。 产毒藻类各温度的Ca3三维荧光联合光谱, 如图3所示, 其中1~40数据点是Db7小波分析Ca3激发光谱(λ ex=650~750 nm), 41~80数据点为Ca3发射光谱(λ em=400~600 nm), 比较不同温度条件下的联合荧光光谱图发现相对荧光的差异主要集中在Ex为400~425和450~545 nm; Em为715~750 nm, 可用这几段特征光谱表征不同温度下产麻痹性贝类毒素藻的识别光谱, 以此特征谱进行Fisher判别。
建立的判别函数如下:
Y1=-130.949+78.758X1+242.195X2+354.102X3-872.739X4-291.105X5-169.714X6+187.348X7+90.945X8+27.478X9-29.249X10-125.974X11+509.928X12+124.248X13-6.539X14+15.802X15-103.205X16-287.275X17-21.752X18+47.053X19+751.713X20(1a)
Y2=-124.088+167.417X1+137.332X2+212.889X3-725.046X4-217.466X5-132.201X6+149.668X7+90.248X8+39.348X9-55.137X10-157.135X11+490.261X12+201.836X13-30.616X14-2.786X15-170.228X16-189.410X17-28.050X18+54.651X19+707.183X20(1b)
其中, X1—X20分别代表第1, 2, 6, 11, 12, 13, 15, 16, 18, 20, 21, 22, 23, 24, 30, 33, 39, 42, 60和80数据点, 数据点由费希尔线性判别函数选择, Y1和Y2分别是麻痹性贝毒藻类和非麻痹性贝毒藻类的分类判别函数值。 经F检验(55, 3047), 显著水平< 0.1, 组间差异显著。 对式(1a, 1b)进行Wilk’ s Lambda检验=0.283, 说明判别组间存在显著水平差异(p< 0.05), 判别式具有统计意义。 使用函数对共95份样本进行判别检验时, 若Y1> Y2, 则该藻有毒; 若Y1< Y2, 则该藻不产毒。 判别率如表3所示, 对麻痹性贝毒藻类判别率为93.3%, 对非麻痹性贝毒藻类的判别率为93.7%。
| 表3 藻类Db7小波Ca3分量判别结果 Table 3 The identification result of algae species with Ca3 scale components of Db7 wavelet |
甲藻是光合自养生物, 光合作用对麻痹性贝类毒素藻产毒是必需的, 光合作用中产生的高能中间产物, 是PSP合成的前提。 PSP产生的调节, 与光合作用相关蛋白质的表达有关, 光合作用调控产PSP相关的酶及前体物质[16, 17]。 通过对实验室在不同温度条件下培养的5株麻痹性贝毒产毒微藻和21种非麻痹性贝毒产毒微藻的三维荧光光谱进行小波分解, 选取Db7小波Ca3分量中的第1, 2, 6, 11, 12, 13, 15, 16, 18, 20, 21, 22, 23, 24, 30, 33, 39, 42, 60, 80等20个数据点构建判别函数, 其对麻痹性贝毒藻类和非麻痹性贝毒藻类的判别率为93.3%和93.7%, 对测试集综合判别率为 93.5%, 判别效果良好。 限于实验藻种的不足, 本实验选取的产毒藻种类较少, 环境因素变量也较少, 且只采用了单一的Db7小波分析方法, 后续可以增加实验藻种, 设置不同的光照, 营养盐浓度等, 扩大获取的数据量, 有望构建出更具代表性的判别模型。 此外, 随着神经网络和图像识别技术的发展, 利用微藻的三维荧光光谱可开发出更为高效快速的产毒藻识别技术, 为我国有毒有害赤潮的管理提供新的技术支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|