作者简介: 王晓霞, 女, 1984年生, 内蒙古科技大学化学与化工学院副教授 e-mail: wxx572369@163.com
在模拟生理环境中, 使用荧光光谱法、 紫外光谱法、 圆二色谱法、 同步荧光光谱法、 三维荧光光谱法与分子对接模拟法研究黄腐植酸和牛血清白蛋白(BSA)之间相互作用。 在荧光光谱法研究中, 经Stern-Volmer方程计算得到298, 303和308 K温度下的动态荧光猝灭速率常数 Kq和猝灭常数, 证明BSA与黄腐殖酸(FA)相互作用的猝灭过程为静态猝灭; 同时根据计算得出的结合位点数 n都在1附近, FA与BSA体系相互作用比为1:1; 利用静态猝灭双对数方程计算三个温度下的热力学参数, 焓变Δ H<0, 熵变Δ S<0, 得出结论, FA与BSA之间的主要作用力为氢键和范德华力; Δ G<0, 说明作用过程为自发过程。 采用Förster's偶极-偶极非辐射能量转移理论, 计算出结合距离 r=6.340 nm, 表明BSA与FA之间存在非辐射能量转移。 分子对接模拟结果表明FA与BSA残基的结合作用力具有氢键和范德华力, 同时二者之间还存在疏水作用力, 多种力共同作用使FA与BSA能够稳定结合。 通过对FA与BSA相互作用的紫外-可见吸收光谱分析, 发现BSA最大吸收峰发生了较为明显的红移, 表明FA使BSA的二级结构发生改变。 通过研究FA与BSA相互作用的同步荧光光谱, 得到FA使BSA中的色氨酸(Trp)残基周围的微环境极性增强, 疏水性减弱, 亲水性增强, 使BSA的蛋白质构象发生了一定程度的改变。 通过研究FA与BSA相互作用的三维荧光光谱, 峰1(peak 1)与峰2(peak 2)的最大发射波长峰都发生了红移, 证明FA与BSA发生了相互作用, FA使BSA周围环境的极性增大, 疏水性减小, 亲水性增加, BSA蛋白质构象发生变化。 最后采用圆二色谱法进行分析, 利用软件计算得出该实验相互作用体系下α-螺旋(α-Helix)减少2.3%、 β-折叠(β-sheet)增加7.7%、 β-转角(β-Turn)增加0.6%和无规则结构(Random coil)含量减少1.2%, β-折叠(β-sheet)含量增加最为明显, 强有力地说明了FA使BSA结构发生了改变。
In this paper, the interaction between fulvic acid (FA) and bovine serum albumin (BSA) was studied by fluorescence spectroscopy, ultraviolet spectroscopy, circular dichroism, synchronous fluorescence spectroscopy, three-dimensional fluorescence spectroscopy and molecular docking simulation in the simulated physiological environment. In the fluorescence spectroscopy study, the dynamic fluorescence quenching rate constant Kq and quenching constant at 298, 303 and 308 K are calculated by the Stern-Volmer equation, which proves that the quenching process of the interaction between BSA and FA is static quenching. At the same time, according to the calculated binding sites n, the interaction ratio between FA and BSA is 1:1. The thermodynamic parameters at three temperatures are calculated by static quenching double logarithm equation, enthalpy change Δ H<0, entropy change Δ S<0, it is concluded that the main interaction force between FA and BSA is hydrogen bond and van der Waals force, Δ G<0, indicating that the interaction process is spontaneous. Based on Förster's dipole-dipole non-radiative energy transfer theory, the binding distance rang 6.340 nm is calculated, indicating a non-radiative energy transfer between BSA and FA. The molecular docking simulation results show that the binding force between FA and BSA residues is hydrogen bond and van der Waals force, and there is a hydrophobic force between them. The interaction of multiple forces makes FA and BSA combine stably. Through the UV-Vis absorption spectrum analysis of the interaction between FA and BSA, it is found that the maximum absorption peak of BSA has an obvious red-shift, indicating that FA changes the secondary structure of BSA. By studying the synchronous fluorescence spectrum of the interaction between FA and BSA, it was found that FA enhanced the polarity of the microenvironment around the tryptophan (Trp) residue in BSA, weakened its hydrophobicity and enhanced its hydrophilicity, which changed the protein conformation of BSA to a certain extent. Through the study of the three-dimensional fluorescence spectrum of the interaction between FA and BSA, the maximum emission wavelengths of peak 1 (peak 1) and peak 2 (peak 2) were red-shifted, which proved that FA interacted with BSA. FA increased the polarity of the environment around BSA, decreased its hydrophobicity, increased its hydrophilicity, and changed the protein conformation of BSA. Finally, circular dichroism was used for analysis, and the software was used to calculate that under the experimental interaction system, α-helix (α-Helix) decreased by 2.3%, β-sheet increased by 7.7%, β-Turn increased by 0.6%, and irregular structure (Random coil) content decreased by 1.2%. The content of β-sheet increased most obviously, which strongly indicated that FA changed the structure of BSA.
黄腐植酸(fulvic acid, FA)为腐植酸中的一种, 其结构中含有较多的活性基团, 具有水溶性好, 分子量小等特点, 是一种良好的免疫佐剂[1]。 近年来, 在医药等领域表现突出, 如Winkler John[2]等研究黄腐植酸对于慢性疾病和糖尿病的疗效; Jayasooriya Rajapaksha Gedara Prasad Tharanga[3]等研究黄腐植酸可能具有刺激免疫调节作用, 诱导癌细胞死亡等功效。 血清白蛋白是人和动物的血浆中最丰富的蛋白质, 作为血液缓冲剂、 维持血浆渗透压和运载药物小分子, 生物体内承担重要作用。 牛血清白蛋白(bovine serum albumin, BSA)与人血清白蛋白在结构上类似, BSA更容易获得也更为廉价, 这些特点使得BSA常用来做研究小分子与蛋白质相互作用的理想模型。 FA分子结构中的含有多个具有活性的酚羟基和羧基, 可以与药物载体血清白蛋白结构中的活性基团相互作用。 本研究能为FA类新药物的开发及未来对于研究FA药物对人体的作用提供一定的数据参考。 同时通过本实验FA与BSA相互作用的探究也对FA的性能和其对于蛋白质结构功能的影响具有重要理论价值。
仪器: 荧光分光光度计(LS-55, 美国PerkinElmer公司); 紫外-可见近红外分光光度计(CARY 5000, AGILENT TECHNOLOGIES有限公司); 圆二色谱仪(Chirascan plus, 英国应用光物理公司)。 试剂: FA(纯度≥ 98%)(合肥巴斯夫生物科技有限公司); BSA(纯度≥ 98%)(上海金穗科技有限公司); 三羟甲基氨基甲烷(tris hydroxymethyl aminomethane, Tris, 分析纯)(天津市光复精细化工研究所)。
分别配制pH 7.40, 浓度为0.1 mol· L-1的Tris-HCl缓冲溶液、 0.5 mol· L-1的NaCl溶液、 5× 10-5 mol· L-1的BSA储备液。 准确移取BSA储备液后加入浓度为0.5 mol· L-1NaCl溶液20 mL, 用pH 7.40的Tris-HCl缓冲溶液定容至100 mL, 得到浓度为5× 10-6 mol· L-1的牛血清白蛋白溶液; 配制浓度为1.5× 10-3 mol· L-1的黄腐植酸溶液: 用天平准确称取黄腐植酸药品粉末0.049 3 g, 充分溶解后定容至100 mL, 得到浓度为1.5× 10-3 mol· L-1的黄腐植酸溶液。
1.3.1 测定不同温度下FA-BSA的荧光光谱
取9支10 mL比色管, 分别移取适量BSA和FA, 得到试管内BSA浓度为5× 10-7 mol· L-1, FA浓度从低到高依次为(0, 0.6, 1.2, 1.8, 2.4, 3.0, 3.6, 4.2和4.8)× 10-4 mol· L-1, 摇匀后静置20 min后放入恒温水浴箱, 将温度分别设置为298, 303和308 K, 在不同温度下加热20 min后取出, 使用荧光光度计进行测量。 设置荧光激发波长280 nm, 狭缝宽度均为10 nm, 扫描速度1 500 nm· min-1, 发射波长290~550 nm, 记录相对应的荧光值。
1.3.2 测定FA-BSA的同步荧光光谱
取9支10 mL比色管, 分别移取适量BSA和FA, 得到比色管内BSA浓度为5× 10-7 mol· L-1, FA浓度从低到高依次为(0, 0.6, 1.2, 1.8, 2.4, 3.0, 3.6, 4.2和4.8)× 10-4 mol· L-1, 震荡摇匀后待测。 在荧光光度计同步荧光激发波长280 nm, 狭缝宽度均为9 nm, 扫描速度1 500 nm· min-1条件下, 分别扫描测定Δ λ =15 nm和Δ λ =60 nm下体系的同步荧光光谱。
1.3.3 测定FA-BSA三维荧光光谱
选用两支10 mL比色管, 分别移取适量BSA和FA, 得到两支试管内溶液浓度为: BSA为2.5× 10-7 mol· L-1, FA为 3.0× 10-5 mol· L-1。 震荡摇匀后待测。 在三维荧光激发波长200 nm, 狭缝宽度7.0 nm条件下, 设置发射波长200~500 nm, 扫描速度为1 500 nm· min-1, 分别测量40组发射波长间隔为5 nm的三维荧光光谱。
1.3.4 测定FA-BSA的紫外-可见光吸收光谱
分别移取适量BSA和FA至比色管, 定容后试管内BSA浓度为5× 10-7 mol· L-1, FA浓度从低到高依次为(0, 0.6, 1.2, 1.8, 2.4, 3.0, 3.6, 4.2和4.8)× 10-4 mol· L-1, 震荡摇匀后待测。 用紫外分光光度计扫描紫外-可见吸收光谱, 扫描波长190~450 nm, 波长间隔1 nm的条件下测量紫外-可见吸收光谱。
1.3.5 测定FA-BSA结合距离
取3支10 mL比色管, 分别移取适量BSA和FA, 得到三个试管溶液浓度为: BSA为5× 10-7 mol· L-1; FA为5× 10-7 mol· L-1; BSA为5× 10-7 mol· L-1, FA为5× 10-7 mol· L-1。 震荡摇匀后静置待测。 在荧光光谱仪激发波长280 nm, 狭缝宽度8.0 nm条件下, 扫描波长范围为290~550 nm, 设置扫描速度500 nm· min-1, 测量并得到FA和FA-BSA的荧光光谱。 在紫外分光光度计扫描波长190~450 nm, 参数波长间隔1 nm的条件下, 测量并得到FA的紫外-可见吸收光谱。
1.3.6 测定FA-BSA圆二色谱
取2支10 mL比色管, 分别移取适量BSA和FA, 得到溶液浓度为: BSA浓度为1× 10-5 mol· L-1; BSA浓度为1× 10-5 mol· L-1, FA浓度为4× 10-5 mol· L-1。 圆二色谱仪扫描波长范围为180~260 nm, 狭缝宽度8.0 nm, 时间0.5 s, 用Tris-HCl作为参比, 记录BSA与FA-BSA体系的圆二色谱。
1.3.7 分子对接模拟
使用ChemDraw Professional 15.1软件绘制FA的分子结构式, 选取蛋白质数据库RCSB Protein Data Bank(http://www.rcsb.org/bdb/home/home.do)中BSA晶体结构, 使用分子对接软件Accelrys Discovery Studio 3.5进行分子对接模拟。
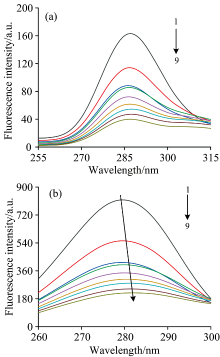
由于BSA分子含有酪氨酸(Tyr)、 色氨酸(Trp)、 苯丙氨酸(Phe)等氨基酸残基能使得BSA分子具有强烈的内源性荧光, FA溶液加入BSA溶液后, 出现荧光猝灭现象。 图1(a, b, c)是在温度分别为298, 303和308 K下, BSA与不同浓度的FA溶液所产生的荧光强度变化情况。 由图1分析对比可知, 激发波长280 nm, BSA最大发射波长为346 nm, 随着FA溶液浓度增加, BSA荧光强度呈规律下降, 发射峰的位置与峰型却没有明显改变, 因此可得出FA对BSA产生荧光猝灭作用, 两者发生相互作用。
荧光猝灭过程分为动态和静态猝灭, 动态猝灭是猝灭剂FA与荧光激发态分子BSA之间相互碰撞, 使得荧光强度降低, 不会影响到BSA的构象; 荧光猝灭过程中静态猝灭则是基态下荧光分子与猝灭分子形成不发光的基态配合物, 使得荧光减弱, 蛋白质分子结构发生改变[4]。 实验采用Stern-Volmer方程[5]进行处理来判断猝灭类型
式(1)中, FA溶液作为猝灭剂, F0为不加入FA溶液时体系的荧光强度; F为加入FA溶液后体系的荧光强度; [Q]为实验测量最终FA溶液的浓度, KSV为动态猝灭常数, Kq为动态荧光猝灭速率常数; τ0为当猝灭剂FA不存在时, 荧光分子的平均荧光寿命, 通常取值10-8 s。 以[Q]为横轴, F0/F为纵轴, 作298, 303和308 K温度下该体系的Stern-Volmer曲线, 并拟合得到方程与相关系数, 见表1。
| 表1 Stern-Volmer线性方程以及相关系数 Table 1 Stern-Volmer linear equations and correlation coefficients |
由表1可知, 在298, 303和308 K下计算得到Kq值均远大于最大扩散碰撞猝灭速率常数2.0× 1010 L· mol-1· s[6]。 证明FA主要通过静态猝灭来降低BSA的荧光强度, 且猝灭常数在298, 303和308 K下的数值随着温度升高而降低, 进而更表明FA与BSA作用为静态猝灭。
已证明FA与BSA相互作用的荧光猝灭类型为静态猝灭, 则静态猝灭双对数公式[7]适用于该反应体系
式(2)中, KA为FA和BSA的结合常数; n为FA与BSA的结合位点数; F0为不加入FA溶液时体系的荧光强度; F为加入FA溶液后体系的荧光强度。 以lg[(F0-F)/F]的值作为纵坐标, 以lg[Q]的值作为横坐标作图, 其直线斜率即为结合位点数n, 结合常数KA为直线截距的负对数值, 见表1。 从表1可知, 三个温度下结合常数KA都较大, 结合位点数在1附近, 证明FA与BSA结合力较强, 且该体系相互作用所形成的复合物为1:1型。 同时, 结合常数数值随着温度的上升而减小, KA(298 K)> KA(303 K)> KA(308 K), 与猝灭常数随温度变化规律一致, 进一步证明了FA与BSA体系猝灭类型为静态猝灭。
药物小分子与蛋白质相互之间通过不同的作用力相互作用形成配合物, 相互作用力的表现形式主要有氢键、 疏水作用力、 静电引力和范德华力。 通过Van't Hoff公式[8]计算得到反应体系的熵变Δ S与焓变Δ H, Van't Hoff公式与反应的吉布斯自由能公式如式(3)— 式(5)
式(3)— 式(5)中, Δ G反应的吉布斯自由能; KA是结合常数; R为摩尔气体常数(取R=8.314 J· mol-1· K); T为试验温度。 根据式(3)— 式(5)求得Δ H=-33.48 KJ· mol-1, Δ S=-40.78 J· mol-1· K和Δ G=-20.95 kJ· mol-1(298 K), -21.12 kJ· mol-1(303 K), -20.92 kJ· mol-1(308 K)。 根据Ross[9]理论可知, FA与BSA体系的热力学参数Δ H< 0, Δ S< 0表明体系中两者之间的作用力为氢键和范德华力; Δ G< 0表明反应为自发反应, 同时本反应为放热反应(Δ H< 0)。
按照Förster偶极-偶极非辐射能量转移机理[10, 11], 该体系满足以下关系式
式(6)— 式(8)中: F为在BSA与FA体系中FA与BSA浓度比为1:1时BSA的荧光强度, F0为只有蛋白质BSA时测得的荧光强度, r为BSA与FA之间的结合距离; R0为E=50%时的临界距离; k2为偶极空间取向因子, 取平均值2/3; n为介质的折射指数, 取水和有机物的平均值1.336; φ 为BSA的荧光量子产率, 取色氨酸(Trp)残基量子产率φ =0.15; J为BSA的荧光发射光谱与FA紫外吸收光谱间的光谱重叠积分; FD(λ )为BSA在波长λ 处的荧光强度; ε A(λ )为受体FA在波长λ 处的摩尔吸光系数。
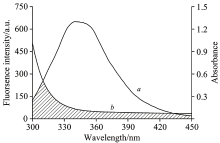
BSA的荧光光谱曲线与FA的紫外吸收光谱曲线的重叠图见图2, 图2重叠部分说明FA与BSA之间存在非辐射能量转移。 根据式(6)— 式(8)计算得到重叠积分J=2.021× 10-15 cm3· mol· L-1, E=18.30%, R0=4.79 nm, r=6.340 nm。 结果表明, FA与BSA相互作用的结合距离r< 7 nm, 同时0.5 R0< r< 1.5R0, 证明FA与BSA之间存在非辐射能量转移。
分子对接技术可以更清晰地了解BSA分子的二级结构改变和FA与BSA相互作用体系中的作用力类型。 利用分子对接模拟软件绘制出FA与BSA相互作用体系的分子对接模拟图, 如图3所示。 图3(a)和(b)中, BSA立体结构呈现心型且FA分子位于BSA的活性中心, FA与BSA结合位点靠近BSA亚结构域Ⅲ B(Subdomain Ⅲ B)site Ⅱ 点。 为进一步观察FA与BSA相互作用的微环境, 列出FA结合位点附近对结合作用影响较为明显的氨基酸残基, 见图3(c)。 图3(c)中, FA与BSA的氨基酸残基之间存在范德华力(Van der waals)的有: HIS534, GLN579, LEU582, LYS535, LEU531, THR578, PHE508, PHE553, GLY571和PRO572。 FA与GLU503和THR507氨基酸残基之间为氢键作用力(Conventional Hydrogen Bond), FA与GLU503氢键键长为5.45 Å , FA与THR507氢键键长为3.19 Å 。 FA与BSA中PHE501, VAL575和PHE506氨基酸残基之间存在不利于碰撞作用力(Unfavorable Bump), FA与PHE501键长为4.69 Å , FA与VAL575不利于碰撞键长为3.64 Å , FA与PHE506键长为5.34 Å 。 FA与BSA中PHE506和LEU574残基存在疏水作用力(以Pi-alkyl与Pi-Pi Stacked形式存在), FA与PHE506键长为4.60 Å , FA与LEU574疏水作用力键长为6.26 Å 。 上述结果证明了FA与BSA相互作用使二者可稳定结合, 表明了BSA二级结构微环境的变化。
2.7.1 FA与BSA相互作用的紫外-可见吸收光谱
用紫外光谱可以探索FA对BSA的结构改变, 模拟生理条件下, 分别测定BSA和FA与BSA体系的紫外-可见吸收光谱, 见图4。 由图4可知, 体系的紫外吸收峰在280 nm左右出现, 随FA浓度的不断增大, 最大吸收峰红移了3 nm, 分析认为由于FA与BSA碱基对发生了电子堆积, FA的空轨道与碱基的电子轨道发生耦合, 发生了跃迁, 吸收光波的能量减小[12, 13], 使BSA周围微环境极性增大, 疏水性减小, 亲水性增大, 证明FA使BSA的二级结构发生了改变。
2.7.2 FA与BSA相互作用的同步荧光光谱分析
同步荧光光谱可以明确反映出蛋白质氨基酸残基周围微环境的变化, 对体系进行了同步荧光光谱测定, 见图5。 由图5可知, 在BSA的浓度保持不变的情况下, 随着FA浓度梯度的升高, 图5(a)中Δ λ =15 nm下对应表征的酪氨酸(Tyr)残基同步荧光光谱的最大发射波长基本维持不变, 峰型无明显变化, 荧光强度猝灭程度较弱; 而图5(b)中Δ λ =60 nm下对应表征的色氨酸(Trp)残基同步荧光光谱的最大发射波长红移了3 nm, 且荧光猝灭程度较强, 这说明FA使BSA中的色氨酸(Trp)残基周围的微环境极性增强, 疏水性减弱, 亲水性增强, 使得BSA的构象发生了一定程度的改变, 证明FA作用在BSA的色氨酸(Trp)残基上, 使BSA的二级结构发生改变。
2.7.3 FA与BSA相互作用的三维荧光光谱分析
为进一步研究FA与BSA的结合对BSA产生结构及在微环境的影响, 对体系进行三维荧光光谱测定, 见图6、 图7。 由图6、 图7可知, 峰1(peak 1)与峰2(peak 2)的荧光强度都发生了较大程度的降低, 且两峰都在最大发射波长处出现了红移现象, 峰1(peak 1)最大发射波长峰红移了1 nm, 峰2(peak 2)最大发射波长峰红移了4 nm, 证明FA与BSA发生了相互作用, FA使BSA周围环境的极性增大, 疏水性减弱, 亲水性增强, 使BSA的蛋白质构象发生变化。 图6(a, b)、 图7(a, b)中, 呈现“ 山脊” 形状的峰a(peak a)、 峰b(peak b)称为瑞利散射峰(λex=λem); 呈现“ 驼峰” 形状的峰1、 峰2为典型的荧光峰(2λex=λem), 其中峰1表征酪氨酸(Tyr)和色氨酸(Trp)残基, 峰2涉及多肽骨架结构, 表征BSA的二级结构[14, 15]。 当BSA溶液未加入FA时, 两峰的特征参数(λex/λem, F)分别为peak 1(280/343, 271.8), peak 2(225/340, 664.3), 峰1与峰2的荧光强度比为1:2.44; 当加入FA溶液后, FA与BSA相互作用体系的两荧光峰特征参数(λex/λem, F)为peak 1(280/344, 220.5), peak 2(225/344, 503.9), 峰1与峰2的荧光强度比为1:2.28。 从峰1和峰2的荧光强度进行分析, 加入FA溶液后, BSA的瑞利散射峰peak a和peak b和荧光峰的强度都发生明显下降, 表明BSA与FA发生相互作用后, BSA的分子表面被破坏, 蛋白质分子更加分散, 即发生解聚作用, 进而使蛋白质粒径减小, 荧光强度减弱, 进一步证明FA使BSA的二级结构发生了改变。
 | 图6 BSA溶液的三维荧光光谱图(a)和等高线图(b) c(BSA)=2.5× 10-7 mol· L-1; pH 7.40; T=298 KFig.6 Three-dimensional fluorescence spectrum and contour map of BSA c(BSA)=2.5× 10-7 mol· L-1; pH 7.40; T=298 K |
2.7.4 FA与BSA相互作用的圆二色光谱分析
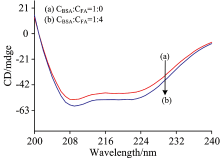
为进一步研究FA对BSA构象的影响, 扫描并记录BSA与FA浓度比1:0和1:4体系的圆二色谱图, 见图8。 从图8可得BSA在208 nm处和224 nm处出现两个负峰, 负峰代表BSA中α -螺旋(α -Helix)结构的特征峰。 将圆二色谱值导入CDNN setup v2.1软件, 软件自动计算得出BSA与FA-BSA相互作用体系特征二级结构的含量值。 在BSA与FA浓度比1:0和1:4体系中, α -螺旋占比由22.25%降至19.9%, β -折叠占比由25.8%增至33.55%, β -转角占比由17.85%增至18.45%, 无规则结构占比由34.8%降至33.6%。 二级结构含量值的变化表明, FA与BSA发生了相互作用, FA改变了BSA周围的微环境, 使BSA的二级结构发生了变化。
采用荧光光谱法、 紫外光谱法、 圆二色谱法、 三维荧光光谱法、 同步荧光光谱法与分子对接模拟法研究黄腐植酸与牛血清白蛋白相互作用的反应机理。 荧光光谱表明FA与BSA相互作用猝灭过程为静态猝灭。 根据Ross理论计算热力学参数与FA-BSA作用力类型得出, FA和BSA之间的主要作用力为氢键和范德华力, 作用过程自发放热。 通过Fö rster's共振能量转移理论计算得出BSA与FA结合距离为6.340 nm, 表明FA与BSA之间发生非辐射能量转移。 分子对接模拟结果表明FA与BSA之间结合作用力除了氢键、 疏水作用力和范德华力, 两者之间还存在不利于碰撞的作用力。 紫外— 可见吸收光谱, 同步荧光光谱, 三维荧光光谱和圆二色谱都表明FA使BSA二级结构发生改变, FA使BSA中的色氨酸(Trp)残基周围的微环境极性增强, 减弱其疏水性, 增强其亲水性。 这些结果阐明了在分子水平上黄腐植酸对于血清白蛋白的作用机理, 对未来深入研究黄腐植酸在体内的作用和黄腐植酸在医药用途上的研究和开发, 具有重要的参考价值与实际意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|