作者简介: 张燕燕, 女, 1981年生, 河南农业大学机电工程学院副教授 e-mail: zyanyan0923@163.com
植物激素脱落酸(ABA)是植物通过自身代谢产生的有机信号小分子, 在极低浓度下可对植物自身产生明显的生理效应, 是植物体内五大内源激素之一, 因能促进植物叶片的脱落而得名, 主要存在于植物干枯的叶子, 根茎、 种子等部位。 由于对植物生长的调节能力, ABA在农业工程领域有着极大的应用前景。 然而, ABA在植物体内的浓度很低, 实现超低浓度检测是ABA应用的关键。 关于ABA的检测, 文献中已经报道的方法有很多, 但是利用拉曼光谱技术对ABA的理论和实验研究还未见报道, 拉曼光谱技术有着样品前处理简单、 分析速度快、 对于检测人员要求低, 更适合于原位和现场检测等特点, 因此对ABA拉曼光谱的机理和实验研究可为在植物激素检测及鉴定中提供可靠的依据。 利用软件Gaussian09和GaussView5.0构建优化ABA的分子结构, 计算了ABA的分子能级、 前线轨道、 拉曼光谱(Raman)、 红外光谱(IR)及核磁共振谱(NMR)。 为了验证理论计算的准确性, 检测了ABA分子的IR、 Raman、 表面增强拉曼光谱(SERS)和NMR谱。 结果表明: ABA的拉曼特征峰理论计算值位于616, 1 056, 1 272和1 689 cm-1处, 实验测得的拉曼特征峰位于612, 1 048, 1 272和1 635 cm-1处, SERS实验获得的特征峰位于598, 1 032, 1 268和1 625 cm-1处, 理论计算和实验结果吻合较好; 同时对ABA在400~4 000 cm-1波长区间的IR和Raman特征峰进行了指认, 指出了其在相应的峰位置上较强拉曼光谱的分子振荡模式, 其中拉曼最强峰1 635 cm-1主要来自于ABA分子碳碳双键和碳碳单键的伸缩振动, 其中碳碳双键的伸缩振动引起的拉曼散射最强。 最后, 对比ABA的计算和实验核磁共振谱, 并进行原子归属指认和原子相对位移分析, 进一步研究了ABA的分子结构, 为ABA的痕量检测提供了一定的实验参考和理论依据。
Plant hormone Abscisic Acid (ABA) is a small molecule of an organic signal produced by the plant's own metabolism and can produce an obvious physiological effect to the plant itself in very low concentrations. ABA is one of the five endogenous hormones in plants, named for its ability to promote leaf shedding and mainly exists in the plant's withered leaves, roots, seeds etc. Because of its ability to regulate plant growth, ABA has a great prospect of agricultural engineering. However, the concentration of ABA in plants is deficient, so the detection of ultra-low concentration is the key to the application of ABA. As for the detection of ABA, there are many detection methods reported in the literature, but as far as we know, the theoretical and experimental studies on ABA by Raman spectroscopy have not been reported. Raman spectral technology has the advantages of simple sample pretreatment, fast analysis speed, low requirements for the detection personnel, and more suitable for in-situ and in-situ detection. Therefore, the experimental and mechanistic study of ABA Raman spectroscopy can provide a reliable basis for detecting and identifying plant hormones. In this paper, the molecular structure of ABA was optimized by software Gaussian09 and GaussView5. 0, and the molecular energy level, Front orbit, Raman spectrum, Infrared spectrum and Nuclear magnetic resonance spectrum of ABA were calculated. In order to verify the accuracy of theoretical calculation, the IR, Raman, SERS and NMR spectra of ABA molecules were tested. The results show that: ABA Raman characteristic peak theory calculated value at 616, 1 056, 1 272 and 1 689 cm-1, experimental measured Raman characteristic peak in 612, 1 048, 1 272, 1 635 cm-1, SERS experiment to obtain the characteristics peak is located at 598, 1 032, 1 268, 1 625 cm-1, the theoretical calculation and experimental results are in good agreement. At the same time, the infrared and Raman peaks of ABA were identified in the range of 400~4 000 cm-1, and the molecular oscillation modes of the ABA producing Raman spectrum at the corresponding Raman frequency shift were pointed out. The most substantial Raman peak of 1 635 cm-1 was mainly caused by the stretching motion of the C=C bond and the C—C bond of ABA molecules, among which the stretching vibration of the C=C bond caused the most intense Raman scattering. Finally, atomic attribution and relative atomic displacement were analyzed, and the molecular structure of ABA was further studied according to comparing the calculation with the experimental nuclear magnetic resonance spectrum of ABA. What had done in the paper provided some experimental reference and theoretical basis for the trace detection of ABA.
植物激素是由植物在自身体内合成的一类微量有机物质[1], 在植物体内某一部位产生, 再转运到作用部位[2], 在含量极低的情况下就能对植物的生长产生明显的生理效应[3]。 脱落酸(abscisic acid, ABA)是天然的生长抑制素, 因能促进植物的叶子脱落而得名[4], 具有调节植物气孔关闭、 抑制种子萌发、 促进植物休眠等作用, 在农业生产中有极大的应用前景, 因此植物中ABA的痕量检测对于构建植物激素测定的新思想新方法有着重要的意义[5]。 目前, 已经报道了多种ABA定量检测的技术, 包括气相色谱/质谱(GC/MS)[6]、 高效液相色谱/质谱(HPLC/MS)[7]、 酶联免疫吸附试验(ELISA)[8]、 毛细管电泳[9]、 化学发光法[10]及局域表面等离子共振法(LSPR)[11]等。 这些方法由于其敏感性和选择性较高可以检测植物激素到超低水平, 但是它们通常耗时, 需要繁琐的样品预处理和富集。 因此, 在农业工程的研究上非常需求发展一个敏感, 快速, 简单的植物激素测定方法, 而拉曼光谱技术因其灵敏度高、 样品前处理快速简单而广泛应用于有机、 无机和小分子检测中, 而利用拉曼光谱技术定量检测ABA的研究还未见报道。
密度泛函理论(density functional theory, DFT)是通过电子密度来研究多种领域中电子结构的领先方法[12], 利用DFT计算待测分子的分子轨道、 静电势、 电子跃迁能级可以为实验研究提供分子层面的解析。 近年来, 利用DFT理论对分子的结构进行优化研究分子光谱性能的报道越来越多, 逯美红等利用DFT对苋菜红分子结构和SERS进行研究, 得到苋菜红分子理论拉曼光谱的特征峰[13]; 何伟平等对头孢氨苄的密度泛函进行研究, 进一步验证头孢氨苄的分子结构[14]; Dikmen利用DFT对3, 5二甲氧基4羟基肉桂酸的Raman, SERS进行研究, 研究银原子与分子结构的最佳结合位点, 为3, 5二甲氧基4羟基肉桂酸的表面增强拉曼研究奠定理论基础[15]。 目前, 利用DFT理论对植物激素ABA的光谱研究还未见到报道。
从理论和实验两个方面对ABA分子的光谱和结构进行了研究, 运用Gaussian09的B3LYP/6-31G(d, p)基组研究了ABA分子的Raman, SERS和IR; 运用Gaussian的NMR方法计算ABA的NMR谱; 将所得的理论计算光谱与实验所得的谱学数据进行对比, 对分子结构进行了分析, 以保证计算得到的每一个稳定构型都对应势能面上的一个局域最小点。
实验中所用的ABA样品购自生工生物工程(上海)股份有限公司, 粉末状, 分子式为C15H20O4, 分子量为264.32 g· mol-1。 取0.5 mg的ABA粉末放于硅片上, 由显微共聚焦拉曼光谱仪(中国卓立汉光)测得ABA的拉曼光谱; 在120 ℃的条件下, 采用0.5 mL、 1%柠檬酸三钠溶液还原50 mL、 0.01%的氯金酸溶液制得微粒尺寸60 nm的金溶胶, 金溶胶的SPR峰在530 cm-1。 各取10 μ L 1 mmol· L-1的ABA溶液与60 nm的金溶胶混合, 取混合物10 μ L滴在干净的硅片上, 室温晾干, 检测其SERS光谱; ABA的红外光谱由Nexus470智能型傅立叶变换红外光谱仪(美国NICOLET)测量; 核磁共振光谱由400MR核磁共振波谱仪(美国安捷伦)测量。
采用Gaussian09和GaussVeiw5.0软件, 在DFT的 B3LYP/6-31G(d, p)基组水平上搭建分子结构优化并进行计算, 计算ABA的Raman和IR, 利用NMR的B3LYP/6-31+G(d)基组来计算NMR, 并将理论计算得到的Raman, IR, NMR与实验所得的相应光谱进行对比。
ABA分子由有39个原子和146个电子组成, 基于DFT, 使用Gaussian 09将ABA分子优化至最低能级, 结构优化计算后, 分子构型的5个最小振动频率值为: 24.83, 36.56, 39.19, 71.16和89.88, 它们对应的振动强度分别为1.538 4, 2.804 3, 2.534 0, 0.076 3和0.726 2, 说明优化后的分子无虚态, 分子结构稳定, 可以作为后续光谱分析的结构。 优化后的总能量为-884.54 eV, 偶极矩为1.435 3。 其优化后的分子结构如图1所示。
由图1可以看出, ABA的分子结构主要由C2, C3, C4, C6, C7和C8组成的环状结构和五个甲基C1-H20-H21-H22, C16-H30-H31-H32, C18-H34-H35-H36, C19-H37-H38-H39, C26-H40-H41-H42, 一个羰基C4-O5, 一个羧基C13-O14-O15-H29、 一个羟基O17-H33组成。
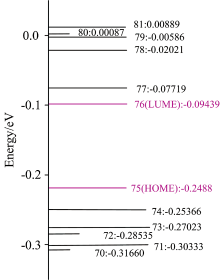
Gaussian09计算了ABA分子能量最高的6个占据轨道和能量最低的6个空轨道能级, 为了更全面地观察轨道电势分布情况, 选择对电子虚态的其中6个空轨道76— 81轨道和电子占据的其中6个轨道70— 75轨道计算电势。 如图2所示: 第75号分子轨道为HOME轨道, E75=-0.244 88 eV; 第76号分子轨道为LUME轨道, E76=-0.094 39 eV, 能隙Δ E=E76-E75=-0.150 49 eV, 能隙很小, 表明电子容易从HOME轨道跃迁到LUME轨道。
第73— 78轨道的电子云分布情况如图3所示。 从图3可以看出, ABA分子的HOME和LUME电子云呈局域分布, HOME和LUME的电子云主要分布在C原子的周围和C=C双键的两侧, C原子周围的电子密度较高, O原子的周围的电子密度次之, H原子的周围电子密度相对较低, 说明, H原子对ABA分子的拉曼光谱特性影响较小, 拉曼活性主要集中在C=C双键处。
如图4所示, ABA的拉曼特征峰主要集中在600~1 700 cm-1之间, 这个区间内分子微运动方式主要是伸缩振动和摇摆振动, 在1 800~2 900 cm-1之间没有特征峰。 计算的拉曼最强峰在1 689 cm-1, 实验拉曼的最强峰在1 635 cm-1, 实验SERS的最强峰在1 625 cm-1, 计算值较实验测定的拉曼数值和SERS测定的数值大, 这是由于在高斯的计算模拟中将分子看做是单独的, 不考虑分子之间相互作用的影响。 若高斯计算时取修正系数为0.97, 那么DFT计算所得的最强峰频移为1 638 cm-1, 与实验测的拉曼频移1 635 cm-1相差3 cm-1, 差别较小, 说明计算的拉曼频移与实验测定的拉曼频移吻合良好。
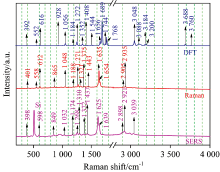 | 图4 脱落酸的DFT计算、 拉曼实验和SERS实验对比Fig.4 The comparison of DFT calculation, Raman and SERS experiment of ABA |
对比DFT计算、 Raman和SERS实验, ABA分子信号较强的拉曼峰有五个, 分别是1 635, 1 271, 1 048, 865和612 cm-1, 分别对应于ABA分子结构中碳碳双键的伸缩振动、 碳碳单键的伸缩振动、 甲基的非平面摆动、 碳碳单键的外扭式振动及碳氢键的平面和非平面摆动, 说明ABA的拉曼特征峰主要来自于碳碳双键和碳碳单键的振动, 其中碳碳双键的伸缩振动引起的拉曼散射最强, 所以1 635 cm-1可以作为ABA的拉曼特征峰用于植物激素ABA的定性和定量检测。
不同的拉曼频移对应于分子中不同原子和基团的振动, ABA的拉曼频移对应的振动模式如表1所示: 拉曼频移小于1 100 cm-1所对应的分子振动模式以C— H键的非平面遥摆振动为主; 拉曼频移在1 100~1 600 cm-1之间所对应的分子振动模式以C— C单键的非对称伸缩为主; 拉曼频移在1 600~1 800 cm-1之间所对应的分子振动模式以碳碳双键的对称伸缩为主; 拉曼频移大于2 900 cm-1时所对应的分子振动模式以C— O和C— H单键的非对称伸缩和非平面振动为主; 如: 拉曼频移在1 053 cm-1所对应分子振动为: 五个甲基的非平面振动, 以及C6-H25, C6-H24, C9-H26, C12-H28和C3-H23的平面振动, 除了O原子以外, 几乎所有的C— H都振动; 1 056 cm-1对应C10-C27的非平面振动, 四个甲基C16-H30-H31-H32, C1-H20-H21-H22, C19-H37-H381-H39, C18-H35-H36-H34的非平面振动, 但甲基C16-H30-H31-H32的振动最为剧烈; 1075对应甲基C16-H30-H31-H32的剧烈非平面振动, 其他四个甲基不动; 1 688 cm-1对应于C9-C10对称伸缩振动和C11-C12的非对称伸缩。 高斯计算后显示: 凡是拉曼峰较强的位置都反映在分子结构的整体振动上, 几乎没有原子或基团是静止不动的, 所以拉曼峰较强的位置都是几个分子或基团相应振动叠加的结果。
| 表1 脱落酸的DFT, Raman, SERS特征峰及其归属 Table 1 DFT, Raman and SERS characteristic peaks of ABA and their attribution |
红外光谱反映的是分子的振动和转动的加和表现, 不同分子的振动和转动不同, 红外光谱具有高度的特异性, 与拉曼光谱相互补充, 用于表征和鉴别各种化学物种。 图5(a, b)分别为实验检测的ABA红外光谱与计算得到的红外光谱图, 对比发现: 红外光谱的实测结果和实验结果吻合良好, 计算得到的红外光谱可作为拉曼定量检测的补充。
ABA分子结构中含有羟基和羧基, 在核磁共振检测时羟基和羧基中的氢易发生不显示的情况, 为了保证全部氢原子的相对位移都能确定, 检测时, 各取两份10 mg的ABA粉末分别溶于0.5 mL的甲醇和DMSO溶剂, 对比确定H原子的相对位移。 图6为以DMSO为溶剂ABA的1H核磁共振谱, 对比甲醇溶剂的1H谱和DMSO中的1H谱发现, 甲醇溶剂的1H谱有19个H, 而DMSO溶剂的1H谱有20个H, DMSO溶剂的1H谱比甲醇溶剂的1H谱多了羟基上的氢。 其他位置氢相对位移的实验与计算值如表2所示, 实验与计算值最大相差1.052 ppm。
| 表2 脱落酸的1H-NMR相对位移 Table 2 1H-NMR relative displacement of ABA |
图7为ABA的13C核磁共振谱, 分子结构中不同位置C原子相对位移的实验值与计算值如表3所示, 实验与计算值最大相差13.785 ppm。 实验与计算结果对比说明: 实验结果与DFT计算结果较一致, 利用DFT计算ABA的核磁共振谱可以作为对ABA分子结构研究的补充和依据。
| 表3 脱落酸的13C-NMR相对位移 Table 3 13C-NMR relative displacement of ABA |
基于密度泛函理论, 对ABA分子搭建分子结构并进行优化, 得到其稳定结构。 利用Gaussian09的B3LYP/6-31G(d, p)基组和NMR方法, 计算ABA分子的常规Raman光谱、 IR及NMR谱。 在此基础上, 实验验证了ABA的Raman、 SERS、 IR及NMR谱, 最后将计算谱图与实验结果进行对比及振动谱指认归属。 结果说明: 理论计算结果与实验研究结果吻合良好, ABA分子拉曼峰较强的位置都反映在分子结构的整体运动上, 几乎没有原子或基团是静止不动的, 拉曼峰较强的位置都是几个原子或基团相应振动叠加的结果, 信号最强的特征峰在1 635 cm-1, 主要来自于碳碳双键的剧烈伸缩振动和碳碳单键的伸缩振动, 1 635 cm-1可以作为拉曼特征峰用于ABA的定性和定量检测。 这些工作将为光谱技术在植物激素检测中的发展和应用提供一定的实验参考和理论支撑, 对后期植物激素ABA的定量检测研究提供可靠的理论基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|