作者简介: 张亚莉, 1975年生, 华南农业大学工程学院副教授 e-mail: ylzhang@scau.edu.cn
在农业生产中施用农药可提高农产品的产量, 然而农药的过量使用也威胁着我国农产品的质量安全, 因此对农产品的农药残留进行快速有效的检测成为农业生产大环境下的迫切要求。 荧光光谱分析技术具有突出的高灵敏度以及有利的时间标度, 对多组分农药残留检测具有良好的分辨能力, 与气相色谱法、 液相色谱法、 气-质联用法等农药残留检测方法相比具备前处理简单、 检测速度快等优点, 在复杂的农药残留检测环境中有较大的优势。 介绍了基于荧光光谱分析技术的农药残留快速检测方法, 概述了传统的荧光光谱分析方法在农药残留检测上的应用, 以及荧光光谱分析结合同步-导数法、 三维荧光光谱、 人工神经网络, 生物传感器, 金属纳米材料等方法与技术用于农药残留检测的研究发展现状, 分析了基于荧光光谱分析的农药残留检测现阶段仍存在的局限与挑战, 以及未来发展趋势。 荧光光谱分析技术在农药残留检测上的普遍推广及应用需通过荧光检测仪器不断朝集成化、 模块化发展来实现, 使得检测更快捷高效。
The application of many pesticides in agricultural production has increased the output of agricultural products. However, the excessive use of pesticides also threatens the food safety of agricultural products in China. Therefore, rapid and effective detection of pesticide residues in agricultural products has become an urgent requirement in the environment of agricultural production. Fluorescence spectrum analysis technology has presented outstanding high sensitivity and favorable time scale, and good resolving power for multi-component pesticide residue detection. Compared with pesticide residue detection methods such as gas chromatography, liquid chromatography and gas-mass spectrometry, fluorescence spectrum analysis technology has advantages of simple pretreatment and fast detection speed. Therefore, fluorescence spectroscopy detection technology has been well utilized in the complex pesticide residue detection environment. This article mainly introduces the rapid detection method of pesticide residues based on fluorescence spectrum analysis technology and summarizes the application of traditional fluorescence spectrum analysis methods in pesticide residue detection, as well as the combination of synchronization, derivative method, three-dimensional fluorescence spectroscopy, neural network, biosensor, metal nanomaterials. Finally, the limitations and challenges of pesticide residue detection based on fluorescence spectroscopy were analyzed. The wider application of fluorescence spectrum analysis technology in pesticide residue detection needs to be realized through the continuous development of fluorescence detection instruments towards integration and modularization, so that the detection is faster and more efficient.
农药是农业生产中必不可少的投入品, 在农业增产、 农民增收等多方面占据着重要地位。 随着生活水平的不断提高, 人们越来越关注食品的安全、 健康、 环保等问题[1]。 农业上主要使用的农药有杀虫剂、 杀菌剂、 除草剂、 植物生长调节剂等四种, 农业生产中对农药的过分依赖及不合理使用, 导致了农药残留直接或间接地危害人们的身体健康[2, 3, 4]。 庞国芳等通过“ 高分辨质谱+互联网+数据科学/地理信息” 技术, 对我国水果和蔬菜中的农药化学污染物残留水平进行了调查及数据库建设, 研究了我国各省检出的农药残留水平[5]。 研究结果表明, 全国范围内的农作物都普遍存在农药残留问题, 特别是东南地区的农药残留问题更为严重。 为了满足人们对食品安全健康的要求, 在鼓励农产品生产中使用非药剂防治病虫害的同时, 如何实现高效快速地对农药残留进行检测分析, 已成为当前农业生产中急需解决的重要问题, 也是有效控制农药残留量, 发展绿色农业的重要途径之一。
国内外发展得比较成熟的农药残留检测技术主要包括气相色谱法、 高效液相色谱法、 气-质联用法、 液-质联用法等[6, 7, 8]。 这些方法具有适应范围广, 分离效能高、 灵敏度高, 重复性好等特点[9]。 但是由于上述方法对样品的前处理过程繁琐、 具有破坏性, 且检测仪器笨重、 价格昂贵, 无法实现市场迫切需要的农药残留的快速检测。
随着荧光光谱技术的不断发展和完善, 其在农药残留快速检测中的应用与研究得到越来越多的关注[10, 11, 12]。 荧光光谱分析技术具有突出的高灵敏度以及有利的时间标度, 能够通过荧光特性反映农药残留量浓度随时间的变化规律, 使得荧光光谱检测技术在复杂的农药残留检测现场有明显的优势。 除此之外, 传统的气相色谱法等检测技术的操作需要专业人员进行, 对检测样品具有破坏性, 在实际的农业生产检测中具有局限性。 而基于荧光光谱技术能够进行无损的农药残留检测, 且研发的便携农药残留检测仪操作简单, 专业性要求低, 更具普适性[13, 14]。 本文主要介绍目前荧光光谱技术在农药残留检测中的应用现状, 并分析其优势及未来的发展趋势。
物质在吸收入射光的过程中, 光子的能量传递给了物质分子。 分子被激发后, 发生了电子从较低的能级到较高能级的跃迁。 处于这种激发状态的分子, 称为电子激发态分子。 处于激发态的分子不稳定, 它可能通过辐射跃迁和非辐射跃迁的衰变过程而返回基态。 辐射跃迁的衰变过程伴随着光子的发射, 即产生荧光。 荧光是一种光致发光现象, 由于分子对光的选择性吸收, 不同波长的入射光便具有不同的激发效率, 分子内激发与衰变过程如图1所示[15]。
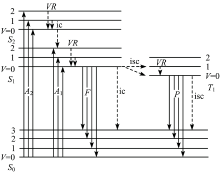 | 图1 分子内的激发和衰变过程[15] A1, A2: 吸收; F: 荧光; P: 磷光; ic: 内转化; isc: 系间窜越; VR: 振动松弛Fig.1 Intramolecular excitation and decay process[15] A1, A2: Absorption; F: Fluorescence; P: Phosphorescence; ic: Internal conversion; isc: Inter-faculty; VR: Vibration relaxation |
在不同物质分子结构不同以及相同物质浓度不同的情况下, 其最后产生的荧光特性也不尽相同。 根据这些特性, 可以对物质进行定性或定量的分析[16, 17]。 荧光光谱法就是利用某些物质被紫外光或可见光照射后产生的能够反映该物质特性的荧光进行分析的方法。
传统的荧光光谱分析在农药残留检测上的应用一般是面向具有荧光效应的物质。 被检测物质拥有较明显的荧光特性, 可以通过荧光光谱直接对其相关特性进行分析。
孙俊等[18]采用荧光光谱技术对抗寒奶油生菜不同浓度的乐果农药残留进行了快速无损定性检测。 结果表明, 应用荧光光谱技术对生菜农药残留鉴别是可行的。 王晓燕等[19]利用荧光分光光度计对典型食品果汁(苹果汁和桃汁)与百菌清混合体系进行了荧光光谱检测, 其研究结果表明荧光光谱法能够检测果汁中百菌清残留, 还可直接选用荧光原始光谱进行建模分析。
荧光光谱技术具有灵敏度高, 选择性好且不破坏样品的优点, 是一种简便有效的对目标物质进行定性定量分析的方法。 传统的基于荧光光谱分析的农药残留检测技术, 可通过采集得到的样本原始光谱图对其荧光光谱特征进行分析, 并通过其光谱特征建立荧光光谱特征与物质特性的关系, 从而分析得到相应的预测模型, 以便后面的研究及应用。
传统的基于荧光光谱技术的农药残留检测技术对于组分较为复杂的检测对象或者是本身不具备荧光效应的检测对象难以发挥作用。 当检测对象的组分较为复杂的时候, 所获取的原始光谱图错综复杂, 难以通过直接分析样品原始光谱图或者通过简单算法进行预处理后获得试验所需要的有用信息, 从而进行预测模型的建模。 不具备荧光效应的检测对象更是缺乏最基本的传统荧光光谱分析的条件, 无法进一步获取检测对象的荧光光谱图。 因而, 为了进一步扩宽荧光光谱技术的应用广度, 学者们进行了荧光光谱检测技术与其他技术结合的探索, 以实现对农药残留检测的多样化和普适性。
在农业生产当中, 为了提高对病虫害的防治效果, 增加农作物的产量, 会采用农药混合搭配使用的方法。 一般说来, 科学地将农药进行配合使用可以使得农药最大限度的发挥其防治病虫害的效果, 但是不合理的农药搭配则会对农作物产生危害, 导致农作物病化甚至是死亡[20, 21]。 因而, 在农药残留的快速检测当中, 面对的不仅是单一组分农药残留检测的问题, 更多时候是多组分农药残留的检测。
在对多组分农药残留物进行检测的过程中, 由于其组分间结构和化学性质的相似性, 采用传统的荧光光谱分析采集出来的荧光光谱图像会出现严重重叠的情况, 不利于后续的分析。 为了解决上述问题, 使用拉曼光谱的方法对多组分混合物检测是一大趋势。 但是拉曼光谱分析过程涉及较复杂的算法计算过程, 不利于实现快速的农药残留检测。 而同步-导数荧光光谱法具有简化荧光谱图、 窄化谱带、 提高选择性、 减少光散射干扰等特点。 利用荧光同步扫描即可获得多组分农药残留基本分离的荧光光谱图, 再使用导数方法进行处理, 可对多组分农药的光谱图进行完全分离, 从而进行定性、 定量分析, 提高检测的灵敏度。 同时, 同步-导数荧光光谱法对多组分农药残留中的低浓度成分的鉴定效果也较好[22]。 因而, 同步-导数荧光光谱法成为分析多组分农残的重要方法。
王玉田等[23]应用同步-导数荧光光谱分析对西维因和克百威两种常用农药的荧光光谱进行研究。 试验对两者混合溶液进行了同步荧光光谱扫描, 并做了一阶导数处理。 实验结果表明, 常规荧光光谱扫描得到的光谱图, 两者荧光光谱都具有宽带的结构, 谱图严重重叠。 而采用同步-导数荧光光谱法得到的光谱, 两者完全得到了分离, 消除彼此的干扰, 能够对两者的混合溶液进行同时测定。 El-ghobashy等[24]利用同步-导数荧光光谱分析的方法克服了格列喹酮及其碱性降解产物正常荧光光谱的重叠现象, 得到了快速测定药品中的格列喹酮含量的检测方法。
同步-导数荧光光谱法在多组分农药残留检测中能够利用其独特的优势实现多组分的同时检测, 大大提高对多组分农药残留物的分辨能力, 提高灵敏度, 获得理想的光谱图[22, 25]。 一般情况下, 同步-导数荧光光谱法可以将互相重合的荧光光谱图进行进一步简化, 从而提高检测的科学性, 准确性以及加快检测效率。
但同步-导数荧光光谱法的缺点在于, 不能对所有的多组分农药残留检测都发挥其独特的优越性。 对于部分多组分农药残留物的检测, 常规的荧光光谱法可能更适用。 王晓燕等[19]的研究结果表明, 对于某些混合农药液体来说, 导数光谱模式下的荧光光谱图与原始光谱下的荧光光谱并没有太大的区别。 因而, 如果直接对多组分农药残留进行同步荧光光谱扫描, 可能会造成部分试验的复杂化。 为了能够准确地使用同步-导数荧光光谱法, 保证能够真正发挥其特有的优势, 在后续的研究中应当多进行经验积累, 建立适合采用同步-导数荧光光谱法进行检测的多组分农药残留的数据库。
传统的荧光光谱分析在农药残留检测上的应用都是分析物质的二维荧光光谱图, 其中包含激发光谱图、 发射光谱图。 二维荧光光谱图只能分析其中两个因素之间的关系, 即激发波长与荧光强度、 发射波长与荧光强度之间的关系。 而三维荧光光谱是指将荧光强度以等高线方式投影在分别以激发光波长(EX)和发射光波长(Em)为纵、 横坐标的平面上获得的谱图, 图像直观, 所含信息丰富。 三维光谱图主要有两种表现形式: 三维荧光立体图(以发射光波长为X轴, 激发光波长为Y轴, 荧光强度为Z轴)、 荧光强度等高线图(发射光波长为X轴, 激发光波长为Y轴, 荧光强度为平面上的点), 如图2所示。 因此, 三维荧光光谱图能够直观描述物质荧光强度随发射波长和激发波长变化的三维变化关系, 使得能够更为直观地观察到物质的三维荧光特性, 一定程度上简化了试验过程。 三维荧光光谱图具有指纹性, 能够在多组分混合物中对特定物质进行定性、 定量分析, 也因此被广泛应用于农药残留检测, 环境污染检测等各个领域[26]。
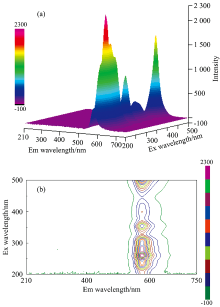 | 图2 三维荧光光谱图 (a): 三维荧光立体图; (b): 三维荧光等高线图Fig.2 Three-dimensional fluorescence spectrum (a): Three-dimensional fluorescence stereogram; (b): Three-dimensional fluorescence contour map |
王书涛等[27]基于三维荧光光谱分析对多环芳烃的荧光信息进行处理, 结果证明基于三维荧光光谱分析和PARAFAC算法对苊与萘的混合溶液进行分析, 能够有效判别混合样品的类别及浓度。
三维荧光光谱具有选择性好, 灵敏度高, 重现性好的优点。 其直观的三维荧光光谱图又称为三维荧光指纹, 能够通过其对农药残留的种类进行快速的简单判别, 同时光谱相关数据也更简单明了。
但是三维荧光光谱仍然具有其局限性, 首先是要求试验样品须具有荧光特性才能捕捉到荧光信息, 而对于本身不具备荧光特性的样品, 需考虑通过增加荧光物质间接反映荧光特性。 其次是三维荧光谱图的特征受外界温度、 pH值、 金属离子及其他离子等因素以及地球生物化学作用的影响较大, 对于多组分系统, 复杂混合物质的分析能力有限[28]。 因而, 需要进一步对各种农药的三维荧光指纹光谱的特征进行研究, 尽可能完善农药的荧光指纹光谱图谱库, 为后续的三维荧光分析提供便利。 最后是三维荧光光谱分析所需用来分析的样品用量少, 还需考虑试验结果的代表性问题。 因此, 可以考虑采取大范围取样, 多次扫描, 综合评价的方法来提高结果的代表性。
人工神经网络具有强大的自学习、 自组织、 自适应以及容错能力, 克服了传统人工智能方法在直觉识别、 语音识别, 非结构化的信息处理能力等方面的不足, 因此在光谱领域也被广泛应用于非线性校准、 模式识别、 数据分析、 图像信息处理等[29]。 将荧光光谱技术与人工神经网络结合起来能够更为有效快速、 全面地对实验数据进行处理, 达到充分利用荧光数据、 优化参数、 对荧光光谱相差不大的组分进行有效区分、 鉴别的效果[30]。 实验表明, 基于人工神经网络得到的预测模型能够得到更为准确有效的数据结果。
Itakura等[31]通过荧光光谱技术对不同成熟度的柑橘皮进行荧光扫描, 获得对应的荧光光谱图。 然后使用卷积神经网络分析荧光光谱, 从而建立起荧光强度和柑橘甜酸度的关系, 用于判断农业生产中柑橘的成熟度。 研究表明, 利用卷积神经网络分析荧光光谱, 最后得到的柑橘甜酸度绝对误差值比以前研究中用其他方法得到的值好得多。
除此之外, 人工神经网络也应用在基于荧光光谱的农药残留检测研究。 王雷等[32]应用基于BP神经网络的荧光光谱法对啶虫脒农药残留量中的荧光混合光谱进行分离, 设计了能够快速检测固体表面啶虫脒农药残留量的荧光光谱测量系统。 王书涛等[33]采用FS920稳态荧光光谱仪和遗传算法优化的径向基函数神经网络的分析方法, 对绿茶和铁观音这两种茶叶中的氯菊酯农药残留量的含量进行了检测。 实验结果表明, 三维荧光分析技术与遗传算法优化的径向基函数神经网络相结合的方法, 检测的灵敏度及检出限都大大提高。
在基于荧光光谱分析的农药残留检测中结合人工神经网络对荧光光谱进行信息处理及分析, 能够更为科学、 高效地提取光谱图像信息, 获得更优的检出限及更精确的预测结果。 得到的预测模型及预测系统为现场的农残快速检测提供了更多的可能性。 但现阶段人工神经网络仍然存在不足的地方, 如人工神经网络具有很强的非线性校正功能, 但在校正时, 需要大量的数据进行训练, 其模型的应用会受到限制。 同时, 如何高效地确定神经网络的参数及结构, 特别是确定神经网络中隐层的神经元的数目, 一直是神经网络研究的重难点。 此外, 神经网络全局搜索能力比较差, 目前其与遗传算法的结合运用是解决这个不足的重要研究方向。 因而, 如何克服人工神经网络技术存在的不足, 将荧光光谱信息通过人工神经网络得到最大的利用, 还需要不断地深入研究, 进行相关的技术融合。
生物传感器一般由生物物质和换能器组成, 通过酶、 抗体、 核酸、 细胞等生物分子感受到被测目标物的信息, 通过换能器将该信息转化为可以识别的电信号、 光信号或者其他可以接受信号的一种装置。 生物传感器具有测试精确度高, 特异性强且操作简单, 方便携带等特点, 因而亦被广泛应用于农业中的农药残留量的快速检测当中[34, 35, 36]。 在生物传感器中融入具有荧光效应的物质形成荧光探针或者利用被测物质的荧光特性进行检测, 能够使得检测效果更为直观明显。 在农药残留的快速检测当中, 生物传感器以其高敏感度, 高专一性等优势得到了较多的应用。 其中, 对于有机磷农药残留检测的应用最为广泛, 其主要传感原理是有机磷农药的不同浓度会对乙酰胆碱酶的活性造成不同程度的影响, 从而检测指标得到不同的荧光效应[37, 38, 39, 40]。
Sun等[41]研制了一种有机磷农药荧光生物传感器。 用pH指示剂CdTe量子点作为光传感器, 研究了被分析物对酶的抑制作用。 通过壳聚糖的介导作用, 静电吸附将识别元件乙酰胆碱酯酶和CdTe固定在石英表面, 形成自组装多层膜, 如图3所示。 该传感器的荧光效应会随着农药存在与否, 农药的浓度大小而发生变化。 同时, 其易于再生, 对有机磷农药具有良好的稳定性和选择性。 除了在有机磷农药残留上的应用外, 生物传感器在其他农药残留检测上也有所发展及应用。 Chang等[42]研制了一种简单、 经济的用于蔬菜样品中对氧乙基农药检测的单发光学探针。
使用具有荧光探针的生物传感器, 不仅可以拥有生物传感器高专一性、 高选择性、 易于携带以及便于实时分析的性能, 还能充分运用荧光探针突出的光学特性, 使得在检测过程中的观察分析更为具体直观。 但目前生物传感器的应用仍然存在的局限主要是酶生物传感器中酶的固定问题。 如何找到普遍适用的理想的酶固定方法, 从而保证酶的活性以及使其与目标分子更好的结合, 需要进一步完善和改进。
针对荧光生物传感器存在的问题, 许多研究者采用了纳米材料构建生物传感器的方法来进行改善。 纳米材料分为许多种类, 如金属纳米材料, 金属氧化物纳米材料等。 但大部分纳米材料都具备比表面积大、 导电性能强的优点, 把纳米材料用于构件生物传感器能够使其充分发挥优势, 通过静电吸附或者共价键结合的形式将更多的酶吸附到电极表面, 从而大大提高了生物传感器的灵敏性、 稳定性和重复性[43]。 纳米材料能够很好的改善传统的生物传感器所存在的问题, 特别是酶活性失活的问题。
金属纳米材料除了用于生物传感器的构建之外, 还可以直接作为荧光探针用于农作物农药残留量的检测。 其主要利用金属纳米材料独特的光学性质和表面识别能力。 部分金属纳米材料具有优异的荧光猝灭能力, 因此可以根据这一特性, 观察含有金属纳米材料的溶液在加入某样物质前后不同的荧光效应来对该物质进行定性与定量分析。 除此之外, 部分金属纳米材料在实验中可以成为间接影响荧光效应的因素。 金属纳米材料与荧光光谱的结合运用在农药残留检测当中具体很大的研究意义与发展前景[44]。
Luo等[45]研究了基于RB-Ag/Au双金属纳米粒子的超灵敏荧光传感器在有机磷农药检测中的应用。 实验主要是通过RB-Ag/Au-NPS在遇到有机磷农药前后不同的荧光效应而对有机磷农药进行定性定量的分析。 RB-Ag/AuNPs对有机磷农药的检测机理如图4所示。
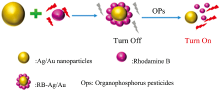 | 图4 RB-Ag/AuNPs对有机磷农药的检测机理[53]Fig.4 Detection mechanism of RB-Ag/AuNPs for organophosphorus pesticides[53] |
这种合金结构与光学的综合运用, 更多地被应用到生物传感器的研究上。 Hsu等[46]研究设计了一种纳米银修饰的氧化多壁碳纳米管用于对乐果的检测; Li等[47]研究开发了一种基于柠檬酸封端银纳米粒子和乙酰胆碱的生物传感器, 用于对不同水样中有机磷农药敌百虫的快速检测; Lang等[48]研究开发了一种基于金纳米棒(AuNRs)的灵敏乙酰胆碱酯酶(AChE)生物传感器, 用于有机磷农药的检测。 金属纳米与光学结合运用的生物传感器, 使得农药残留的检测变得更为快速及准确。
然而, 现阶段纳米材料的制备技术尚不完善, 纳米材料的形态、 尺寸控制以及其纯化的技术还需要不断地提高改善。 这也是基于金属纳米材料与荧光光谱结合的农药残留检测技术中所需要克服的问题。
荧光光谱分析技术已在农药残留检测方面展现了其独特的优异性。 为了更直观地反映上述六种荧光光谱分析方法的特点, 对其进行了表格汇总, 如表1所示。
| 表1 基于荧光光谱分析的农药残留检测方法 Table 1 Pesticide residue detection methods based on fluorescence spectrum analysis |
荧光光谱检测具备高灵敏度, 高效率, 以及高重现性, 能够帮助实现农业生产中农药残留的快速检测。 但目前荧光光谱分析方法用于农药残留检测存在以下挑战:
(1)荧光光谱检测对检测对象要求高
荧光是光致发光的效果, 事实上并不是所有的农药或者被检测的物质都具有天然的荧光特性。 因而, 对于无荧光效应的农药残留检测, 需通过间接的方法获取其相关荧光光谱图, 如荧光探针以及光化学诱导荧光(PIF)检测的应用。 目前, PIF检测技术在解决不具备自然荧光的农药残留检测的问题具有很好的效应, 能够通过用紫外光照射分析物, 将其转化为高荧光的光产物, 从而增强荧光, 以便进行荧光分析[49, 50]。
(2)荧光光谱检测受环境因素影响大
荧光光谱检测的结果受外界环境因素的影响较大, 如试验使用的溶剂, 温度, pH值等因素。 以上因素都可能会影响到荧光光谱检测的结果, 对于检测结果分析造成干扰, 影响分析结果的可靠性以及科学性。 因而, 在未来的研究中, 需进一步发现更合适的方法去提高检测环境的稳定性, 进一步保证检测结果的科学性。 同时, 要继续更新及完善有关农药的荧光光谱图库, 对不同种类农药建立对应的指纹图谱, 从而更好地排除外界因素对荧光光谱图的干扰。
(3)荧光光谱检测预测模型应用广谱性低
荧光光谱检测存在适应性差、 应用范围不够广泛的问题。 这是因为目前进行荧光光谱分析所得出的预测模型基本都是针对某一种或者是某几种农药进行试验得出, 只能应用于相应的农药残留检测。 如果能够把试验所得的各种农药残留的预测模型结合起来, 使得检测仪器可以对多种类的农药进行农药残留检测, 将能大大提高荧光光谱检测的适用性。
因此, 检测仪器的便携性、 集成度、 稳定性必将是未来研究发展的趋势。
(4)荧光光谱检测的成本高
现阶段基于荧光光谱的农药残留检测大部分还是在实验室内进行, 很难真正应用到农作物市场或者是农场上。 其中除了一部分是受试验环境要求较高的影响之外, 还有一部分是因为检测成本的问题。 检测的相关设备, 试验使用的试剂以及试验仪器价格昂贵, 也是荧光光谱技术难以在农药残留检测上大展身手的原因之一。 因而, 未来基于荧光光谱的农药残留检测仪器应当逐渐集成化, 模块化, 通过与其他新兴技术与新型材料进行结合, 朝更为轻便, 大众的方向发展。
随着科技的发展及各学科的融合, 基于荧光光谱技术的农药残留检测方法将进一步完善和推广, 对保障食品安全和环境的可持续发展发挥重要作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|



