作者简介: 万红兵, 1977年生, 中国农业科学院北京畜牧兽医研究所博士研究生 e-mail: wanhongbing2014@sohu.com
熟度是指牛排烹煮到可食用的程度, 是影响牛排的适口性和消费者满意度的重要因素。 肌原纤维蛋白是肌肉中一类重要的盐溶性结构蛋白群, 其热凝胶特性与肉品品质密切相关。 加热是使生肉变熟的关键工艺, 近年来, 国内外在加热过程对肌原纤维蛋白凝胶特性及其结构变化影响方面开展了广泛的研究, 但在熟度对牛肉蛋白结构影响研究方面却鲜有报道。 为了探究熟度对肌原纤维蛋白结构影响及其变化机理, 在现代红外光谱分析的基础上, 将ATR-FTIR技术与二维相关光谱相结合, 利用红外光谱、 二阶导数光谱和二维相关光谱动态跟踪熟制过程蛋白结构变化规律, 说明蛋白在烹饪过程的主要变化, 为揭示熟度引起的蛋白构象变化机理和西餐牛排烹饪工艺优化提供理论依据。 结果表明, 在1 700~1 500 cm-1波数范围内, 熟度对肌原纤维蛋白特征吸收峰强度影响显著, 从特征峰强度变化趋势可见, 肌原纤维蛋白特征峰强度呈阶段性变化: 第一阶段, 从对照组到一分熟, 特征峰强度下降, 属于加热初期; 第二阶段, 从一分熟到五分熟, 特征峰强度无显著变化, 属于加热中期; 第三阶段, 从五分熟到过熟, 特征峰强度继续减弱, 属于加热后期; 同步谱分析结果表明, 在1 650, 1 640, 1 556和1 540 cm-1附近出现自相关峰, 且自相关峰两两之间的交叉峰均为正交叉峰, 说明这些自相关峰对于熟度变化较为敏感, 且峰强度与蛋白烹饪熟度之间呈正相关; 由自相关峰光谱强度顺序可以看出, 五分熟是蛋白温度敏感区变化的转折点, 在从对照组到五分熟的烹饪过程中, 肌原纤维蛋白的温度敏感重点区域位于酰胺Ⅱ带, 而在从五分熟到过熟的烹饪过程中, 蛋白的温度敏感重点区域位于酰胺Ⅰ带的α-螺旋结构。 得到的这些由熟度变化引起的肌原纤维蛋白分子结构动态变化的微观信息, 可为西餐牛排烹饪工艺过程控制和优化提供理论依据。
Degree of doneness(DOD)is an important factor affecting the palatability and consumer satisfaction of steak. Myofibrillar proteins are important structural proteins, which are closely related to meat quality. Heating is the key technology of meat processing. In recent years, there were lots of articles that reported the effects of thermal treatment on the structural properties of myofibrillar proteins, but few reports on the effects of DOD on its structure. Based on modern infrared spectroscopy, the attenuated total reflectance Fourier transform infrared spectroscopy (ATR-FTIR)was combined with two-dimensional correlation spectroscopy, using infrared spectroscopy, second derivative spectroscopy and two-dimensional correlation spectroscopy to track the cooking process of myofibrillar proteins dynamically. The main changes in the protein cooking process were explained by analyzing the trend and regularity of characteristic peaks. The results showed that in the range of 1 700~1 500 cm-1, DOD had a significant effect on myofibrillar proteins' characteristic absorption peak. As the DOD increased, the intensity change of myofibrillar proteins characteristic peak was divided into three stages: the first stage was the initial stage of heating, and the intensity decreased from control to rare; the second stage was the middle stage of heating, from rare to medium. There was no significant change in peak intensity; the third stage was the late stage, from medium to over-cooked, and the peak intensity decreased significantly. The synchronous spectrum analysis results showed four autopeaks near 1 650, 1 640, 1 556, 1 540 cm-1, and the cross peaks between the two autopeaks were all positive. The autopeaks intensity analysis results showed that the medium was the turning point of the change of the protein's temperature sensitive region. When proteins were cooked from control to medium, the amide II band was the sensitive region of myofibrillar proteins, while the sensitive region was the α-helix of amide I banded when proteins were cooked from medium to over-cooked. The information of the dynamic changes of myofibrillar proteins molecular structure caused by cooking provided a theoretical basis for the control and optimization of Western steak cooking.
随着牛肉产业的发展和居民消费水平的提高, 我国居民肉类消费结构正逐步由单一的猪肉消费向牛肉等多元肉类消费结构发展, 与此同时, 牛排以较高的营养价值和独特的风味逐渐被国人认可。 牛排的引入, 打破了国内牛肉产品以酱卤制品为主的单一现状, 并受到国人的热情追捧。 熟度是指牛排烹煮到可食用的程度, 是影响牛排的适口性和消费者满意度的重要因素。 在西餐中, 通常将牛排的熟度分为一分熟(rare)、 三分熟(medium-rare)、 五分熟(medium)、 七分熟(medium-well)、 全熟(well-done)和过熟(over-cooked)六个程度, 不同熟度的终点温度分别为52~55 ℃, 55~60 ℃, 60~65 ℃, 65~69 ℃, 70~80 ℃和> 90 ℃。
肌原纤维蛋白是肌肉中一类重要的结构蛋白质, 主要由肌球蛋白、 肌动蛋白、 肌动球蛋白、 原肌球蛋白、 肌钙蛋白等多种蛋白组成, 约占肌肉蛋白质总量的50%~55%, 除了参与肌肉收缩, 影响肌肉嫩度外, 对肉品品质和功能特性具有重要的影响。 加热是使生肉变熟的关键环节, 是食品加工过程中的重要工艺。 加热过程不仅可以提高产品货架期, 同时还可赋予产品特有的色泽和风味, 影响产品质地和消费者的购买意愿, 而这些品质的变化主要取决于肌原纤维蛋白的热变化。
近年来, 在加热过程对肌原纤维蛋白结构变化影响方面, 文献报道很多, 但在烹饪熟度对蛋白构象影响研究方面却鲜有报道。 随着光谱技术的发展, 衰减全反射傅里叶变换红外光谱技术(attenuated total reflectance Fourier transform infrared spectroscopy , ATR-FTIR)在生物大分子、 农产品品质监测、 生化反应动力学等领域得到了广泛的应用, 成为表征和理解蛋白质结构的技术之一[1]。 二维红外相关光谱技术的发展, 使得红外光谱的分辨率和谱图识别能力有了新的突破, 并在蛋白构象分析领域得到了广泛应用[2, 3]。 本实验从分子水平出发, 利用现代红外光谱技术, 将ATR-FTIR与二维相关光谱相结合, 依次从红外谱、 二阶导数谱、 二维相关谱逐级对肌原纤维蛋白熟制过程进行动态跟踪, 通过分析谱图特征峰变化趋势和规律, 说明蛋白烹饪过程中的主要变化, 以期为牛排烹饪工艺研究提供理论依据。
牛肉样品由河北省廊坊市大厂回族自治县某企业提供。 采集6头36月龄的相同饲养方式的本地黄牛, 按照《牛屠宰操作规程》(GB/T19477—2004)进行屠宰。 宰后在0~4 ℃的冷库中吊挂排酸48 h, 然后取左半胴体背最长肌, 剔除多余的脂肪和结缔组织, 而后切成100 g左右的肉块, 装入真空包装袋, 真空包装后放入-28 ℃以下的冷库中, 使肉块的中心温度在48 h内达到-18 ℃以下, 最后冰运至实验室, 贮存于-18 ℃低温冰箱中备用。 肌原纤维蛋白提取前, 肉样在0~4 ℃下解冻12 h。
TENSOR 27傅里叶变换红外光谱仪(德国布鲁克光谱仪器公司); Avanti J-26S XP高速冷冻离心机(美国贝克曼库尔特商贸有限公司); UltraTurraxT25 BASIS高速匀浆机(德国IKA公司); HI99163 HANNA酸度计(意大利Hanna仪器设备公司); BS214D型电子天平(北京赛多利斯仪器系统有限公司); HH-4型可调恒温数显水浴锅(江苏省金坛市荣华仪器制造有限公司)。
1.3.1 肌原纤维蛋白的提取
肌原纤维蛋白提取参考Doerscher等[4]的方法, 在低温(0~4 ℃)下提取。 蛋白浓度采用双缩脲法进行测定, 提取的蛋白质在4 ℃下保存, 24 h内用完。
1.3.2 样品制备
用0.6 mol·L-1 NaCl, 0.05 mol·L-1 Na2HPO4/NaH2PO4, pH 7.0的缓冲溶液, 将肌原纤维蛋白浓度调至10 mg·mL-1, 取10 mL分装到试管中, 室温下保持2 h, 而后分别置于54 ℃(rare)、 58 ℃(medium-rare)、 63 ℃(medium)、 68 ℃(medium-well)、 72 ℃(well-done)、 100 ℃(over-cooked)的水浴锅中保温15 min, 以未经加热处理的样品作为对照(control), 保温结束后, 立即取出置于0~4 ℃的冰浴中存放过夜, 第2天进行后续试验。
1.3.3 肌原纤维蛋白ATR-FTIR光谱测定
参考Gangidi等[5]的方法, 并略作修改。 取适量不同熟度的肌原纤维蛋白溶液置于ATR附件上进行扫描, 通过扣除0.6 mol·L-1 NaCl, 0.05 mol·L-1 Na2HPO4/NaH2PO4, pH 7.0的缓冲溶液背景进行基线校准, 扫描范围4 000~400 cm-1, 信号扫描累加64次, 扫描分辨率为4 cm-1, 采集红外光谱图。 每种处理图谱扫描重复三次。
1.3.4 数据处理与分析
采用Origin 8.5软件对不同熟度肌原纤维蛋白的红外光谱进行原始、 二阶导数光谱数据处理; 采用2D Shige软件进行二维相关光谱分析, 并利用Origin 8.5软件绘制二维相关光谱图。
在室温(25 ℃)下, 牛肉背最长肌肌原纤维蛋白的红外光谱如图1所示, 肌原纤维蛋白的红外光谱具有一些典型的特征峰, 其谱峰归属如下: 3 500~3 250 cm-1左右的吸收峰归属为O—H伸缩振动、 N—H伸缩振动以及结合水中的O—H基团与氨基酸中的C=O所形成的分子内和分子间氢键; 1 639 cm-1处归属为酰胺Ⅰ带C=O对称伸缩振动特征峰, 与氢键作用力密切相关; 1 550 cm-1处归属为酰胺Ⅱ 带N—H弯曲振动与C—H伸缩振动特征吸收峰; 1 078 cm-1左右的吸收峰主要是C—O键、 C—N—C键的伸缩振动峰。
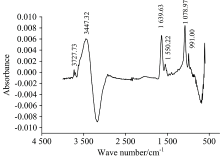 | 图1 肌原纤维蛋白红外光谱图Fig.1 ATR-FTIR spectra of beef myofibrillar proteins recorded at room temperature (25 ℃) |
在红外光谱中, 酰胺Ⅰ带(1 700~1 600 cm-1)被广泛用于蛋白质的二级结构分析[6, 7]。 近年来, 随着科学技术的发展和进步, 酰胺Ⅲ带(1 330~1 200 cm-1)也被用于蛋白质结构区域分析[8], 并探讨其内部氢键结合情况; 但本研究发现, 酰胺Ⅲ带在红外光谱中吸光强度较弱, 没有出现特征峰, 故在下面选用1 700~1 500 cm-1波段, 开展肌原纤维蛋白红外谱、 二阶导数谱以及二维相关光谱分析研究。
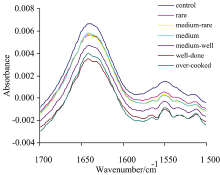
图2可见, 烹饪熟度对肌原纤维蛋白特征吸收峰强度影响显著(p< 0.05)。 从特征峰强度变化趋势可见, 肌原纤维蛋白特征峰强度变化分为三个阶段: 第一阶段, 从对照组到一分熟, 属于加热初期, 特征峰强度下降; 第二阶段, 从一分熟到五分熟, 属于加热中期, 峰强度无显著变化; 第三阶段, 从五分熟到过熟, 属于加热后期, 峰强度继续减弱。 这与肌肉蛋白组成及其变性温度有关, 肌原纤维蛋白是肌肉中一类重要的结构蛋白质群, 主要由肌球蛋白和肌动蛋白组成, 二者的变性温度分别为: 50~60 ℃和70~80 ℃[9]。 在加热过程中, 从对照组到一分熟, 此时蛋白的终点温度约为54 ℃左右, 肌球蛋白和少量不耐热的蛋白发生变性引起特征峰强度减弱; 当肌原纤维蛋白被加热至五分熟时, 蛋白的终点温度从54 ℃升高至63 ℃左右, 在这个过程中, 仍以肌球蛋白变性为主, 故特征峰强度无显著变化; 继续加热, 随着蛋白熟度的进一步增加, 肌动蛋白发生变性, 肌原纤维蛋白完全变性, 另一方面, 随着熟度的增加, 部分蛋白发生一定的分解, 从而导致蛋白特征峰强度显著减弱。
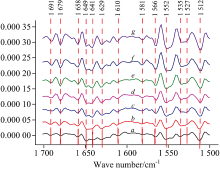
图3可见, 通过对不同熟度肌原纤维蛋白红外光谱进行二阶导数分析, 结果表明, 对照组样品的红外光谱共分辨出13个特征吸收峰, 其中酰胺Ⅰ带有7个, 酰胺Ⅱ 带有6个。 随着蛋白熟度的增加, 1 528 cm-1处的峰消失, 同时又出现了4个新的吸收峰, 其中, 在一分熟时出现1 666 cm-1处的峰, 并且在熟制过程中峰位保持稳定; 在三分熟时出现1 599和1 622 cm-1处的峰, 峰位随熟度的增加呈现先减小后增大的变化趋势; 在过熟时出现1 589 cm-1处的峰, 此时肌原纤维蛋白红外光谱共有16个特征吸收峰。
图4可见, 在1 700~1 500 cm-1波数范围内, 不同熟度的肌原纤维蛋白同步二维相关红外光谱主要在1 650, 1 640, 1 556和1 540 cm-1附近出现自相关峰, 分别归属于α -螺旋、 无规则卷曲和酰胺Ⅱ 带[10], 表明这些峰所对应的基团对于熟度的变化较为敏感, 另一方面, 自相关峰两两之间的交叉峰均为正交叉峰, 说明自相关峰光谱强度与蛋白熟度之间呈正相关。 从自相关峰光谱强度顺序可以看出, 五分熟是蛋白温度敏感区变化的转折点, 当蛋白熟度低于五分熟时, 1 540 cm-1附近的相关峰强度最大; 而当蛋白熟度高于五分熟时, 1 650 cm-1附近的相关峰强度达到最大, 上述结果表明, 在中低熟度(一分熟至五分熟)下, 蛋白酰胺Ⅱ 带对熟度变化更敏感, 而在中高熟度(五分熟至全熟)下, 蛋白酰胺Ⅰ带的α -螺旋结构对熟度变化更敏感, 综上所述, 随着熟度的增加, 肌原纤维蛋白温度敏感重点区域由酰胺Ⅱ 带转移至酰胺Ⅰ带的α -螺旋结构。
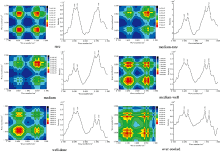 | 图4 不同熟度肌原纤维蛋白同步二维相关红外光谱图Fig.4 Synchronous spectra of beef myofibrillar proteins with different degrees of doneness in the range of 1 700~1 500 cm-1 |
造成上述现象的原因可能是由于酰胺Ⅰ和Ⅱ 带化学键的振动模式及其力常数的不同所致。 酰胺Ⅰ带主要以C=O键对称伸缩振动为主, C=O键的力常数为12 N·cm-1; 而酰胺Ⅱ 带的振动模式为N—H键弯曲振动与C—H键伸缩振动, 其中, N—H键、 C—H键的力常数分别为6.4和4.8 N·cm-1, 均小于C=O键的力常数, 二者的化学键强度均小于C=O键的强度, 所以, 在中低熟度牛排的烹饪过程中, 酰胺Ⅱ 带对熟度的敏感性更高, 而在中高熟度牛排的烹饪过程中, 酰胺Ⅰ带对熟度的敏感性更高。
运用衰减全反射傅里叶变换红外光谱、 二维相关光谱分析研究了烹饪熟度对肌原纤维蛋白构象的影响, 不同熟度蛋白的红外光谱、 二阶导数谱和二维同步相关光谱的变化规律和趋势分析结果表明, 在1 700~1 500 cm-1波数范围内, 不同熟度肌原纤维蛋白同步二维相关红外光谱在1 650, 1 640, 1 556和1 540 cm-1附近出现自相关峰, 且自相关峰两两之间的交叉峰均为正交叉峰, 说明这些自相关峰对于熟度变化较为敏感, 且峰强度与蛋白熟度之间呈正相关; 由自相关峰光谱强度顺序可以看出, 五分熟是蛋白温度敏感区变化的转折点, 随着烹饪熟度的增加, 肌原纤维蛋白温度敏感重点区域由酰胺Ⅱ 带转移至酰胺Ⅰ带的α -螺旋结构。 由烹饪熟度变化引起的肌原纤维蛋白分子结构动态变化的微观信息, 为西餐牛排烹饪工艺控制和优化提供了理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|