作者简介: 李会吉, 1987年生, 郑州师范学院化学化工学院讲师 e-mail: huijili@zznu.edu.cn
水体中砷的去除与其水化作用密切相关, 而不同质子化砷和砷酸铁水化特征相关报道甚少, 且缺乏不同质子化砷和砷酸铁水化层红外光谱解析。 在B3LYP/6-311G(d, p)计算水平上比较不同质子化砷酸根[HmAsO4]m-3(m=0~2)和铁-砷酸盐络合物种[FeHmAsO4]m+(m=0-2)水化能, 利用约化密度梯度函数图形化分析其与水分子相互作用的强度、 类型和位置, 并解析不同质子化砷酸根和砷酸铁水化层红外光谱特征。 结果表明, 随着氢质子化, 砷酸根[HmAsO4]m-3(m=0~2)水化能力减弱, 而铁-砷酸盐络合物种[FeHmAsO4]m+(m=0~2)水化能力随着氢质子化增强。 当水分子中1个氢与[HmAsO4]m-3(m=0~2)中1个氧相互作用时倾向形成氢键; 而水分子中2个氢同时分别与[HmAsO4]m-3(m=0~2)中两个氧相互作用时, 相互作用变弱, 以范德华力相互作用; 水分子通过其氢与砷酸根中氧形成的氢键强于水分子通过其氧与质子化砷酸根中氢形成的氢键。 未质子化ON倾向与2~4个水分子形成氢键, 而质子化OP最多与2个水分子形成氢键且OP…HW氢键弱于ON…HW氢键。 红外光谱中, 2 954, 3 114, 3 179, 3 252和3 297 cm-1是AsO43-第一水化层中水分子Ow—Hw伸缩振动峰, 3 277, 3 324和3 376 cm-1是HAsO42-第一水化层中水分子的Ow—Hw伸缩振动峰, 3 189, 3 277, 3 306和3 383 cm-1是H2AsO4-第一水化层中水分子Ow—Hw伸缩振动峰; [FeHmAsO4]m+(m=0~2)第一水化层中水分子Ow—Hw伸缩振动对应区域依次是2 500~3 060, 2 660~3 200和2 900~3 360 cm-1。 因此, 随质子化, [HmAsO4]m-3(m=0~2)和[FeHmAsO4]m+(m=0~2)第一水化层中水分子的Ow—Hw伸缩振动峰蓝移; 相对于[HmAsO4]m-3(m=0~2), [FeHmAsO4]m+(m=0~2)第一水化层水分子的弯曲振动峰和伸缩振动峰都明显红移。 [FeHmAsO4]m+(m=0~2)第一水壳层形成Fe—Ow—Hw…Ow—Hw…ON—As氢键桥, 该氢键桥中Ow—Hw具有特殊吸收峰, 伸缩振动峰依次位于2 195, 2 526和2 673 cm-1, 质子化导致明显蓝移但峰强度几乎无变化; 而其弯曲振动峰随质子化红移且强度明显降低; 独立OP—H伸缩振动峰不受Fe络合影响, 而OP—H…Ow中OP—H伸缩振动峰位置因Fe络合而发生明显蓝移。 该研究有助于更好地解析不同PH下砷和砷酸铁在水中溶解性, 可用于红外光谱监测水溶液中砷和砷酸铁水化特征。
The removal of arsenate in water is closely related to its hydration, but there are few reports on the hydration characteristics of different protonated arsenates and iron arsenates, and there is no correlation analysis on infrared spectra of hydration layers of protonated arsenates and iron arsenates. The hydration energies of different protonated arsenates [HmAsO4]m-3(m=0~2) and iron arsenates [FeHmAsO4]m+(m=0~2) were compared at B3LYP/6-311G(d, p) level. Reduced density gradient functions conducted graphical analyses for the intensities, types and locations of the interaction between water molecules with [HmAsO4]m-3(m=0~2) and [FeHmAsO4]m+(m=0~2). And, the characteristics of infrared spectra of the hydration layers of different protonated arsenates and iron arsenates were analyzed. The results show that the hydration of [HmAsO4]m-3(m=0~2) gradually decreases with hydrogen protonation, while the protonation enhances the hydration of [FeHmAsO4]m+(m=0~2). Hydrogen bonds tend to form when a water molecule hydrogen interacts with an oxygen of [HmAsO4]m-3(m=0~2). However, when two hydrogens of water molecules simultaneously interact with two oxygens of [HmAsO4]m-3(m=0~2), the interaction becomes weaker, and the van der Waals force appears. The hydrogen bond formed by water molecules through hydrogen with the oxygen of arsenates is stronger than the hydrogen bond formed by water molecules through oxygen with the hydrogen of protonated arsenates. The unprotonated ON tends to form hydrogen bonds with 2~4 water molecules, while the protonated OP forms hydrogen bonds with at most 2 water molecules, and the OP…HW hydrogen bond is weaker than the ON…HW hydrogen bond. In the infrared spectra, 2 954, 3 114, 3 179, 3 252 and 3 297 cm-1 is the stretching vibration peaks of Ow—Hw in the first hydration shell of As43-; 3 277, 3 324 and 3 376 cm-1 is the stretching vibration peaks of Ow—Hw in the first hydration shell of HAs42-; 3 189, 3 277, 3 306 and 3 383 cm-1 is the stretching vibration peaks of Ow—Hw in the first hydration shell of H2As4-. The stretching vibration regions for Ow—Hw in the first hydration shell of [FeHmAsO4]m+(m=0~2) are 2 500~3 060, 2 660~3 200, 2 900~3 360 cm-1. Therefore, the stretching vibration regions for the first hydration waters of [HmAsO4]m-3(m=0~2) and [FeHmAsO4]m+(m=0~2) have blue shifts with protonation. Compared with [HmAsO4]m-3(m=0~2), the water molecules in the first hydration layers of [FeHmAsO4]m+(m=0~2) exhibit a significantly red shift of the bending vibration peaks and stretching vibration peaks in the infrared spectra. The hydrogen bond bridge Fe—Ow—Hw…Ow—Hw…ON—As is formed in the first hydration shell of [FeHmAsO4]m+(m=0~2). The Ow—Hw in this hydrogen bond bridge has a special absorption peak, such as the stretching vibration peak located in 2 195, 2 526 and 2 673 cm-1, respectively. Its stretching vibration peak is significantly blue-shifted, but the peak strength is almost unchanged, while its bending vibration peak is red-shifted with the protonation and the strength is significantly reduced. The stretching vibration peak of independent OP—H is not affected by the complexation of Fe, while the position of stretching vibration peak for OP—H in OP—H…Ow is significantly blue shifted, due to the complexation of Fe. This study is helpful to understand better the solubility of arsenates and iron arsenates in water at different pH.
砷是水环境中最危险污染物之一, 受自然释放和采矿、 冶金、 煤矿、 化工等人类活动影响, 地下水和冶炼金属废水中砷污染越来越严重[1]。 砷的去除已经成为一个亟待解决问题。
基于Gaussian 09软件通过B3LYP/6-311G(d, p)方法搜寻[HmAsO4(H2O)12]m-3(m=0~2)和[FeHmAsO4(H2O)30]m+水化团簇稳定构型。 Fe采用Stuttgart赝势基组, As, H, O采用6-311G(d, p)基组; 能量分析时考虑基组重叠误差校正。 [HmAsO4(H2O)12]m-3(m=0~2)和[FeHmAsO4(H2O)30]m+(m=0~2)水化能计算公式
红外光谱数据采取0.967因子校正, 0.8 cm-1因子展宽。 结合可视化软件VMD, 采用波函数分析软件Multiwfn中约化密度梯度函数可视化分析[HmAsO4]m-3和[FeHmAsO4]m+物种与水相互作用类型、 位置及强度。
2.1.1 砷物种水化能及与水相互作用图形化分析
利用水化能计算公式, 可得[HmAsO4]m-3(m=0~2)水化能和热力学参数, 见表1。 随质子化, [HmAsO4]m-3(m=0~2)水化能力减弱。 [HmAsO4]m-3(m=0~2)第一水化层水分子数依次是11, 10和8,
| 表1 [HmAsO4]m-3(m=0~2)水化能和水化热力学参数(298 K) Table 1 Hydration energies and Hydrated thermodynamic parameters of [HmAsO4]m-3(m=0~2) |
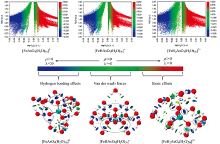
图1中蓝色代表相互作用相对强的氢键、 绿色代表范德华力作用、 红色代表立体位阻效应。 散点图中横轴sign[λ2(r)]ρ (r)数值越小, 相互作用越大。 [AsO4(H2O)12]3-散点图中位置最负的(-0.040 a.u.)为水分子中HW与
相对于[AsO4(H2O)12]3-, [HAsO4(H2O)12]2-散点图中在sign[λ2(r)]ρ (r)< 0区域出现最负峰更往右, 表明水分子与
2.1.2 水化层红外光谱分析
[HmAsO4(H2O)12]m-3(m=0~2)红外光谱中700和864 cm-1分别对应As—OP和As—ON伸缩振动, 和Makreski等[10]红外光谱实验中As—OP和As—ON伸缩振动峰650~750和860 cm-1一致。 从而证明[HmAsO4(H2O)12]m-3(m=0~2)理论红外光谱是合理的。 在Hunter等[11]的水体红外光谱实验中水分子弯曲振动峰为1 645 cm-1, 伸缩振动峰为3 413 cm-1。 图2(a)所示[AsO4(H2O)12]3-的理论红外光谱图中, 1 694 cm-1对应水分子弯曲振动, 2 954, 3 114, 3 179, 3 252和3 297 cm-1对应Ow—Hw…ON中Ow—Hw伸缩振动; 3 350~3 650 cm-1 属于Ow—Hw…Ow中Ow—Hw伸缩振动, 对应Hunter等[11]红外光谱实验中水分子伸缩振动峰。 可见, 相对于水体,
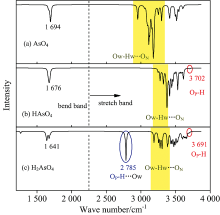 | 图2 [HmAsO4(H2O)12]m-3(m=0~2)物种水化层的理论红外光谱Fig.2 Theoretical infrared spectra for hydration layers of [HmAsO4(H2O)12]m-3(m=0~2) species |
[HAsO4(H2O)12]2-[图2(b)]和[H2AsO4(H2O)12]-[图2(c)]中水分子弯曲振动峰分别为1 676和1 641 cm-1。 随着质子化, [HmAsO4]m-3(m=0~2)第一水壳层中水分子弯曲振动峰红移。 图2(b)中3 277, 3 324和3 376 cm-1对应[HAsO4(H2O)12]2-的Ow—Hw…ON中Ow—Hw伸缩振动, 图2(c)中3 189, 3 277, 3 306和3 383 cm-1对应[H2AsO4(H2O)12]-的Ow—Hw…ON中Ow—Hw伸缩振动。 随着质子化, Ow—Hw…ON中Ow—Hw伸缩振动峰蓝移, 峰强度减弱。 [HAsO4]2-中独立OP—H伸缩振动峰为3 702 cm-1, [H2AsO4]-中独立OP—H伸缩振动峰为3 691 cm-1, OP—H…Ow中OP—H伸缩振动峰为2 785 cm-1。
2.2.1 水化能和电荷分析
铁盐除砷效果与[FeHmAsO4]m+(m=0~2)物种的水化特性密切相关。 由表2中[FeHmAsO4]m+(m=0~2)的水化能和热力学参数可知, 砷酸根的质子化导致[FeHmAsO4]m+(m=0~2)更易被水化。 利用Multiwfn软件分析[HmAsO4(H2O)12]m-3和[FeHmAsO4(H2O)30]m+(m=0~2)的Hirshfeld电荷, 如图3。 铁离子与[HmAsO4]m-3的络合使[HmAsO4]m-3负电荷减少; 随质子化, 铁所带正电荷略增加。
| 表2 [FeHmAsO4]m+(m=0~2)水化能和水化热力学参数(298 K) Table 2 Hydration energies and hydrated thermodynamic parameters of [FeHmAsO4]m+(m=0~2) |
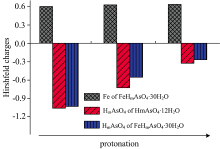 | 图3 [HmAsO4(H2O)12]m-3和[FeHmAsO4(H2O)30]m+(m=0~2)中Fe和HmAsO4的Hirshfeld电荷Fig.3 The Hirshfeld charges for Fe and HmAsO4 of [HmAsO4(H2O)12]m-3 and [FeHmAsO4(H2O)30]m+(m=0~2) |
2.2.2 相互作用图形化分析
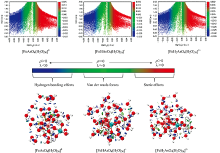
与图1中[HmAsO4(H2O)12]m-3物种散点图相比, 图4中[FeHmAsO4(H2O)30]m+(m=0~2)散点图明显复杂很多, 而图4中RDG填色等值面图可直观发现, 随着质子化, [FeHmAsO4(H2O)30]m+(m=0~2)团簇中[HmAsO4]m-3与水形成氢键的能力增强, 但与[HmAsO4]m-3相比, [FeHmAsO4(H2O)30]m+(m=0~2)团簇中[HmAsO4]m-3与水形成氢键能力仍明显降低。
2.2.3 砷酸铁水壳层红外光谱分析
[FeHmAsO4]m+(m=0~2)周围水分子弯曲振动峰依次位于图5(a)中1 628 cm-1附近(蓝色圈内)、 图5(b)中1 610 cm-1附近和图5(c)中1 593 cm-1附近, 质子化导致[FeHmAsO4]m+(m=0~2)周围水分子弯曲振动峰红移。 相对于[HmAsO4]m-3(m=0~2)水化层中水分子弯曲振动峰, [FeHmAsO4]m+(m=0~2)周围水分子弯曲振动峰明显红移, 且峰强度明显减弱。 非常有趣地发现, [FeHmAsO4(H2O)30]m+(m=0~2)中Fe第一水化层和[HmAsO4]m-3(m=0~2)第一水化层形成Fe—Ow—Hw…Ow—Hw…ON—As氢键桥, 该氢键桥中Ow—Hw具有特殊红外光谱峰。 [FeAsO4(H2O)30]0的氢键桥中Ow—Hw的弯曲振动峰位于1 764 cm-1和伸缩振动峰位于2 195 cm-1; [FeHAsO4(H2O)30]+的氢键桥中Ow—Hw的弯曲振动峰位于1 700 cm-1和伸缩振动峰位于2 526 cm-1; [FeHAsO4(H2O)30]+的氢键桥中Ow—Hw的弯曲振动峰位于1 679 cm-1和伸缩振动峰位于2 673 cm-1。 随着质子化, [FeHmAsO4]m+(m=0~2)物种第一水壳层氢键桥中Ow—Hw的弯曲振动峰发生红移且强度明显降低, 而其伸缩振动峰发生明显蓝移但峰强度几乎没有变化。
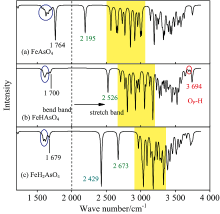 | 图5 [FeHmAsO4]m+(m=0~2)物种水化层的理论红外光谱Fig.5 Theoretical infrared spectra for hydration layers of [FeHmAsO4]m+(m=0~2) species |
图5(c)中2 429 cm-1处峰是[FeH2AsO4(H2O)30]2+中Fe第一水化层水分子即将水解特征峰, 对应Fe—Ow—Hw…Ow中Ow—Hw键长为0.103 nm, 明显长于普通Ow—Hw键长(0.098 nm)。 FeAsO4第一水化层水分子伸缩振动峰位于2 500~3 060 cm-1, [FeHAsO4]+第一水化层水分子伸缩振动峰位于2 660~3 200 cm-1, [FeH2AsO4]2+第一水化层水分子伸缩振动峰位于2 900~3 360 cm-1。 随着质子化, [FeHmAsO4]m+(m=0-2)第一水化层水分子伸缩振动峰蓝移。 相对于[HmAsO4]m-3(m=0~2)第一水化层红外光谱, [FeHmAsO4]m+(m=0~2)第一水化层水分子的弯曲振动峰和伸缩振动峰都发生了明显的红移。 图5(b)中 [FeHAsO4(H2O)30]+的独立OP—H伸缩振动峰位于3 694 cm-1, 相对于[HmAsO4]m-3(m=0~2)中独立OP—H伸缩振动峰几乎无移动。 图5(c)的[FeH2AsO4(H2O)30]2+中OP—H…Ow中OP—H伸缩振动峰为3 298和3 329 cm-1, 相对于[H2AsO4(H2O)12]-物种的峰发生了明显蓝移。 可见, 独立OP—H伸缩振动峰不受Fe络合影响, 而OP—H…Ow中OP—H伸缩振动峰受Fe络合影响。
铁盐除砷剂去除水体中砷的效果与砷物种水化特征、 铁-砷酸盐络合物种的水化特征密切相关。 在B3LYP/6-311G(d, p) 计算水平上搜寻[HmAsO4(H2O)n]m-3(m=0~2)和[FeHmAsO4(H2O)n]m+(m=0~2)优势物种, 分析其水化特征和水化层红外光谱。 结果表明, 受质子化影响, 随着[HmAsO4(H2O)n]m-3(m=0~2)水合团簇中氢离子数量的增加, 处于其第一配位层的水分子数目逐渐减少, Hm
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|