作者简介: 祖丽德孜·努兰, 1995年生, 清华大学环境学院硕士研究生 e-mail: zldz19@mails.tsinghua.edu.cn
汞是一种具有显著积累效应和遗传毒性的重金属元素, 对人体健康和生态环境危害极大。 我国水环境中汞污染严重, 开发快速、 高效、 经济的汞离子检测方法可以有效推动水环境中汞污染的源头治理。 该研究创新性地提出利用硫胺素-三维荧光法来实现水环境中汞离子的检测。 研究结果表明, 硫胺素与汞离子发生氧化还原反应前后, 其荧光峰的位置与数量发生了明显改变, 可作为检测水中汞离子的特征性信号。 此外, 在利用该法检测水中汞离子时, 硫胺素的浓度不宜过高, 体系应保持碱性环境, 反应温度与反应时间可由一级动力学模型来优化, 以期降低检测成本, 提高检测效率。 在指定的检测条件(硫胺素浓度为10 μmol·L-1、 pH为9.7、 反应时间为120 min、 温度为20 ℃)下, 汞离子浓度的线性检测范围为4~15 μmol·L-1。 硫胺素-三维荧光法与传统的水中汞离子的检测方法相比具有突出优势和良好的实际应用价值, 可以有效助力水环境中汞污染的源头监管, 极大提升环境执法效率。
Mercury is a heavy metal element with significant accumulation effect and genotoxicity, which is extremely harmful to human health and the ecological environment. In China, the water environment is facing serious problems of mercury pollution. Developing rapid, efficient, and economical method for mercury ion detection can effectively promote the source control of mercury pollution in the aquatic environment. This study innovatively proposed a method, namely thiamine-fluorescence excitation-emission matrix (EEM), to monitor mercury ion in the water environment. Results showed that the position and number of fluorescence peaks of thiamine significantly changed after it happed redox reaction with mercury ion, which could be used as a characteristic signal for detecting mercury ions in water. In addition, when using this method to detect mercury ions in water, it was suggested that the concentration of thiamine should not be too high, and the reaction system should be kept in the alkaline environment. The reaction temperature and reaction time could be further optimized by the first-order kinetic model to reduce the detection cost and improve the detection effectiveness. Under the specific detection conditions (thiamine concentration 10 μmol·L-1, pH 9.7, reaction time 120 min, temperature 20 ℃), the linear detection range of mercury ion concentration was suggested to 4~15 μmol·L-1. The thiamine-EEM method owns outstanding advantages and good practical application values compared with the traditional method of mercury ion monitoring in water, which can effectively help the pollution source supervision of mercury in water environment and greatly improve the efficiency of environmental law enforcement.
汞是一种具有显著积累效应和遗传毒性的重金属元素, 对人体有较强的致畸性和神经毒性, 严重危害人体健康[1]。 汞在水体中主要以Hg2+形态存在。 Hg2+在水体中能够被微生物还原为Hg0, Hg0易挥发进入大气被人体吸入体内; 同时水体中的Hg2+又可以被微生物转化为毒性更强的烷基汞, 并最终通过食物链富集至人体体内[2]。 金属冶炼、 煤电、 化工等行业的快速发展加剧了汞的排放[3], 大量含汞物质泄漏至水环境中, 对人体健康造成了极大威胁。 我国是全球汞污染最严重的国家之一, 2010年, 全国地表水中汞的排放量达到了1.8 t[4]; 2016年, 我国近岸海域中汞的排放量达到了39 t[5], 水环境中的汞污染问题已不容忽视, 急需加强对水环境中汞污染的治理。 治理的要义在于源头监管, 而保障监管效能的手段在于发展行之有效的检测方法。
目前, 检测水体中汞离子的方法主要包括: 电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry, ICP-MS)[6]、 阳极溶出伏安法[7]、 冷原子吸收分光光度法[8]。 ICP-MS法设备昂贵且易受有机物干扰; 阳极溶出伏安法存在重复性较差、 维护成本高等缺点; 冷原子吸收分光光度法包含消解及加热过程, 检测成本高、 操作难度大、 二次污染风险高。 不难看出, 现有的水中汞离子检测方法普遍存在成本高昂、 测试复杂、 周期冗长等不足。 因此, 建立快速、 准确、 经济的汞离子检测方法, 将会极大提高水体中汞污染的检测效率, 助力汞污染的源头监管。
三维荧光光谱(fluorescence excitation-emission matrix, EEM), 是一种可以同步记录荧光信号随激发波长及发射波长变化的矩阵光谱, 它可以提供废水中溶解性有机物的丰富信息[9]。 三维荧光技术因其具有快速、 灵敏、 预处理简便、 无额外试剂引入、 所需样品少等优点而逐渐受到关注。 近年来, 多项研究表明, 三维荧光技术可以实现对水体中污染物的监测与早期预警, 还可以应用于污水处理的全过程监测[10]。 硫胺素是一种常见的荧光有机物, 可以与汞离子发生氧化还原反应[11]。 硫胺素被氧化后其三维荧光信号可能发生变化, 利用三维荧光技术检测硫胺素反应前后三维荧光信号的差异, 就能实现水中汞离子的快速检测与预警。 本研究旨在探究硫胺素-三维荧光法检测水中汞离子的可行性, 研究了不同测试条件对汞离子检测的影响。 此外, 还对本方法开展了抗干扰性研究。 目前, 尚未见有利用硫胺素-三维荧光法检测水中汞离子的报道。 本研究为水环境中汞离子的快速、 精准检测提供了一种可行的方法, 具有良好的应用前景。
本研究所需试剂及溶液如表1和表2所示。 实验所用溶剂均为超纯水。
| 表1 本研究所需试剂 Table 1 The chemical reagent of this study |
| 表2 本研究所需溶液 Table2 The solution of this study |
pH的测试由pH计(Mettler-Toledo, 瑞士)完成。 三维荧光光谱的测试由三维荧光分光光度计(Hitachi, F-2700, 日本)完成。 测试条件为: 扫描速率12 000 nm· min-1, 激发波长220~450 nm, 发射波长250~550 nm, 波长间隔5 nm。
在硫胺素溶液浓度为10.00 μ mol· L-1, pH为4.9~11.3的条件下测试了其三维荧光光谱, 如图1所示。 结果表明, 当溶液pH为4.9~10.0时, 硫胺素溶液的荧光信号不明显; 当溶液pH为10.6~11.3时, 硫胺素溶液在类腐殖质区产生了明显的荧光信号[12], 在激发/发射波长(记作Ex/Em)为230(295)/405 nm处出现了两个荧光峰(峰a和峰b)。 两个荧光峰的强度均随溶液pH的升高而升高。 硫胺素分子中包含有噻唑鎓结构, 该结构在碱性条件下可能发生去质子化作用, 改变了硫胺素分子的最低激发单重态, 从而在碱性条件下出现了荧光信号。
2.2.1 硫胺素浓度
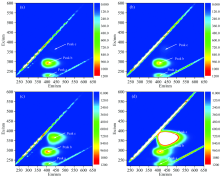
设定氯化汞浓度为10.00 μ mol· L-1, 改变溶液中硫胺素的浓度, 分别为0.01, 0.10, 1.00和10.00 μ mol· L-1, 检测不同硫胺素浓度下溶液的EEM, 如图2所示。 显然, 当氯化汞与硫胺素发生氧化还原反应后, 被氧化后的硫胺素的荧光信号与被氧化前相比发生了变化。 在硫胺素浓度为10.00 μ mol· L-1时, 峰a的位置发生了红移, 由Ex/Em=230/405 nm位移至Ex/Em=230/425 nm处; 峰b的位置并未发生明显改变。 同时, 在Ex/Em=365/440 nm处出现了一个新的荧光峰(峰c)。 硫胺素被汞离子氧化前后荧光信号的变化初步表明: 利用硫胺素-三维荧光法测定水中汞离子的方法是可行的。
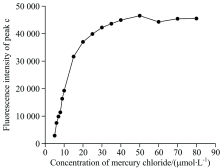
此外, 如图3所示, 随着硫胺素浓度的提高, 峰c的荧光强度也随之升高。 进一步的研究表明, 当硫胺素浓度提高至100.00 μ mol· L-1时, 峰c的荧光强度超过了三维荧光光谱仪的测试量程, 表明利用本方法测定水中汞离子时, 硫胺素浓度不宜过高。
 | 图3 峰c的荧光强度随硫胺素浓度的变化关系Fig.3 The relationship between the fluorescence intensity of Peak c and the concentration of thiamine |
2.2.2 pH
设定氯化汞及硫胺素的浓度均为10.00 μ mol· L-1, 改变溶液的pH, 分别为4.9, 6.2, 7.6, 8.6, 9.7, 10.7, 11.5和11.8, 并检测不同pH下溶液的EEM。 峰c的荧光强度随pH的变化关系如图4所示。 随着pH的升高, 峰c的荧光强度呈现先增长后下降的趋势。 其中, 当pH为8.5~11.0时峰c的荧光强度相对较高, 在pH为9.7时峰c的荧光强度达到最大值, 表明利用硫胺素-三维荧光法检测水中汞离子时, 体系环境宜为碱性。
2.2.3 温度-时间
由前文分析可知, 当氯化汞及硫胺素浓度均为10.00 μ mol· L-1, 溶液pH为9.7时, 峰c的荧光强度为最大。 因此, 本小节以上述条件作为反应的初始条件, 分别在20, 30和40 ℃条件下, 记录峰c的荧光强度随时间的变化关系, 如图5所示。 在三个温度条件下, 峰c的荧光强度均呈现随时间增长而逐渐升高的趋势, 且荧光峰强度在60~120 min期间增长缓慢, 趋于平缓。 此外, 在相同反应时间下, 峰c的荧光强度随温度的升高而升高。
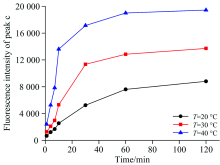 | 图5 峰c的荧光强度随温度及时间的变化关系Fig.5 The relationship between the fluorescence intensity of Peak c, temperature, and time |
为了深入分析峰c的荧光强度与反应时间的关系, 分别对20, 30和40 ℃条件下峰c的荧光强度(I)随反应时间(t)的变化曲线进行一级动力学和二级动力学拟合, 拟合结果如表3所示。
| 表3 不同温度下峰c荧光强度与反应时间关系曲线的动力学拟合 Table 3 Kinetic estimation of relationship curve between fluorescence intensity of peak c and reaction time in different temperature |
结果表明, 不同温度下峰c的荧光强度随反应时间的变化曲线与一级动力学和二级动力学模型的拟合度均较高, 相关系数均在0.97以上。 但是, 相同条件下, 一级动力学模型的相关系数均高于二级动力学模型, 表明不同温度下峰c的荧光强度随反应时间的变化关系更符合一级动力学模型。 同时, 进一步将反应温度与一级动力学模型中的速率常数进行线性拟合, 关系如式(1)所示
式(1)中, v为反应的速率常数(min-1), T为反应温度(℃), 相关系数R2为0.998 5。
将式(1)带入表1中的一级动力学方程, 可得式(2)
式(2)中, I为峰c的荧光强度, T为反应温度(℃), t为反应时间(min)。
综合式(2)不难看出, 提高反应温度和反应时间, 峰c的荧光强度将会随之升高, 但是过度提高反应温度会增加硫胺素-三维荧光法的测试成本, 反应时间过长还会降低硫胺素-三维荧光法的测试效率。 因此, 可以利用式(2)对硫胺素-三维荧光法的反应温度和反应时间进行优化。 例如, 若反应温度为20 ℃, 则峰c的最大荧光强度为8 892.4, 若要令峰c的荧光强度达到最大荧光强度的97%, 则反应时间控制在114 min即可。
为了构建峰c的荧光强度与水中汞离子浓度的关系, 需要建立特定测试条件下汞离子测定的标准曲线。 以本研究为例, 设定反应体系中硫胺素的浓度为10 μ mol· L-1、 pH为9.7、 反应时间为120 min(为便于时间控制, 将反应时间由114 min调整至120 min)、 反应温度为室温(20 ℃)。 在上述测试条件下, 通过改变体系中氯化汞的浓度(4~80 μ mol· L-1), 探究峰c的荧光强度与汞离子浓度的线性区间, 如图6所示。
显然, 峰c的荧光强度随氯化汞浓度的升高而升高并逐渐趋于稳定。 在低浓度范围内(4~15 μ mol· L-1), 峰c的荧光强度与汞离子浓度呈现良好的线性关系。 对该段曲线进行线性方程拟合, 结果如式(3)所示。
式(3)中, I为峰c的荧光强度, c为氯化汞浓度(μ mol· L-1)。
探究了硫胺素-三维荧光法检测水中汞离子的可行性,
并研究了不同测试条件(硫胺素浓度、 pH、 反应温度、 反应时间)对水中汞离子测定的影响。 同时, 在特定的测试条件下, 初步构建了汞离子测试的标准曲线。 结果表明:
(1)硫胺素在酸性至中性条件下未见明显的荧光信号, 在pH为10.6~11.3时, 硫胺素在Ex/Em=230(295)/405 nm处出现了峰a和峰b两个荧光峰, 且它们的荧光强度随pH升高而升高;
(2)当硫胺素与氯化汞发生氧化还原反应后, 峰a的位置由Ex/Em=230/405 nm位移至Ex/Em=230/425 nm, 峰b的位置未发生明显改变, 且在Ex/Em=365/440 nm处产生了新的荧光峰c。 硫胺素反应前后荧光信号的变化初步验证了硫胺素-三维荧光法检测水中汞离子的可行性;
(3)使用该法检测水中汞离子时, 硫胺素浓度不宜过高, 体系环境宜为碱性, 反应温度及反应时间可利用一级动力学模型进行优化, 以降低检测成本, 提高检测效率;
(4)当硫胺素浓度为10 μ mol· L-1、 pH为9.7、 反应时间为120 min、 温度为室温(20 ℃)时, 可得到汞离子浓度的线性检测范围为4~15 μ mol· L-1。
本研究为快速、 准确、 经济地检测水中汞离子提供了一种可行方法, 值得深入研究并进一步推广。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|