作者简介: 唐谷华, 女, 1997年生, 暨南大学生物矿化与结石病防治研究所硕士研究生 e-mail: 1215372181@qq.com
人体尿液中存在大量具有生物表面活性的物质, 而这些物质与尿液中不同形貌的草酸钙微晶间的吸附关系并未得到人们广泛关注。 挑选了常用的阴离子表面活性剂磺基琥珀酸钠二辛酯(AOT)作为吸附物质, 研究了不同形貌的二水草酸钙(COD)晶体对AOT的吸附差异, 探究草酸钙结石的形成机理。 采用X射线粉末衍射仪(XRD)和傅里叶变换红外光谱仪(FTIR)表征, 并通过谱图差异分析了吸附AOT前后棒状、 圆钝形、 花状、 十字形和双锥形COD晶体的组分变化; 采用Zeta电位分析仪测定吸附AOT后晶体表面的Zeta电位随AOT浓度的变化; 采用比色法通过紫外可见分光光度计测定不同浓度AOT存在下晶体的吸附量变化并绘制吸附曲线。 随着AOT浓度的增加, COD的吸附量逐渐上升, 最后达到吸附饱和状态, 各吸附曲线均呈S型。 不同形貌COD对AOT的最大吸附量大小顺序为: 棒状COD (41.0 mg·g-1)>圆钝形COD (37.5 mg·g-1)>花状COD (35.0 mg·g-1)>十字形COD (27.2 mg·g-1)>双锥形COD (20.9 mg·g-1)。 COD晶体的比表面积越大, 表面提供的活性位点也越多, 越有利于表面活性剂AOT在晶体表面的吸附; 富含Ca2+的(100)晶面更利于阴离子的AOT的优先吸附; 此外COD晶体的内能越大, 越会抑制AOT在COD表面的吸附, 导致吸附量降低。 吸附了AOT的COD晶体稳定性显著增加, COD向COM转变的速度明显降低。 基于AOT在不同形貌的COD晶体表面的吸附特点, 提出了COD晶体吸附AOT的分子模型。 COD晶体对AOT的吸附与晶体形貌密切相关。 容易吸附AOT的COD晶体形貌更容易粘附在带负电荷受损伤的细胞表面, 加大草酸钙结石形成的风险。
There are many biosurfactant substances in human urine, and the adsorption relationship between these substances and calcium oxalate crystallites with different morphologies has not received widespread attention. In this study, the commonly used anionic surfactant sodium dioctyl sulfosuccinate (AOT) was selected as the adsorbing substance. The adsorption differences of AOT onto calcium oxalate dihydrate (COD) with different morphologies were studied to calcium oxalate stone’s formation mechanism. The crystalline phase transition of COD with different morphologies (Rod, Blunt, Flower, Cross, Bipyramid) before and after AOT adsorption was analyzed using an X-ray powder diffractometer Fourier-transform infrared spectrometer. Zeta potential changes on crystal surface after AOT adsorption was measured using a Zeta potential analyzer. The adsorption quantity of different AOT concentrations onto various COD crystals was detected using a colorimetric method, and the adsorption curves were drawn. As c(AOT) increases, the number of COD adsorbed increases gradually, and finally reaches saturation, and the adsorption curves are all S-type. The order of maximum adsorption of AOT by different morphologies of COD is: COD(Rod) (41.0 mg·g-1)>COD(Blunt) (37.5 mg·g-1)>COD(Flower) (35.0 mg·g-1)>COD(Cross) (27.2 mg·g-1)>COD(Bipyramid) (20.9 mg·g-1). The larger the specific surface area of the COD crystal was, and the more active sites were provided, so the stronger the adsorption capacity would be; the (100) surface of COD, which is rich in Ca2+ ions, is beneficial to AOT adsorption; the larger the internal energy of COD crystal was, the lower the adsorption amount would be. COD crystals’ stability in suspension adsorbed is obviously increased after AOT adsorption, and the rate of COD transition to COM is obviously reduced. Based on the adsorption characteristics of AOT on the surface of COD crystals with different morphologies, we propose a molecular model for the adsorption of AOT onto COD crystals. The adsorption of AOT by COD crystals is closely related to crystal morphology. The morphology of COD crystal that easily adsorbs AOT is more likely to adhere to injured cells’ surface with negative charges, thus leading to an increasing risk of calcium oxalate stone formation.
草酸钙肾结石的形成包括四个过程: 晶体的成核、 生长、 聚集及晶体与细胞的粘附[1, 2, 3]。 人体尿液中存在大量具有生物表面活性的物质, 如磷脂类有机物、 蛋白质、 氨基酸、 尿酸性粘多糖和胆汁盐等[4, 5, 6, 7]。 这些物质可改变尿液表面张力, 影响离子在晶体界面的吸附和扩散, 造成晶体表面电荷密度的差异, 从而影响尿微晶的生长和聚集。
带电荷的表面活性剂会选择性地吸附在相反电荷密度高的晶面, 影响晶体生长的择优取向性[8, 9], 进而影响晶体的最终形貌。 Fischer等[10]研究了具有不同链长的聚谷氨酸(Glun)对草酸钙形成的影响。 当谷氨酸链长n=10时, Glu10诱导的晶体主要为四角双锥形的二水草酸钙(COD)晶体; 而Glu20则诱导生成(100)面明显拉长的棒状COD, 归因于Glu20含有的大量带负电荷的羧基容易吸附在COD的正电荷密度相对较高的(100)面上, 使得(100)面的生长停止, 从而促进其向垂直(100)面的方向上生长。 Wei等[11]研究了十六烷基三甲基溴化铵(CTAB)和十二烷基硫酸钠(SDS)对草酸钙晶体生长习性的影响。 在c(CTAB)=1 mmol· L-1时主要生成“ 蝴蝶形” 一水草酸钙(COM)晶体, 当c(CTAB)增加至15 mmol· L-1时, COM形貌发生明显改变, 其长径比由从1.16增加至2.3。 在c(SDS)=1 mmol· L-1时主要生成孪生型COM晶体, 随着c(SDS)增加, COM被抑制, 并促进圆钝形COD晶体形成; 当c(SDS)继续增加, COD的形貌也由圆钝形变为(100)面拉长的棒状COD晶体。 Zhong等[12]研究表明, 牛血清白蛋白(BSA)诱导形成薄的菱形COM和少量六角形COM晶体, 胶体硒纳米粒子(nanoSe0)诱导形成椭圆形或球形COM晶体, 而BSA修饰的胶体硒纳米粒子(nanoSe0-BSA)诱导形成三水草酸钙(COT)和COD晶体。
亚甲基蓝、 磺基琥珀酸钠二辛酯(AOT, 上海楷洋生物技术有限公司)等均为分析纯试剂。 实验用水均为二次蒸馏水。
X射线粉末衍射仪(XRD, D/MAX2400, 日本); 傅里叶变换红外光谱仪(FTIR, 美国Nicolet公司); XL30型环境扫描电子显微镜(SEM, 荷兰Philips公司)。 Zetasizer Nano-ZS型纳米粒度仪(英国Malvem公司); Varian Cary 500型紫外可见分光光度计(美国Varian公司); KQ3200 DE型超声仪(江苏昆山市超声仪器有限公司); TGL-16C离心沉淀机(上海安亭科学仪器厂)。
参照文献[13]制备尺寸分布在约5 μ m棒状、 圆钝形、 花状、 十字形和双锥形COD晶体, XRD和FTIR表明均为纯的目标产物。
阳离子染料亚甲基蓝与AOT作用, 生成蓝色离子对化合物可被三氯甲烷萃取, 其色度与浓度成正比; 采用分光光度计检测波长652 nm测量三氯甲烷相的吸光度可以定量测量AOT的浓度, 其标准曲线的线性方程为: y=0.070 13x-0.004 85, R2=0.999 92。 准确称取50 mg的COD晶体于25 mL烧杯中, 加入12 mL不同浓度(c0)的AOT溶液, 超声10 min后, 37 ℃恒温水浴, 吸附24 h后离心, 取上清液测定剩余AOT浓度(ceq), 计算出被COD晶体吸附的AOT量(Qads)为: Qads=V(c0-ceq)/m[14]。
参照文献[15], 取吸附了24 h后的COD和AOT混合悬浮液上机测量。
在COD和AOT吸附6, 24, 48和96 h后, 将悬浮液离心, 下层晶体转移到干燥洁净的滤纸上, 放入55 ℃烘箱中, 干燥后进行XRD和FTIR检测。 用XRD进行晶相分析时, 测试条件为: Cu靶Kα 射线, 石墨单色器, 40 kV, 30 mA, 扫描范围5° ~55° , 扫描速度0.02° · s-1。 采用K值法[16]定量计算草酸钙中COM和COD的相对质量百分比。
不同形貌COD晶体的SEM图像分别如图1(a— e)所示, 晶体的平均尺寸均约为5 μ m。 XRD谱[图2(a— f)]均检测到d=0.618, 0.442, 0.278和0.225 nm依次归属于COD (200), (211), (411)和(213)晶面的衍射峰(卡号: 17-541)[17]。
各形貌COD晶体与AOT发生吸附后, 均同时检测到归属于COD和COM的衍射峰, 表明部分COD晶体已转化为COM晶体[图2(b— f)]。 图2中d=0.598, 0.364和0.235 nm的衍射峰依次归属于COM的(
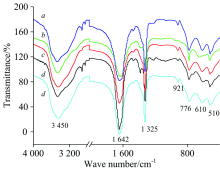
图3为五种不同形貌的COD晶体与AOT吸附24 h后的FTIR谱。 各样品均在3 450 cm-1附近为一个宽的单峰, 没有出现分裂; 草酸钙的羰基反对称[ν as(COO-)]和对称伸缩振动带[ν s(COO-)]吸收峰分别为1 642和1 325 cm-1; 在指纹区, 吸收带出现在921, 776, 610和510 cm-1附近; 这些吸收峰的出现表明吸附AOT后的主要组分仍然是COD[19], 因为COM的ν as(COO-)和ν s(COO-)分别为1 618和1 318 cm-1, 而COD的ν as(COO-)和ν s(COO-)分别为1 647和1 327 cm-1, 且COM晶体在3 450 cm-1附近会分裂为5个小的吸收峰。 由于发生吸附后, ν as(COO-)和ν s(COO-)均发生了蓝移, 表明生成了COM和COD的混合物。
根据XRD谱定量得到的COD晶体中转化为COM的百分含量如图4所示。 五种不同形貌的COD晶体随着放置时间的延长, 均会向COM转化, 在96 h后, 十字形COD晶体的转化率最大为65.5%, 其次是双锥形COD(64.9%), 花状COD晶体的转化率最低(44.7%)。 即五种不同形貌COD晶体的稳定性顺序是: COD(Flower)> COD(Rod)> COD(Blunt)> COD(Bipyramid)> COD(Cross)。
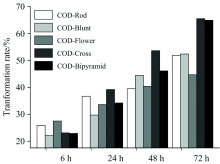 | 图4 不同形貌COD晶体与AOT吸附不同时间后转化为COM的质量百分比Fig.4 Mass percent of COD crystals with different morphologies converted into COM after adsorption with AOT for different time |
相比之下, 在没有AOT存在的纯水溶液中, COD在1 d后可转化50%, 2 d后则全部转化为COM晶体[20], 可见, AOT可以稳定COD的存在。 由于COM和COD的细胞毒性存在差异, COD表面电荷很少, 而COM表面带较高的正电荷[21], 因此, COM与带负电荷的肾上皮细胞间的粘附力比COD强得多, 即COM更容易在细胞表面粘附和聚集, 从而加剧了结石形成的风险。 AOT可以稳定COD的存在, 有利于减少肾结石的形成风险。
造成这种稳定性差异的根本原因是这五种不同形貌的COD晶体自身含的能量不同。 从各晶体的合成条件(表1)中可以看出, 十字形和双锥形的COD晶体的合成温度是37和33 ℃, 棒状和圆钝的COD晶体的合成温度为25 ℃, 花状COD晶体的合成温度为15 ℃。 根据阿伦尼乌斯公式Ea=RT2
| 表1 不同形貌COD晶体的合成条件 Table 1 Synthesis conditions of COD crystals with different morphologies |
不同形貌的COD晶体对AOT的吸附曲线都呈S型(图5)。 即随着c(AOT)增大, 各COD晶体对AOT的吸附量先缓慢增加, 然后再快速增大, 最后吸附达到饱和, 出现平台。 但出现平台的高度(即增大吸附量)不同, 从高至低顺序为: COD(Rod)> COD(Blunt)> COD(Flower)> COD(Cross)> COD(Bipyramid)。 造成吸附曲线差异的原因与晶体的比表面积(SBET)、 晶体结构以及晶体稳定性等因素密切相关:
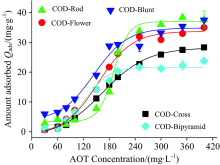 | 图5 与AOT作用后不同形貌COD晶体的吸附曲线Fig.5 Adsorption curves of COD crystals with different morphologies after reaction with AOT |
(1) SBET愈大, 提供的活性位点也越多, 越有利于吸附量的提高。 从表2可以看出, 各COD晶体比表面积为: SBET(Rod)(5.81)> SBET(Blunt)(5.33)> SBET(Flower)(3.04)> SBET(Cross)(2.79)> SBET(Bipyramid)(1.11 m2· g-1), 即COD晶体对AOT的吸附量大小与其SBET完全一致, 表明SBET是影响其吸附量的主要因素。
| 表2 不同形貌COD晶体基本性质和对AOT最大吸附量和吸附密度 Table 2 Basic properties of COD crystals with different morphologies and its maximum adsorption and adsorption density to AOT |
(2) AOT优先吸附在COD晶体的(100)面。 由于COD晶体(100)面的Ca2+密度(0.043 95 site· A-2)高于(101)面的(0.022 5 site· A-2)[10, 21], 因此, AOT会优先吸附在富Ca2+的(100)面上。 例如, (100)面最大的棒状COD(图6)对AOT的吸附量也最大; 同样, (100)面最小的双锥形COD对AOT吸附量也最小, 即吸附曲线出现的平台最低。
 | 图6 棒状、 圆钝形和双锥形COD晶体的 (100)晶面变化模型图Fig.6 Schematic representation of morphology and (100) crystal face variation of COD-Rod, COD-Blunt, and COD-Bipyramid crystals |
(3) COD晶体的内能越大, 吸附量越低。 不同形貌COD晶体的稳定性也会影响其对AOT的吸附。 AOT在COD晶体表面的吸附主要是由离子交换、 离子对及“ 憎水键” 形成等一系列化学吸附过程组成, AOT分子需要一定的活化能来克服晶体自身的“ 能垒” , 完成在COD晶体表面的吸附。 从图4不同形貌COD的转化率可以看出, 十字形和双锥形COD晶体的内能很大, 当AOT吸附在这两种形貌的COD晶体表面, 形成稳定的分子层时, 需要较高的活化能来完成吸附的过程[22]。 因此在同样的温度条件下进行AOT的吸附时, 十字形和双锥形这两种COD对AOT吸附量低于其他三种形貌的COD晶体。
容易吸附AOT的COD形貌有可能也更容易粘附在带负电荷的受损伤肾上皮细胞表面, 导致草酸钙结石形成的风险增加。
不同形貌COD晶体的Zeta电位随c(AOT)的变化趋势(图7)与其吸附曲线(图5)一致, 归因于晶体表面吸附AOT后, 晶体表面的负电荷增加, 引起Zeta电位变负, 因此, Zeta电位曲线呈现反S型[23]。
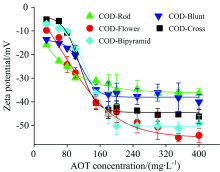 | 图7 吸附AOT后不同形貌COD晶体表面的Zeta电位Fig.7 Zeta potential on the surface of COD crystals with different morphologies after adsorption of AOT |
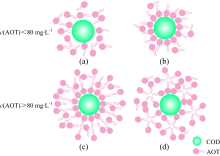
在c(AOT)< 80 mg· L-1时[如图8(a, b)], 各形貌COD的Zeta电位绝对值随c(AOT)增加而缓慢增加, 此时溶液中的AOT分子以带负电荷的“ 头部” 磺酸基利用库仑力吸附在晶体表面, 形成单分子层[图8(b)], 带负电荷的磺酸基团会直接与晶体表面的Ca2+作用, 即磺酸根离子有一部分需要用来抵消COD表面的正电荷, 因此, Zeta电位变负的趋势更加缓慢。 当c(AOT)> 80 mg· L-1时, 溶液中游离的AOT分子以“ 尾对尾” 的方式与晶体表面的AOT单分子层作用, 形成大量双分子层[图8(c)]和亚临界胶束, 甚至出现表面活性剂聚集体[图8(d)], 此时Zeta电位绝对值快速增大。 当c(AOT)> 250 mg· L-1时, AOT吸附量达到最大, Zeta电位也达到稳定状态。
晶体的Qmax与以下因素正相关: 比表面积增大、 孔容增大、 孔径增大, 晶体中有利于AOT分子吸附的富Ca2+的(100)面增大[24, 25]。 Γ 是指每平方纳米上吸附的AOT分子数目。 Γ 与Qmax成正比, 与比表面积(SBET)成反比。 如表2所示, 不同形貌的COD晶体对AOT的最大吸附量的顺序为: Qmax(Rod)(41.0)> Qmax(Blunt)(37.5)> Qmax(Flower)(35.0)> Qmax(Cross)(27.2)> Qmax(Bipyramid)(20.9 mg· g-1)。 而吸附密度顺序为: Γ (Bipyramid)(25.5)> Γ (Cross)(19.4)> Γ (Flower)(17.0)> Γ (Blunt)(9.53)> Γ (Rod)(8.71 N· nm-2)。
通过XRD、 FTIR和紫外-可见分光光度计分析了不同形貌的COD晶体对阴离子表面活性剂AOT的吸附差异。 AOT的吸附可以显著增加COD晶体的稳定性, 抑制COD向COM晶型的转化。 不同形貌的COD晶体对阴离子表面活性剂AOT的吸附存在差异, 决定吸附曲线和吸附量大小的因素包括晶体的比表面积、 晶体表面的钙离子密度和晶体的内能。 比表面积愈大, 提供的活性位点也越多, 越有利于吸附量的提高; 富Ca2+的(100)面有利于AOT优先吸附; COD晶体的内能越大, 吸附量越低。 容易吸附AOT的COD形貌(如棒状COD)有可能也更容易粘附在带负电荷的受损伤肾上皮细胞表面, 导致草酸钙结石形成的风险增加。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|