作者简介: 姜利英, 1981年生, 郑州轻工业大学教授 e-mail: jiangliying@zzuli.edu.cn
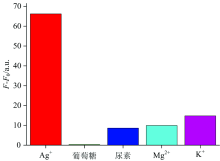
银凭借其独特的性能, 在医疗材料、 摄影、 电子、 成像等行业中应用广泛。 然而, 银离子被列为最具毒性的重金属离子之一, 会对环境以及人类的生命健康造成严重威胁。 为了灵敏、 特异性的检测水环境中的银离子浓度, 利用纳米金的优良光学猝灭性以及双链核酸适体捕获银离子能力更强的优点, 结合荧光能量共振转移原理, 提出一种用于检测水环境中银离子浓度的荧光适体传感器。 将修饰SH键的核酸适体与纳米金混合形成稳定的纳米结构, 并加入标记有FAM的核酸适体, 形成检测银离子浓度的工作溶液。 当不存在银离子时由于不匹配碱基C—C之间的排斥力导致两条核酸适体不结合, 反应体系中具有较强的荧光; 当存在银离子时, 双链核酸适体中不匹配的C—C能与银离子通过金属离子-碱基的相互作用形成稳定的C—Ag+—C碱基对, 这种复合结构的产生会拉近纳米金和荧光基团之间的距离, 使得荧光信号随着银离子浓度的增加而逐渐减弱。 根据加入银离子前后荧光强度的变化可实现银离子浓度的检测。 同时, 为了提高传感器的灵敏性和稳定性, 实验优化了工作溶液中纳米金与核酸适体的浓度比、 氯化钠浓度、 缓冲液的pH以及培养温度等参数。 结果表明, 当浓度为0.012 5 g·L-1的纳米金与5 μmol·L-1核酸适体的体积比为5∶1, NaCl浓度为260 mmol·L-1, 缓冲液pH 7, 培养温度为30 ℃时, 工作溶液初始荧光强度最强, 银离子检出限为10 nmol·L-1, 相关系数为 R2=0.99。 此外, 该传感器对银离子的浓度检测表现出较好的特异性, 且具有操作简单、 灵敏和不引入有毒溶剂等优点, 在水环境中的银离子浓度检测领域有较好的应用前景。
Silver is widely used in medical materials, photography, electronics, imaging and other industries because of its unique properties. However, silver ions are listed as one of the most toxic heavy metal ions, which poses a serious threat to the environment and human health. In order to detect the concentration of silver ions in an aqueous environment sensitively and accurately, a fluorescence aptasensor for detecting the concentration of silver ions in aqueous environment is proposed, which takes advantage of the excellent optical quenching property of nanogold and the stronger ability of double chain aptamers to capture silver ions based on the principle of fluorescence energy resonance transfer. Aptamer modified with SH bonds were mixed with nanogold to form stable nanostructures, and aptamer labeled with FAM were added to form a working solution to detect the concentration of silver ions. In the absence of silvers, two aptamers cannot hybridize with each other due to the repulsive force between the mismatched bases C—C, and the reaction system has strong fluorescence. In the presence of silver ions, the mismatched C—C in the double-stranded aptamers can form a stable C—Ag+—C base pair with the silver ions through the interaction between metal ion and base. The generation of this composite structure will shorten the distance between the gold nanoparticles and the fluorophore, so that the fluorescence signal will gradually weaken with the increase of silver ion concentration. According to the change of fluorescence intensity before and after adding silver ion, the concentration of silver ion can be detected. At the same time, in order to improve the sensitivity and stability of the sensor, the concentration ratio of gold and nucleic acid aptamers in the working solution, the concentration of sodium chloride, the pH of the buffer and the culture temperature were optimized. The results showed that when the volume ratio of 0.012 5 g·L-1 nano gold to 5 μmol·L-1 aptamer was 5∶1, the concentration of NaCl was 260 mmol·L-1, the pH of the buffer was 7, and the culture temperature was 30 ℃, the initial fluorescence intensity of the working solution was the strongest, the detection limit of silver ion was 10 nmol·L-1, and the correlation coefficient was R2=0.99. Based on the characteristics of high recognition ability and strong affinity of aptamers to silver ions, the sensor showed good selectivity to silver ions and was not disturbed by other substances. In addition, the sensor has good specificity for silver ion concentration detection, and has the advantages of simple operation, sensitivity and no introduction of toxic solvents, so it has a good application prospect for silver ion concentration detection in the water environment.
银在电子、 摄影、 成像等行业中应用广泛, 但银离子所带来的污染也是一个不容忽视的问题[1]。 当银离子随工业废水排入土壤和水源后, 就会被动植物吸收, 接着又随食物链进入人体与人体内的蛋白质、 酶发生相互作用, 严重威胁人类的健康[2]。 因此, 检测水环境中银离子浓度对保护人类生命健康至关重要。
目前检测银离子浓度的方法主要依赖于电感耦合等离子体质谱法[3]、 原子吸收光谱法[4]和电感耦合等离子体/原子发射光谱法[5]。 尽管这些方法检测精度比较高, 但仪器耗资昂贵、 运行费用高、 操作要求多, 检测比较费时、 费力, 而且测量时需萃取、 浓缩富集或抑制干扰等复杂前处理过程[6]。 而生物传感器, 凭借其具有选择性高、 分析速度快和仪器价格低廉等特点, 引起研究者的极大关注, 目前研究工作大都致力于研制荧光[7]、 比色[8]或电化学传感器[9]。 其中, 荧光分析技术具有灵敏度高、 精度高、 检测速度快等优点在各种分子检测中应用广泛。
Long[10]等利用NaYF4∶ Yb3+, Tm3+上转换纳米颗粒(UCNPS)设计了一种定量检测银离子的荧光传感器, 检出限为33 nmol· L-1。 Lu[11]等基于Ag+与谷胱甘酸(GSH)的相互作用, 研究了检测银离子的金属配位聚合物荧光传感器, 检出限为50 nmol· L-1。 以上研究者捕获金属离子使用的是各种配位体和络合物, 一般结构比较复杂, 例如4-氨基-3, 5-二(2-羟基苯基)-1, 2, 4-三唑NH2C2N3(C6H4OH)2等[12], 重金属离子的解离常数比较高(μ mol· L-1级)且存在有毒物质。 为此一些研究者利用金属与碱基的相互作用来检测银离子[13]。 Zhu[14]等利用银离子能使核酸适体从随机线圈结构变成G-四重结构来检测银离子。 Mao[15]等使用单层的MoS2作为荧光猝灭剂, 并结合银离子与核酸适体中不匹配碱基C的相互作用来检测银离子。 以上两种方法利用核酸适体提高了银离子的检出限, 但其制备过程复杂, 且引入了部分有毒物质, 不利于水环境中的银离子检测应用。 本研究基于金属-碱基对相互作用捕获能力强和荧光检测技术灵敏度高的优点, 将纳米金作为猝灭基团与DNA1相连, FAM作为荧光基团标记在DNA2一端, 两者混合即可制备工作溶液。 检测工作溶液中银离子加入前后的荧光信号变化可实现银离子的浓度检测, 该方法具有操作简单、 灵敏和不引入有毒溶剂等优点, 适用于水环境中的银离子检测。
F-7000型荧光分光光度计(日本HITACHI公司); 电子天平和pH计(梅特勒-托利多仪器有限公司); GL-16Ⅱ 型离心机(上海安亭科学仪器厂); 07HWS-2型数显恒温磁力搅拌器(杭州仪表电机有限公司); 恒温振荡培养箱(北京东联哈尔仪器制造有限公司)。
银离子的核酸适体序列分别为: DNA1: 5’ -SH-CTACCCTAGC-3’ ; DNA2: 5’ -GCTACCCTAG-FAM-3’ (上海生工生物工程有限公司); 40 nm纳米金0.05 g· L-1(中科雷鸣); 2 mol· L-1 NaCl; 100 mmol· L-1 TCEP(包含20 mmol· L-1Tris-CH3COOH); 10 mmol· L-1 Tris-CH3COOH缓冲液; AgNO3溶液(1 mmol· L-1): 精准称取AgNO3固体, 溶于超纯水中; 实验用水为18.2 MΩ · cm的去离子水。
工作溶液指的是Au@aptamer偶联体和HDNA-FAM的混合溶液。 主要制备流程如下: 首先将DNA1和DNA2在100 mmol· L-1的TCEP溶液(包含20 mmol· L-1 Tris-CH3COOH)中激活2 h, 然后将0.012 5 g· L-1的纳米金和5 μ mol· L-1的DNA1混合并振荡培养12 h。 接着向溶液中加入2 mol· L-1 NaCl, 每隔3 h加一次, 最终使NaCl的浓度达到0.26 mol· L-1。 振荡培养24 h后, 以14 000 r· min-1离心20 min, 去除上清液并将沉淀分散于600 μ L, 10 mmol· L-1的Tris-CH3COOH缓冲液中并加入5 μ mol· L-1, 20 μ L的DNA2, 4 ℃下保存备用。
将上述制备好的620 μ L的工作溶液中加入100 μ L不同浓度的银离子并室温孵化40 min, 然后取出600 μ L放入荧光光谱仪进行检测, 绘制不同银离子浓度下的荧光光谱图。
图1为检测银离子浓度的原理示意图。 纳米金和修饰有巯基的核酸适体通过Au-S连接在一起, 当不存在银离子时, 尽管两条DNA链有7个碱基互补配对, 但3个碱基对之间的氢键力被强静电斥力抵消, 所以两条DNA序列不能杂交; 当存在银离子时, 两条DNA链会通过C— Ag+— C进行特异性结合, 拉近了FAM与纳米金之间的距离引起荧光猝灭, 猝灭的程度与银离子的浓度有关。
为验证传感器的可行性, 分别检测加入银离子前后荧光适体传感器的荧光强度如图2所示。 a为未加入银离子时的荧光光谱图, b和c为加入银离子后的荧光光谱图, 可见加入银离子后出现了荧光猝灭的现象, 并且随着银离子浓度增大猝灭现象越明显, 验证了该传感器的可行性。
纳米金和核酸适体的比例会影响纳米金表面核酸适体的密度, 当纳米金过少时, 纳米金表面修饰过多的核酸适体, 在加入银离子时部分互补链不能挤进去与核酸适体结合; 当纳米金过多时, 每个纳米金表面修饰的核酸适体过少, 核酸适体会包裹在纳米金表面, 影响其与互补链的结合。 因此Au和aptamer的比例会影响传感器的灵敏度[16]。 除此之外, 纳米金和核酸适体的静电排斥力也会阻止核酸适体修饰在纳米金的表面, 因此需要添加合适浓度的NaCl来减少核酸适体与纳米金之间的静电排斥力并且不使纳米金发生聚集[17]。 除了纳米材料的浓度会影响传感器的灵敏度以外, 外界环境[18](pH、 温度)也会影响到传感器的稳定性以及灵敏度。 因此对Au和aptamer的比例, NaCl的浓度优化, 培养温度和pH进行了优化。
(1)Au和aptamer的比例优化
为了优化Au和aptamer的体积比, 实验采用浓度为0.012 5 g· L-1的纳米金, 把核酸适体的体积固定在20 μ L, 改变纳米金的体积, 探究了Au和aptamer的体积比在1∶ 1~8∶ 1范围内, 对工作溶液的影响, 图3为Au和aptamer在不同体积比下的荧光强度值, 当体积比在1∶ 1~5∶ 1时, 荧光强度随着纳米金浓度的增加而逐渐增大; 当体积比超过5∶ 1时, 纳米金的体积过量, 核酸适体包裹在纳米金的表面, 部分FAM的荧光直接被纳米金猝灭, 荧光强度逐渐下降。 为了保证纳米金表面修饰适量的核酸适体, 选择Au和aptamer的体积比为5∶ 1进行后续实验。
(2)NaCl的浓度优化
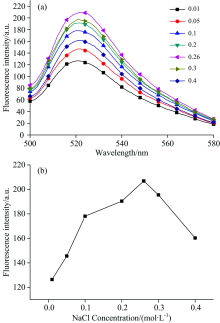
分别向工作溶液中加入不同体积的NaCl(2 mol· L-1), 探究了NaCl的浓度在0.1~0.4 mol· L-1范围内对工作溶液的影响。 由图4所示, 随着NaCl浓度的增加, 纳米金和核酸适体的静电排斥力逐渐减小, 使得纳米金表面修饰的核酸适体增多, 荧光强度有所增加, 而NaCl的浓度超过260 mmol· L-1时, 过多的NaCl使纳米金发生聚集, 荧光强度又逐渐下降。 因此选择NaCl浓度为260 mmol· L-1进行后续实验。
(3)工作溶液培养温度的优化
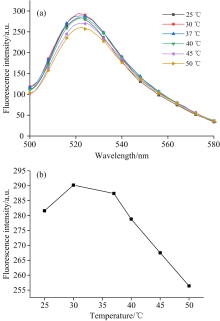
为了确定荧光适体传感器制备的最佳温度, 分别测量了工作溶液在25~50 ℃范围内的荧光强度, 结果如图5所示。 在25~30 ℃范围内, 随着温度的升高, 荧光强度逐渐升高, 主要是因为工作溶液的稳定性逐渐增强, 而温度大于30 ℃以后, 随着温度的升高荧光强度反而降低, 分析认为高温破坏工作溶液的稳定性。 因此, 后续实验选择30 ℃进行测量。
(4)pH的优化
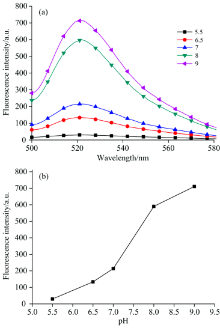
FAM对pH非常敏感[19], 为了优化工作溶液的pH, 实验采用Tris-CH3COOH来调节溶液的pH值, 在pH为5.5~9范围内考察pH对工作溶液的影响。 由图6所示, pH值在5.5~7范围内, 随着pH值的增大荧光强度逐渐增大, 主要因为低pH会抑制FAM的活性; 当pH值在7~9范围时, 随着pH的升高荧光强度逐渐升高, 但是在碱性环境下Ag+会与氢氧根发生反应, 不利于检测银离子的浓度, 因此选择pH 7的缓冲液进行后续实验。
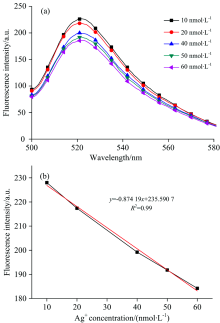
在优化的实验条件下, 分别对10, 20, 40, 50和60 nmol· L-1的Ag+进行检测, 得到不同浓度银离子的荧光强度值。 如图7(a)所示, 随着银离子浓度增加, C— Ag+— C复合结构增加, 更多的FAM被拉到AuNPs的近端, 因此随着银离子浓度的增大, 荧光强度值不断减小。 如图7(b)所示银离子浓度与荧光强度的线性回归方程为y=-0.874 19x+235.590 7(y为荧光强度, x为银离子浓度), R2=0.99, 检测范围为10~60 nmol· L-1, 检出限为10 nmol· L-1。
构建了一种用于检测水环境中银离子浓度的荧光适体传感器, 利用银离子能与碱基C形成C— Ag+— C的特殊碱基对结构实现银离子的特异性捕获; 结合纳米金与FAM之间由于距离变化引起的荧光共振能量转移现象实现荧光信号的检测。 其中, 为了提高传感器的灵敏性和稳定性, 实验优化了传感器的各项制备参数, 并对银离子的浓度进行了检测, 检出限为10 nmol· L-1, 具有一定的抗干扰能力。 但受限于核酸适体中碱基C的数量过少, 传感器目前检测范围较窄, 下一步会通过调整核酸适体中碱基的数量与种类进一步优化传感器的各项检测性能, 为水环境中银离子的浓度检测提供研究基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|