作者简介:谢文菁, 女, 1994年生, 江苏师范大学硕士研究生 e-mail 2317692246@qq.com
细胞微环境的稳定是保持细胞正常增殖、 代谢和功能活动的重要条件, 微环境成分的异常变化可使细胞发生病变。 采用荧光光谱技术研究离体白细胞在多糖微环境中荧光发射特性的变化规律和发光机制, 并进一步的分析了多糖对白细胞的生物活性的影响。 实验结果表明: 当白细胞受波长为407 nm的激光照射时, 发射位于450 nm的荧光。 在加入脂多糖或葡聚糖时, 白细胞的荧光发射峰的位置不会变化, 峰值受到影响。 脂多糖的加入会减弱白细胞荧光峰强度, 且荧光强度随脂多糖浓度(0~500 μg·mL-1范围内)的增加而持续减弱。 而葡聚糖可以一定程度增加白细胞的荧光强度, 浓度越高, 荧光强度越大。 分析认为白细胞发射的450 nm荧光来自发射物质烟酰胺腺嘌呤二核苷酸(NADH)。 白细胞内NADH随着离体时间的增长, 被氧化成不发荧光的烟酰胺腺嘌呤磷酸二核苷酸(NAD+), 导致细胞荧光峰值下降, 从而引起细胞凋亡。 加入脂多糖产生的羟自由基(·OH)会与NADH发生氧化反应, 因此脂多糖加速了NADH的消耗, 导致白细胞荧光减弱, 加快细胞凋亡。 而葡聚糖主要是由葡萄糖单体组成, 葡聚糖的加入会将NAD+还原成NADH, 因此延缓了白细胞的凋亡。 分析认为脂多糖可以加速白细胞的凋亡, 提高细胞发生炎症甚至是肿瘤的机率, 而葡聚糖对白细胞有保护作用。 该研究为研究肿瘤的发生和发展过程以及治疗提供有价值的参考。
The stability of the cell microenvironment is an essential condition to maintain healthy cell proliferation, metabolism, and functional activities, and the abnormality of microenvironment components can cause pathological cell changes. In this paper, the fluorescence emission characteristics and mechanism of white blood cell (WBC) in vitro in polysaccharide microenvironment were considered by fluorescence spectroscopy, and the effect of Polysaccharide on the WBC biological activity was further analyzed. The results showed that under 407 nm laser irradiation, white blood cells emit fluorescence at 450 nm. When lipopolysaccharide or dextran is added, the position of fluorescence emission peak of leukocyte will not change, but the fluorescence peak will be affected. The addition of lipopolysaccharide (LPS) can weaken the fluorescence peak intensity of leukocytes, and the higher the LPS concentration (in the range of 0~500 μg·mL-1), the lower the fluorescence intensity. While the addition of dextran can enhance the WBC fluorescence intensity to a certain extent, and the higher the concentration, the stronger the fluorescence. It believes that the 450 nm fluorescence emitted by WBC comes from the nicotinamide adenine dinucleotide (NADH). NADH is oxidized to NAD+ with the increase of cell in vitro, which leads to the decrease of fluorescence intensity and apoptosis. The hydroxyl radical (·OH) generated by adding lipopolysaccharide will react with NADH. Therefore, lipopolysaccharide accelerates the consumption of NADH, resulting in weakened leukocyte fluorescence and accelerated cell apoptosis. Dextran is mainly composed of glucose monomer, which can reduce NAD+ to NADH, thus delaying the WBC apoptosis. It believes that lipopolysaccharide can accelerate the WBC apoptosis, improve the probability of inflammation and even tumor, while dextran can protect WBC. This study is used as a valuable reference for the study of tumor occurrence, development, and treatment.
炎症是活体组织对损伤因子的一种自动防御反应, 通常情况下是有益的。 炎症增生能够限制炎症的扩散和弥漫, 使受损组织得以再生修复[1]。 但过度的炎症增生对机体不利, 会使原有的实质细胞遭受损害而影响器官功能。 炎症与肿瘤的发生、 发展具有相关性, 炎症调节因子和效应细胞是肿瘤组织局部微环境的重要组成, 它们在炎症与肿瘤相互关系中起着重要作用[2]。 随着人类对肿瘤起源认识不断提高, 开始靶向于肿瘤微环境中的炎症成分进行协同治疗, 肿瘤进展过程中如何抑制机体的肿瘤免疫功能, 肿瘤相关的炎症如何在多个方面影响恶性肿瘤等引起了广泛关注和重视[3]。
白细胞(white blood cell, WBC)作为炎症细胞是机体防御系统的一个重要组成部分。 它们吞噬侵入的细菌、 病毒、 寄生虫等病原体和一些坏死的组织碎片[4]。 一般认为, 白细胞能向异物处聚集, 并将其吞噬。 由于白细胞的趋化特性, 细菌体或死亡的细胞产生的化学刺激, 诱发着白细胞向该处移动。 临床证明组织发炎时产生一种活性多肽是白细胞游动的诱发物质之一。 白细胞的防御功能受所处微环境的影响及其变化机制尚待研究。
多数活性多糖可以刺激免疫活性, 促进抗体形成, 在一定程度上具有抗肿瘤活性的功能[5]。 尤其对一些易发生广泛转移, 不宜采取手术治疗和放射疗法的白血病、 淋巴瘤等更有治疗价值。 常见多糖有脂多糖和葡聚糖等。 脂多糖(lipopolysaccharide, LPS)由脂质和多糖构成, 又称糖脂质, 位于细胞壁的最外层、 覆盖于细胞壁的黏肽上, 脂多糖对宿主具有毒性[6, 7, 8]。 一般LPS很难从细胞壁脱落, 当细菌死亡或被破坏时会通过溶解、 破坏细胞来脱落, 并通过作用于动物细胞等发挥其毒性。 葡聚糖(dextran, PUT)是葡萄糖单糖间以糖苷键相连而组成的同型多糖, 分为α -葡聚糖和β -葡聚糖, 具有提高免疫力的作用[9]。 如β -葡聚糖能使受伤机体的淋巴细胞产生细胞因子的能力迅速恢复正常, 有效调节机体免疫机能。 这种葡聚糖活化的细胞会激发宿主非专一性防御机制, 故在肿瘤、 感染病和治疗创伤方面的应用深受瞩目。 它能够活化巨噬细胞与嗜中性白血球等, 因此能提高白细胞素、 细胞分裂素和特殊抗体含量, 全面刺激机体免疫系统[10]。 白细胞在脂多糖和葡聚糖微环境中的生物功能变化情况和产生机制引起了研究者的关注。
细胞微环境的稳定是保持细胞正常增殖、 分化、 代谢和功能活动的重要条件, 微环境成分的异常变化可使细胞发生病变。 本文采用荧光光谱技术研究了离体白细胞以及在多糖微环境中荧光发射特性变化规律和发光机制, 得到不同多糖微环境对白细胞影响, 研究结果为肿瘤的发生发展及其治疗提供有价值的指导。
实验仪器: FLS-920稳态/瞬态荧光光谱仪, 激发光407 nm, 发射光扫描波段为200~800 nm。 10~100和100~1 000 μ L移液枪、 离心机。
实验样品: 实验所需的健康人体血液由徐州医学院附属第三医院提供, 脂多糖, 葡聚糖购于上海源叶生物科技有限公司。
样品制备: 白细胞分离步骤。 取新鲜血液加入等体积的磷酸缓冲盐溶液(PBS)稀释, 在离心管中加入适量的人外周血淋巴细胞分离液(当稀释后的血液体积小于3 mL时, 加入3 mL分离液; 当稀释后的血液体积大于3 mL时, 加入等体积的分离液), 将稀释后的血液平铺到分离液液体的上面, 保持两界面清晰。 在室温的条件下, 以500~1 000 g的速度离心20~30 min, 血液体积越大, 离心时间越长。 离心后, 白细胞会分布在从上面数第二层, 使用移液枪提取出该层备用。 提取到的细胞放入15 mL洁净的离心管中, 加入10 mL的PBS。 以250 g的速度离心10 min。 弃上清。 再加入5 mL的PBS, 250 g的速度离心10 min, 重复两次后, 提取下层细胞悬液。
所有实验均在实验室室温20 ℃下进行, 离体后的白细胞在4 ℃的环境下保存。 同组对比实验中使用的白细胞来自同一个健康成人。
为了探究白细胞生物功能随微环境的变化规律及影响, 实验中先对普通白细胞的荧光发射特性进行了研究, 结果如图1中黑色曲线所示。 从图1可以看出, 当采用407 nm的激光照射白细胞溶液时, 获得420~570 nm范围内的荧光光谱的主荧光发射峰位于450, 490和550 nm处有两个次荧光发射峰。 分析认为450 nm的荧光是由白细胞中的烟酰胺腺嘌呤二核苷酸(NADH, N指烟酰胺, A指腺嘌呤, D指二核苷酸)发射。
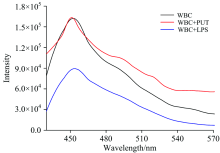 | 图1 不同多糖微环境下白细胞的荧光光谱特性Fig.1 Fluorescence spectrum of WBC under different polysaccharide microenvironments |
为了详细研究脂多糖微环境对白细胞生物功能的影响, 实验中采用同样的方法研究了浓度同为500 μ g· mL-1的脂多糖和葡聚糖两种白细胞荧光发射特性。 测量两种白细胞的荧光光谱与正常白细胞的荧光光谱对比结果如图1所示。 黑色曲线代表的是正常环境中白细胞的光谱图, 红色曲线代表的是在500 μ g· mL-1的葡聚糖环境下的白细胞光谱图, 蓝色曲线代表的是500 μ g· mL-1的脂多糖环境下的白细胞光谱图。 在407 nm的激光照射下, 加入了脂多糖和葡聚糖的两组白细胞的荧光光谱主发射峰依然位于450 nm。 只是脂多糖的加入引起了白细胞荧光发射谱强度的整体减弱, 葡聚糖则对450 nm处的荧光发射峰影响不大, 对490和550 nm处的荧光表现出增强作用。
为了进一步研究多糖浓度对白细胞荧光发射特性的影响, 分别配置了两组含不同浓度(0, 100, 250, 500, 750和1 000 μ g· mL-1)的脂多糖和葡聚糖的白细胞溶液进行实验, 获得荧光发射主峰的峰值随脂多糖和葡聚糖浓度的变化如图2所示。 从图2中可以看出白细胞的荧光发射峰强度随脂多糖浓度的增大迅速减小, 当浓度增至500 μ g· mL-1之后, 荧光强度降至最低并趋于稳定。 而白细胞的荧光强度随葡聚糖浓度的增加虽然呈增强趋势, 但强度增强量不明显。
为了详细研究脂多糖和葡聚糖对白细胞生物功能的衰变特性的影响, 将含有500 μ g· mL-1脂多糖和500 μ g· mL-1葡聚糖的两种白细胞样品与正常白细胞同时置于4 ℃环境下自然衰变, 分别测量三种白细胞在几个相同时间点的荧光发射特征, 并统计在450 nm处主荧光峰强度随时间的变化曲线如图3所示。
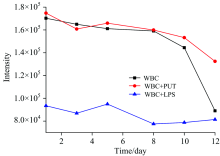 | 图3 不同多糖微环境下白细胞的荧光强度随时间衰变Fig.3 Fluorescence intensity of WBC decay with time under different polysaccharide microenvironments |
实验结果表明, 主荧光峰的发射强度随着离体时间延长而减小, 表明随着白细胞的凋零, 其荧光强度逐渐减弱。 从图中加入了脂多糖的白细胞实验结果(蓝色线)可以看出, 脂多糖环境下的白细胞的荧光发射强度在前8天内持续减弱, 第8天之后达到稳定值。 加入葡聚糖的白细胞荧光发射一定程度上维持着与普通白细胞的荧光发射, 在细胞自然凋亡的前10天, 葡聚糖环境下的白细胞荧光强度持续表现出与正常细胞相当的荧光水平。 第10~12天的葡聚糖环境下的白细胞荧光强度略强于正常白细胞, 表明其荧光衰减速度比普通白细胞慢, 葡聚糖延缓了白细胞荧光发射的衰减。
细胞间的氧化还原平衡是调节能量生产和中间代谢以及细胞生存, 生长和增殖的关键[11]。 细胞氧化还原平衡的两个主要决定因素是烟酰胺腺嘌呤二核苷酸(NADH)和烟酰胺腺嘌呤磷酸二核苷酸(NAD+)氧化还原[12, 13], 如图4所示。
NADH在核酸, 蛋白质和多糖合成以及物质转运过程中具有重要作用, NADH是烟酰胺腺嘌呤二核苷酸的还原态, 还原型辅酶Ⅰ , NADH容易被还原为NAD+。 NAD+是烟酰胺腺嘌呤二核苷酸的氧化态, 容易被氧化。 NADH的氧化还原反应实际指NADH的还原反应和NAD+的氧化反应。 NADH氧化过程如式(1)
白细胞中发荧光的物质是NADH, 其结构是刚性共轭平面(如图5所示)[14]。 但NADH发生氧化反应后, NAD+结构中的磷原子P→ O键的的共轭结构被破坏, 导致分子不发射荧光。
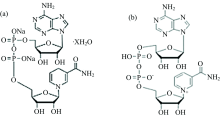 | 图5 物质分子结构式 (a): NADH结构式; (b): NAD+结构式Fig.5 Structural molecular formula (a): NADH structural formula; (b): NAD+ structural formula |
细胞中NADH水平(NAD+/NADH的比率)参与细胞代谢通路的多个反应, 数值并不是绝对不变, 直接影响细胞的衰老、 死亡直至癌变。 正常离体白细胞随着离体时间延长, 白细胞中NADH被慢慢氧化成NAD+, 导致细胞中NAD+的含量增加, NADH含量减小, 因而白细胞450 nm处的峰值白细胞随离体时间延长而逐渐减弱。 白细胞在死亡过程中荧光发射强度逐渐减弱, 直至几乎不发射荧光。
当白细胞中加入葡聚糖时, 葡聚糖单体间发生了聚糖反应, 其聚糖反应过程如式(2)
因为葡聚糖的单体葡萄糖可以将白细胞内的NAD+还原成NADH, 随着白细胞离体时间延长, 白细胞在逐渐死亡过程中, NADH的氧化产物NAD+被葡聚糖再次还原成NADH。 这就延缓了NADH的消耗速度, 因此葡聚糖起到了保护白细胞荧光发射作用, 即含葡聚糖的微环境一定程度上延缓了白细胞的凋亡。
当加入脂多糖时, 由于加入脂多糖可以在生物体内产生的羟自由基(· OH), · OH的化学性质非常活泼, 寿命极短, 与任何生物分子都以极快的反应速率反应, 虽然现有很难直接检查出生物体内的· OH, 但是已有很多事实间接证明生物体内确有· OH产生。 · OH可以在某些生理或病理生理作用中产生, 如: 嗜中性白细胞吞噬细菌时; 在发炎过程中: X射线或Y射线照射生物体时等。 而有些化学因素如毒物脂多糖等进入生物体后也可能直接或间接产生· OH。 因此· OH的加入加速了NADH被氧化的过程, 生产了大量不发荧光的NAD+, 白细胞中NADH含量减少。 一方面, 使得脂多糖的微环境下白细胞的荧光发射急剧减弱, 一定程度上加速了白细胞的凋亡。 另一方面导致细胞的氧化还原反应不平衡, 因而容易导致炎症性疾病或癌症的发生。 而加入葡聚糖的白细胞中发生着作用相反的化学反应-聚糖反应使得NAD+被还原成NADH, 补充了细胞衰减过程中NADH的消耗, 减缓NADH的衰减速度和NAD+的增加速度, 一定程度上维持了细胞氧化还原反应的平衡。 所以脂多糖的加入增大了细胞发生炎症甚至是肿瘤的机率, 葡聚糖的加入减小了细胞发生炎症的机率, 起到保护白细胞的作用。
采用荧光光谱分析技术研究了白细胞在多糖微环境下的荧光发射特性, 并对其发光机制进行了研究, 总结如下:
(1)采用407 nm的激光照射离体白细胞, 主发射峰位于450 nm, 对应发光物质为细胞中的烟酰胺腺嘌呤二核苷酸(NADH), 随着白细胞离体时间延长, NADH逐渐氧化成不发荧光的NAD+, 荧光发射逐渐减弱;
(2)白细胞在脂多糖的微环境下主发射峰位于450 nm, 脂多糖加入后产生的· OH加速了NADH被氧化的过程, 生产了大量不发荧光的NAD+, 提高了NADH的正常衰减速度, 所以脂多糖的微环境下白细胞的荧光发射急剧减弱;
(3)白细胞在葡聚糖的微环境下也会发射位于450 nm的荧光峰, 葡聚糖中的葡萄单糖与白细胞的NAD+反应生成NADH, 白细胞中的NADH数量增加, 补偿了细胞衰减过程中NADH的消耗, 因此葡聚糖的加入保持了白细胞的荧光发射, 对白细胞起到保护作用。
多糖环境使得白细胞中NAD+/NADH的比率发生变化, 细胞的氧化还原反应不平衡。 脂多糖微环境加大了细胞发生炎症甚至是肿瘤的机率, 容易导致炎症性疾病或癌症的发生, 而葡聚糖对白细胞有保护作用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|




