作者简介: 罗淋淋, 1988年生, 深圳大学生命与海洋科学学院光生物学博士研究生 e-mail: linsluo@163.com
细胞是动植物结构和生命活动的基本单位。 细胞过程的一个重要特点就是其生化组分在时空调控上的相互作用关系。 然而, 利用传统的生化方法(如酵母双杂交系统、 pull-down系统等)很难在空间上评估活细胞内分子间的相互作用。 光学技术的快速发展, 为研究活细胞中生物分子的时空动态提供了新的遗传研究工具, 其中荧光共振能量转移-荧光寿命显微成像(FRET-FLIM)技术在实时探测分析活细胞中生物大分子构象变化和分子间动态相互作用过程具有独特的优势, 如: 实现对活细胞的实时“可视化”研究, 同时具有高时空分辨率; 检测更加灵敏、 结果可信度高; 且基于简易的数学运算完成简单快捷的分析程序。 介绍FRET-FLIM技术的理论背景知识, 对比了该技术与传统蛋白相互作用技术研究的利弊, 同时归纳了其在蛋白相互作用、 细胞生物学和疾病诊断等方面的最新应用研究进展, 最后总结和讨论了FRET-FLIM技术的未来发展趋势, 以期能够为揭示活细胞的结构和细胞过程相关研究提供新的见解。
Cell is the basic unit of structure and biological activities of animals and plants. An important feature of cellular processes is that the biochemical components involved in it have spatiotemporally interacted with each other. However, it is difficult to evaluate molecular interactions in living cells using traditional biochemical methods (e. g., yeast two-hybrid system, pull-down system, etc. ). The rapid development of optical technology provides new genetic research tools for studying the spatiotemporal dynamics of biomolecules in living cells. FRET-FLIM (Förster resonance energy transfer-fluorescence lifetime imaging microscopy) technology has unique advantages in real-time detection and analysis of conformational changes and dynamic interactions of macromolecules in living cells, such as achieving real-time “visualization” study of living cells with the high spatial and temporal resolution, obtaining more reliable results with high sensitivity, and accomplishing simple and fast analysis program based on brief mathematical operations etc. This paper outlined the theoretical backgrounds of FRET-FLIM, and then summarized the advantages and disadvantages of FRET-FLIM technique compared with traditional methods for protein interaction studies. In addition, we emphasized the recent studies and applications of FRET-FLIM in protein interaction, cell biology, and disease diagnosis. Finally, this paper prospected the future research trend of FRET-FLIM in the field of life sciences and provided a comprehensive and systematic reference for related research in the structure and processes of living cells.
随着人类对生命现象本质的探究, 科学家对生命科学问题的研究日益深入, 这推动了非生物学科(如数学、 化学、 物理学、 信息科学等)与生命科学相互交叉和相互融合的热潮。 20世纪90年代, 商用共聚焦显微镜的问世为研究活细胞中不同蛋白的共表达提供了便利的工具[1]。 与传统宽场成像方法相比, 共聚焦显微镜的光学分辨率和视觉对比度都大幅提高, 能够呈现高质量的彩色图像, 但是其空间分辨率仍无法突破衍射极限(大约200 nm), 因而无法用于研究生物分子间的相互作用。 2006年以后, 许多超分辨率成像技术应运而生, 如受激发射损耗显微术(stimulated emission depletion, STED)、 结构光照明显微术(structure illumination microscopy, SIM)、 光激活定位显微术 (photoactivatable localization microscopy, PALM)和随机光学重构显微术(stochastic optical reconstruction microscopy, STORM)等, 它们的分辨率都能突破衍射极限, 最高空间分辨率可达到10 nm, 使光学显微镜步入纳米时代[2, 3, 4]。 超分辨成像技术由于其高成像分辨率的优势对科学家在活细胞分子水平上的研究起到了显著的促进作用, 如活细胞内生物大分子结构的观察, 遗传信息的编码及表达的研究, 都对生命过程和疾病发生机理的理解具有重要的意义[5, 6, 7]。 然而, 这些成像技术仅能较好地获取其结构特征, 对体内蛋白质-蛋白质的相互作用所体现的生物功能信息分析特异性不强。
荧光寿命显微成像(fluorescence lifetime imaging microscopy, FLIM)技术是研究细胞内生命活动状态的一种非常可靠的方法。 荧光寿命是荧光团在返回基态之前处于激发态的平均时间, 是荧光团的固有性质, 与样品浓度、 样品吸收、 光漂白和激光激发强度等因素无关[8, 9], 相反地, 荧光寿命对荧光团所处的微环境非常敏感, 如细胞中温度、 pH值分布、 离子浓度、 氧浓度、 分子结合或溶液疏水性等, 因而它能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移[10]。 FLIM技术就是对荧光探针分子的荧光寿命进行成像, 能实现对细胞内诸多生化参数的定量测量, 尤其是结合了荧光共振能量转移(fö rster resonance energy transfer, FRET)的FRET-FLIM技术。 FRET本身不是一种成像技术, 而是一个物理过程, 指两个携带不同荧光基团的大分子之间或同一分子的不同荧光团之间通过电偶极相互作用所发生的非辐射能量转移[11, 12]。 传统的FRET过程分析通常是基于荧光强度成像来实现, 分析的结果容易受光谱串扰的影响, 因而灵敏度不高, 将FLIM技术应用于FRET过程分析, 利用FLIM技术可定量测量这一优势, 可非常灵敏地反映供体荧光分子与受体荧光分子之间的能量转移过程[9]。 因此, FRET-FLIM联合能够实时监测生物细胞中蛋白质的动态变化, 如蛋白质折叠、 底物相互作用和细胞间信号分子传递等。
基于FRET-FLIM技术生物测定的原理, 比较了其与几种常见的研究蛋白相互作用测定方法的利弊, 综述了其在生物医学和生命科学领域的广泛应用, 并对FRET-FLIM技术的未来发展趋势做了讨论与展望。
荧光物质作为一个整体, 其激发光撤除后荧光强度I随时间呈指数衰减, 荧光强度下降到撤除前荧光强度I0的1/e所需要的时间称为荧光寿命, 常用τ 表示, 如式(1)所示
$I(t)=I_{0} \exp (-t / \tau)$(1)
假如荧光分子处于不同状态时有不同的寿命, 且处于不同状态的荧光分子同时存在, 则荧光衰减将呈现为多个单指数衰减的叠加, 称为多组分情形, 每个寿命组分的寿命用τ i表示[13, 14]。 通常情况下, 荧光衰减信号多是这种多组分情形, 有多个不同的寿命值, 称为不同的寿命组分, 每个组分的占比用ai表示。
荧光寿命是荧光分子固有的一个特征参数, 反映的是荧光分子退激发之前处于激发态的平均时间, 和绝对发光强度无关。 而荧光分子的退激过程很容易受周围微环境的影响, 因此荧光寿命的变化可以灵敏地反映周围微环境的变化。
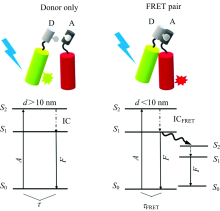
1940年, Fö rster定义了FRET的定量理论, 称这个过程为福斯特共振能量转移或FRET。 FRET是一个双分子过程, 在这个过程中, 一个荧光团(供体)的激发态能量以非辐射方式通过非常弱的偶极-偶极耦合转移到一个邻近的基态分子(受体), 从而导致供体荧光猝灭和受体荧光的激发[14](图1所示)。 为了实现FRET, 荧光供体和受体分子必须满足以下几个前提条件: (1)供体发射光谱和受体吸收光谱需要重叠; (2)供体和受体之间距离小于10 nm; (3)有限的偶极取向因子[15, 16]。 FRET的能量传递效率(E)表示为
$E=1/\{1+(r/R_{0})^{6}\}$(2)
其中r是供体和受体分子之间的距离, R0为Fö rster半径, 表示当E等于50%时候供体和受体之间的距离, 可见E正比于供体分子和受体分子之间距离的倒数6次幂, 所以FRET对分子间距离十分敏感(FRET效率E与R0密切相关, 当r< R0时, E增加; 当r> R0时候, E减少)[17]。
FRET-FLIM测量基于对供体分子荧光寿命的测定, 当受体分子与供体之间的距离小于10 nm时, 供体的能量转移到受体, 受体从基态发生能量跃迁, 从而影响供体的荧光寿命, 与没有受体分子的时候相比, 发生FRET的供体分子的荧光寿命降低[18, 19]。 FRET-FLIM的原理如图2所示: Gü nther等[19]利用FRET-FLIM分析在MSR-1细胞中的MamJ-phiYFP和MamJ-phiYFP+TagRFP657-MamK的寿命变化, 通过TCSPC测量的荧光寿命衰减曲线: 红色线代表只有MamJ-phiYFP(供体), 绿色线代表MamJ-phiYFP与TagRFP657-MamK(受体)同时存在, 在只有供体存在时, τ D=2.95 ns; 而供体和受体同时存在时, τ DA=0.56 ns, 供体的寿命减少了2.39 ns[图2(a)]; 并分别展示了供体的寿命图[图2(b)], 供体和受体同时存在的寿命图[图2(c)]。 FRET效率E可用供体寿命表示为
$E=1-\left(\tau_{\mathrm{DA}} / \tau_{\mathrm{D}}\right)$(3)
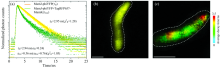 | 图2 FRET-FLIM原理图[19] (a): 通过TCSPC测量MSR-1细胞中的MamJ-phiYFP和MamJ-phiYFP+TagRFP657-MamK的荧光寿命衰减曲线; (b), (c): MamJ-phiYFP单独或与TagRFP657-MamK同时存在时的寿命图像, 较暖的颜色表示未受影响的供体衰减时间, 较冷的颜色表示较短的衰减时间, 这是由于phiYFP和TagRFP657之间的能量转移造成的, 比例尺: 1 μ mFig.2 Diagram of FRET-FLIM principle[19] (a): Representative phiYFP (donor) fluorescence decay curves measured by time-correlated single-photon counting (TCSPC) in MSR-1 expressing either MamJ-phiYFP (yellow data points) or MamJ-phiYFP together with TagRFP657-MamK (green data points) translational fusions; (b), (c): FLIM images of MSR-1 with MamJ-phiYFP alone or together with TagRFP657-MamK, in which warmer colors represent the unaffected donor decay time and colder colors represent shorter decay times due to energy transfer between phiYFP and TagRFP657, scale bar: 1 μ m |
式(3)中, τ DA和τ D分别为受体存在和只有供体存在时的荧光寿命。 因为只测量供体的寿命, 不需要测量受体的荧光信息, 所以在FRET-FLIM图像中不需要对供体-受体间的光谱串扰进行校正。 FRET-FLIM技术的分析是基于简单的数学原理, 所以可以快速完成[7]。
FRET-FLIM技术主要分为三部分: 荧光标签、 检测手段和数据分析。
1.3.1 荧光标签
如前所述, FRET的发生首先需要一对光谱匹配的荧光分子对, 因此荧光标签是FRET-FLIM的第一个技术要素。 荧光分子作为标记物应具有良好的光学性质, 如较高的量子产率、 光稳定性等, 同时还需要能够和待检测目标有特异性连接。 常用的荧光分子对有: 绿色荧光蛋白(GFP)与蓝色荧光蛋白(BFP)、 GFP与黄色荧光蛋白(YFP)、 荧光素异硫氰酸酯(FITC)与Cy3[20]等。 如今, 荧光标签不仅有荧光染料和探针, 更是研发出了如石墨烯量子点和金纳米棒等新材料[21, 22]。 例如, Zhang等[22]展现了双光子激发的FRET-FLIM方法监测金纳米棒(gold nanorods, GNRs)在活细胞中内吞摄取过程的新方法, 这项技术有助于研究体内和体外的生物成像传感及单分子追踪。
1.3.2 检测手段
FLIM技术根据寿命获取方式的不同分为频域法和时域法两类。 频域法利用经过调制的连续光谱激发样品, 通过检测荧光信号的振幅和相位变化计算得到荧光寿命信息; 时域法采用高重复频率的超短脉冲激光激发样品, 通过分析脉冲过后的荧光衰减曲线得到寿命信息。 在时域法中, 由于目前探测器的响应尚不能直接记录荧光衰减曲线, 因此需要采取一些间接探测方式, 常用的有门控探测法(time-gated detection)、 条纹相机测量法(streak-FLIM)、 时间相关单光子计数法(time-correlated single photon counting, TCSPC)。 在所有方法中, TCSPC法的时间分辨率最高, 应用最广, 但采集速度较慢; 频域法对设备要求低, 成本低, 数据处理速度快, 但其性能指标不如时域法[14]。
1.3.3 数据分析方法
通常FLIM测量得到的数据并不是直接的寿命信息, 需要根据不同测量原理得到的数据特点进行分析获取寿命值, 如TCSPC-FLIM测量得到的荧光寿命衰减信息通常采用最小二乘法拟合得到寿命。 结合FRET原理, 可对得到的寿命信息进一步处理得到FRET效率从而反映相互作用程度。 近年来, 为了改进FRET-FLIM数据的分析, 人们开发了许多方法, 其中运用最多的是全局分析(global analysis)方法和相量方法(phasor approach)。 全局分析方法通过检测受体分子不存在或存在的情况下, 供体分子的荧光寿命, 可用于准确地检测FRET现象。 Laptenok等[23]将一对相互作用蛋白同时转染拟南芥(Arabidopsis thaliana)的原生质体, 描述了应用全局分析法获得高空间分辨率的荧光寿命图像, 表明该方法适用于观察和量化活植物细胞中的FRET。 相量方法最初用于频域寿命数据的全局分析[24], 随后, Fereidouni等[25]修改了相量图的演算方法, 使其适用于分析时域门控法得到的荧光寿命图像, 并在活细胞中进行了测试。 相量法的主要优点是基于简单的数学运算, 分析速度快, 是一种可靠的分析方法, 然而它在多指数衰减中很难量化荧光寿命及其各组分的占比。 Grecco等[26]扩展了原本针对单频域FLIM数据开发的全局分析方法, 优化了FRET-FLIM数据过滤方法, 将其可以应用于TCSPC数据, 实现即使在信噪比很低的情况下, 也可以可靠地估计荧光寿命和自由及相互作用分子的相对浓度。
荧光技术作为一种新型技术之所以被广泛运用于化学、 物理和生物领域, 主要源于两个因素, 一是: 光学技术的普及和进步: 如飞秒/皮秒连续锁模激光器、 单光子雪崩光电二极管(SPAD)、 电子倍增电荷耦合器件(EMCCD)等新技术和新方法的应用; 二是: 这种方法非常敏感, 并且可以同时检测多种荧光信号。 荧光反应是一种成熟的细胞生物学技术, 因为细胞中的蛋白质可以通过与GFP及其衍生的突变体(如eGFP, YFP, CFP和BFP等)和其他mRFP衍生的荧光蛋白(如tdTomato, mOrange和mCherry等)融合而产生荧光, 这些突变体具有增强的光稳定性和亮度, 且它们的吸收/发射光谱基本上覆盖了整个可见光谱, 这样不同的细胞区间都可以被荧光材料染色[27, 28]。 因为以上原因, 它可以应用到活细胞中, 实时监测基于荧光强度的一系列生物过程。 本文总结了近年来FRET-FLIM应用于研究分子间相互作用、 信号传导和分子运输、 病理学研究的最新进展。
2.1.1 应用FRET-FLIM研究分子间相互作用的利弊
目前, FRET-FLIM技术主要用于解决需要满足高精度和多维度要求的各种生物问题。 传统研究生物蛋白-蛋白间相互作用的实验方法, 如酵母双杂交系统、 电泳迁移率改变分析(electrophoretic mobility shift assay, EMSA)和双分子荧光互补(bimolecular fluorescent complimentary, BiFC)等, 不能还原蛋白质在细胞内部的自然状态且不能进行蛋白质亚细胞定位, 可能无法准确反映活细胞中复杂的细胞环境。 例如, 已报道在EMSA实验中存在蛋白质复合物的解离, 且在迁移过程中存在人工复合物的形成[29]。 与FRET相比, BiFC系统更灵敏, 两个荧光片段的互补作用稳定, 并且利用不同颜色的BiFC系统, 可以同时观察到活细胞中多种蛋白的相互作用。 但它的缺点是对温度依赖性强, 低温有利于两个荧光片段的荧光重建, 但可能影响目标蛋白的行为; 另外, 它不能用于检测短暂关联状态时的蛋白相互作用。 相比之下, FRET-FLIM的优势在于高时空分辨率, 适用于活细胞成像, 且分析程序简单快速。 但缺点是测量时需要目标蛋白高表达, 激发光源可能会引起细胞的自发荧光和供/受体的光漂白[30], 在多指数衰减中, 荧光寿命及其贡献难以量化, 此外, 它的检测成本相对较昂贵[7]。 表1总结比较了常用于研究蛋白相互作用的方法及其优缺点。
| 表1 研究蛋白相互作用的常用方法比较 Table 1 Comparison of common methods for studying protein interactions |
2.1.2 FRET-FLIM应用于分子间相互作用的研究
FRET和FLIM的结合提供了高的空间(纳米)和时间(纳秒)分辨率, 能够实时监测生物细胞中蛋白质的动态[24]。 拟南芥是植物学研究的模式植物, 转录因子间的相互作用是基因表达调控的重要方式。 Rios等[16]使用FRET-FLIM技术观察了植物生长素响应因子ARF5在拟南芥原生质体中的二聚化反应; 拟南芥根尖维管束四周的U型区可以分为静止区、 皮层/内皮层起始区和内皮层几个部分, 每个区域的细胞形态迥然不同[38, 39]。 这三个区域的基因受到SHR (SHORT-ROOT), SCR (SCARECROW) 和 JKD (JACKDAW)等转录因子的调控。 Long等[40]在Nature上发表了利用FRET-FLIM技术, 阐述了SHR, SCR和JKD三个转录因子在根尖不同区域的相互作用模式, 不同的相互作用模式呈现不同的复合体构象, 调控不同的靶基因, 从而导致细胞分化成不同的细胞状态, 该实验在植物中实现了蛋白相互作用的可视化, 并揭示了根尖细胞发育的分子机理(图3)。
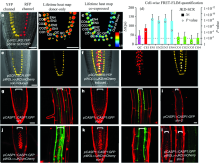 | 图3 FRET-FLIM分析显示JKD-SHR在内胚层细胞中的相互作用[40] (a)— (d): FRET-FLIM在体内测量pJKD::JKD:YFP和pSCR::SCR:RFP在根的共表达; (e), (f): pWOL≫JKD:mCherry激活pSCR::SCR:YFP在脉管系统中的表达; (g)— (i): 在野生型中表达pCASP1::CASP1:GFP的根的共聚焦图像, 括号表示维管束, 比例尺: 20 μ mFig.3 FRET-FLIM analysis of JKD-SCR shows high interaction in endodermal cells[40] (a)— (d): In vivo FRET-FLIM measurements in roots co-expressing pJKD::JKD:YFP and pSCR::SCR:RFP; (e), (f): Induction of pWOL≫JKD:mCherry activates pSCR::SCR:YFP expression in the vasculature; (g)— (l): Confocal images of roots expressing pCASP1::CASP1:GFP in wild type, brackets mark vasculature, scale bars: 20 μ m |
除了用于蛋白-蛋白间相互作用的研究, FRET-FLIM还能用于蛋白-核酸的相互作用研究。 DNA结合蛋白和RNA结合蛋白在生物体的活细胞中起着关键作用, 如参与转录、 复制和DNA修复过程等。 在体内和体外研究核酸-蛋白质相互作用的实验方法多种多样如: 染色质免疫沉淀(chromatin immunoprecipitation, ChIP)被认为是一种检测DNA和核酸相互作用的前沿技术, 但是它耗时且昂贵, 具有局限性, 如: DNA-蛋白复合物的富集不足, 交联反应效率低, 难以识别短暂的DNA-蛋白相互作用; 蛋白质的富集依赖于高活性的抗体, 从而限制了检测的应用范围等[41]。 研究RNA-蛋白质相互作用的技术, 包括RNA-EMSA, RNA pull-down, RNA印记或RNA免疫沉淀等[42, 43], 这些方法的缺点是实验步骤相对繁琐、 需要设计特定RNA探针, 并且整个过程都要在无核酸酶条件下进行, 对实验操作的要求很高[44]。 上述方法的共同缺点是不能显示细胞内核酸-蛋白质相互作用的定位信息, 为了克服这一限制, Camborde等[17]分步解析了从样品制备、 数据采集和分析环节的操作方法, 展示了如何通过FRET-FLIM研究植物叶片中核酸-蛋白之间的相互作用。 这个体系可以在多种植物种类和突变体, 例如, 拟南芥、 蒺藜苜蓿(Medicago truncatula)的不同组织(叶片和根)中使用; Garcé s等[45]利用FRET-FLIM实验, 将GFP∶ BdCRN13和GFP∶ AeCRN13(供体)分别和连接有Sytox Orange染料的核酸(受体)在烟草中瞬时转化, 当受体存在的条件下, 供体的寿命降低, 表明GFP∶ BdCRN13, GFP∶ AeCRN13和核酸分子发生了能量转移; 同理, Testard等[46]使用同样的实验方法, 在烟草细胞中验证了Nt(BY-2)GAPCs在细胞核中与核酸的相互作用。 表2总结了近年来FRET-FLIM技术应用于分子间相互作用的相关研究。
| 表2 FRET-FLIM 应用于分子相互作用的研究 Table 2 Application of FRET-FLIM in the study of molecular interactions |
细胞内信号的调控依赖于激酶和磷酸酶等分子开关的精确控制。 它们活动的中断会导致不适当的细胞增殖、 生长和存活。 蛋白激酶B (protein kinase B, PKB)是调节生长因子受体下游事件的关键激酶, Calleja等[55]使用FRET-FLIM监测细胞中PKB的构象变化, 发现PKB和其上游调节因子3-磷酸肌醇依赖蛋白激酶1 (PDK1)在细胞质中以复合物的形式存在, 并在多种生长因子的激活下, 在质膜上独特地共聚焦, 从而使PDK1磷酸化PKB。 在植物向光素介导的信号通路研究中, Xue等[49]利用FRET-FLIM检测向光素phot1-GFP和固醇富集脂质环境指示蛋白AtRem1.3-mCherry之间的相互作用, 结果发现增加蓝光处理时间可增强两者间的相互作用, 表明蓝光可促进向光素phot1迁移至细胞膜富含甾醇的微域, 从而激活信号通路。
油菜素类固醇(BR)是一类可以调节细胞生长、 分化和增殖的植物类固醇激素。 油菜素类固醇信号通路起始于细胞膜[56]。 Hutten等[48]发现BRI1和SERK3/BAK1在细胞膜上呈现不均匀的成簇分布, 随后利用FRET-FLIM发现: 在有无配体的情况下, BRI1和SERK3/BAK1的分布并没发生变化, 但在信号通路活化后, 由于内吞作用, BRI1-SERK3/BAK1寡聚体数目减少10%到15%, 因此认为细胞膜上BRI1先与SERK3/BAK1形成寡聚体后再执行BR信号的感应单元功能。 Doll等[57]利用FRET-FLIM测定RhoB聚合物(供体)对BODIPY标记的胆固醇(受体)吸收, 证明了可以在活细胞内用荧光显微镜观察到胆固醇摄取过程。
细胞核中信使RNA(mRNA)的输出是真核细胞正常功能和调控所必需的。 mRNA的出核是一个利用多种蛋白质和复合物将mRNA从转录位点通过核孔复合物(nuclear pore complex, NPC)转移到细胞质中的过程。 NPC是一个高度保守的八重对称通道, 由核孔蛋白组成[58], Yishay等[50]利用FLIM-FRET检测NPC的蛋白间相互作用关系, 发现NPC细胞质侧的特异性相互作用是mRNA定向输出的基础。
细胞外囊泡(extracellular vesicle, EV)是细胞分泌到胞外基质中的直径在20~2 000 nm的微粒, 由脂质双分子层包裹, 内含物为蛋白、 质脂质和核酸, 可与邻近或远端的靶细胞作用修饰其表型和功能。 EV根据大小和生物起源区分为外泌体、 微泡和凋亡小体等[59]。 近几年, EV尤其是外泌体在医疗和诊断领域有广泛的应用。 Saari等[60]通过FLIM, 展示了装载抗癌剂紫杉醇的不同EV亚型、 外泌体和微囊泡的不同的细胞摄取机制; 许多课题组报道了通过FRET测定NBD(荧光脂膜探针)和罗丹明(红色荧光染料)标记的脂质混合比, 定量评估外泌体和脂质体融合的效率, 这套系统被广泛用于分析脂质体-脂质体, 脂质体-细胞, 病毒-细胞的融合实验[61]; 为了控制和改善外泌体纳米载体的性能, Sato等[62]采用冻融法将外泌体的膜与脂质体融合, 开发了混合外泌体, 将含有从转基因细胞中分离出的特定膜蛋白的外泌体与各种脂质体融合, 证实膜工程方法可以与基因修饰技术相结合, 为药物传递系统提供了一种新的策略。
荧光寿命是荧光物质的固有特性, 荧光寿命的测量技术在药物发现、 医学诊断和基础生物学研究等方面有广泛的应用。 在疾病诊断中的工作方法可以归纳为两类: (1)高通量应用方法, 采用生化体外分析, 不需要高空间分辨率; (2)将高时空分辨率的荧光数据结合起来的检测方法。 第二种方法不仅能用于研究肿瘤细胞系, 而且还能用于研究活体动物的特定组织甚至器官。
典型的FRET-FLIM在一次实验中只能以低通量进行, 而且难以实现多种不同条件的实验, Osterlund等[51]开发了一种带有八个TCSPC探测器的FRET-FLIM成像系统, 可实现快速、 同步采集高光谱数据, 利用这个系统在384孔板中观察Bcl-2家族内成员间的相互作用, 有助于理解Bcl-2蛋白是如何通过相互作用来调控细胞凋亡; Margineanu等[12]开发了一种高通量的分析方法, 利用FRET-FLIM来筛选RASSF蛋白家族中MST1激酶的结合伙伴, 并量化其相互作用的亲和力, 实现了FLIM快速阅读96孔板的要求。 这种自定义的基于时间门控检测的FLIM多孔板显微镜能够快速自动获取图像, 因此有助于对双分子过程的系统研究, 提供统计上可靠的读数, 快速突出任何系统错误, 并有效地平均生物变化。
β -内酰胺酶分析法(The β -lactamase (BlaM) assay)是一种可用于研究病毒融合的方法, 是一个基于FRET的报告系统, 并且兼容一系列常用的细胞系。 如今, BlaM检测已经以试剂盒的形式进行商业销售, 并且能够方便、 廉价地用于一系列需要基于荧光检测的实验步骤[63]。 Andres和Parra提出了一种新的BlaM显微定量方法, 这种方法对单细胞融合检测、 基于群体的检测以及报告细胞和原代细胞的药物筛选检测更为直接和准确[64](图4); 此外, BlaM测试被证明特别适合于高通量筛选(HTS)试验, 用于识别如: HIV-1[65]和EBOV的潜在融合抑制剂[66]。 前期的研究表明在胚胎早期发育中, PLCγ 和SFK1在雄原核(MPN)上共定位, 却不知道它们是否相互作用, Byrne等[67]利用FRET, 通过双光子FLIM检测技术证明了PLCγ 和SFK1在MPN的表面共定位, 但是, 只有在原核融合时才发生直接的交互作用; Meshri等[68]利用FRET-FLIM技术在Hela细胞中分析研究了HIV-1的Pr55 Gag的核衣壳(NC域)在Gag寡聚和细胞内转运的动力学中的功能, 这一发现强调了NC域在病毒装配中的关键作用。
荧光寿命是荧光物质的固有属性, 与探针浓度、 激发强度或光漂白无关, 可以区分光谱相似的荧光团。 在活细胞应用中, 细胞中的蛋白质可以通过与GFP及其衍生的突变体融合而产生荧光, 实时监测基于荧光强度的一系列生物过程。 传统的生化方法(如酵母双杂交系统、 免疫共沉淀系统等)分析蛋白相互作用, 不能还原蛋白质在细胞内部的自然状态且不能进行蛋白质亚细胞定位, 可能无法准确反映活细胞中复杂的细胞环境, 相比之下, FRET-FLIM能够呈现活细胞中细胞结构及其生物过程的高时空分辨率的实时“ 可视化” 图像, 且分析程序简单快速, 分析结果不需要光谱校正。
FRET-FLIM技术发展已经日益成熟, 广泛应用于研究分子间相互作用、 信号传导和分子运输、 病理学研究等方面, 进一步推动了在药物发现、 医学诊断和基础生物学研究等方面的研究进展。 尽管与其他显微技术相比, FRET提供了独特的成像信息, 但是它也有缺点: (1)信噪比(signal noise ratio, SNR or S/N)低: FRET测量的最大局限性是与FRET成像相关的低信噪比。 在许多情况下, 测量的荧光衰减曲线被建模为一个单指数函数, 然而, 通常情况下, 不同浓度或不同荧光团的多个分子物种在标本中呈现双指数衰减, 高信噪比是多指数衰减可靠分析的必要条件[69]。 FRET过程相关的能量损失, 以及两个荧光分子直接或间接参与了FRET信号的测量是导致SNR降低的主要因素[70]; (2)推广应用范围有限: FRET-FLIM系统相对复杂, 对光源要求高, 探测器价格昂贵, 要求从业者具备光谱学的专业知识来理解数据和操作设备, 其庞大的硬件系统限制了临床诊断技术推广的可行性。
FRET-FLIM技术在生命科学领域具有广阔的发展前景。 未来科研人员仍需要在FRET测量的生物样品、 探测技术和数据分析等方面进行不断改进, 使三维空间和时间分辨的生化研究能够在单个细胞、 局部亚细胞间隔和活组织内进行[71]。 首先, 促进生物技术的创新进步, 如开发改良的荧光标签, 提高生物组织穿透性和超分辨率是FRET-FLIM技术的发展方向; 其次, 与其他技术相结合, 提供深层组织信息, 如光声成像(photoacoustic imaging, PAI)、 新型多模态成像系统等, 三分子和更高分子的FRET将成为探索分子间多步相互作用的新手段。 这些技术有望扩大FRET-FLIM技术的诊断能力; 最后, 发展新的数据分析技术和编码新的图像分析算法, 有助于提高FRET效率计算的准确性, 更好地利用现有显微镜系统获得的数据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|