作者简介: 徐 宁, 女, 1996年生, 江西农业大学工学院硕士研究生 e-mail: 1517866554@qq.com
以金溶胶作为活性基底, 浓度为1%的NaCl溶液作为活性剂, 利用DXRTM显微拉曼光谱仪采集鸡肉的表面增强拉曼光谱(SERS), 实现快速鉴别鸡肉中残留的磺胺二甲基嘧啶(SM-2)和磺胺吡啶(SPD)两种抗生素。 用937和1 188 cm-1处是否有拉曼特征峰来判别鸡肉中是否残留SPD和SM-2。 采用单因素实验方法, 根据937和1 188 cm-1处的特征SERS强度, 对试验条件进行优化, 得到最佳试验条件: 金溶胶加入量为500 μL、 NaCl溶液加入量为100 μL和吸附时间为5 min, 所选用的金溶胶柠檬酸钠加入量3.7 mL。 根据测试集鸡肉中残留的SM-2和SPD的分类精度确定研究用自适应迭代惩罚最小二乘法(air-PLS)、 归一化和二阶导数作为原始拉曼光谱的预处理方法, 然后用主成分分析(PCA)提取特征向量, 最后以前四个PCA得分值作为支持向量机(SVM)分类模型的输入值, 建立基于C-SVC类型的SVM分类模型。 其中, 最优惩罚参数 c为0.01、 核参数 g为0.1。 此分类模型对测试集的整体分类精度达到93.23%。 对测试集的敏感性和特异性进行计算, 敏感性的范围为77.42%~100%, 特异性的范围为96%~99.02%, 其中, 含SM-2+SPD鸡肉的敏感性最高为100%, 含SPD鸡肉的特异性最高为99.02%。 试验结果表明, 该方法具有良好的鉴别效果, 可用于实现对鸡肉中SM-2和SPD两种抗生素残留的快速检测和鉴别。
Surface-enhanced Raman spectroscopy (SERS) of chicken was collected by DXRTM micro-Raman spectrometer with gold colloid as an active substrate and NaCl solution as the active agent. Rapid identification of sulfadimidine (SM-2) and sulfadiazine (SPD) residues in chicken was achieved. Raman peaks at 937 and 1 188 cm-1 were used to determine whether there are SM-2 and SPD in chicken or not. The Single-factor experiment method was used to optimize the experimental conditions, and the optimum experimental conditions were obtained: the addition amount of Gold glue was 500 L, the addition amount of NaCl solutionwas 100 L and the adsorption time was 5 minutes. The original Raman spectra were pre-processed by adaptive iterative penalty least squares (air-PLS), normalization and second derivative. Then the eigenvectors were extracted by principal component analysis (PCA). Finally, the first four PCA scores were used as input values of the support vector machine (SVM) classification model, and the SVM classification model based on C-SVC type was established. The optimal penalty parameter c was 0.01, and the kernel parameter g was 0.1. The overall classification accuracy of the model was 93.23%, the sensitivity of chicken containing SM-2+SPD was 100%, and the specificity of chicken containing SPD was 99.02%. The results showed that this method had good identification effects. It could be used to detect and identify SM-2 and SPD antibiotic residues in chicken quickly.
磺胺二甲嘧啶(sulfadimidine, SM-2)和磺胺吡啶(sulfapyridine, SPD)都属于磺胺类药物, 是人工合成的价格低、 性质稳定、 应用简单的抗菌药[1], 对许多病菌均有抑制作用, 对细菌感染性疾病能产生一定的预防和治疗作用[2]。 很多养殖户为了提高动物对疾病的预防能力, 在饲养过程中常将此类抗生素添加到饲料中[3]。 每年, 磺胺类药物的使用量都非常可观, 例如2018年养殖使用的兽用抗菌药中, 磺胺类药物制剂数量最多, 多达38种, 但是此类抗生素在动物体内代谢较慢、 容易累积, 进而导致禽肉体内残留量过高[4], 如果人们长期食用此类禽肉, 残留的抗生素将会随着禽肉进入体内、 产生积累, 将严重影响人体健康, 甚至对血液系统或者免疫系统造成损坏[5]。
目前常用的磺胺类抗生素残留检测方法包括: 固相萃取— 高效液相色谱[6]、 高效液相色谱-荧光检测[7]、 酶联免疫法[8]等。 上述方法虽然能检测磺胺类抗生素的残留, 但是对样品的前处理要求较高, 检测过程相对比较复杂, 不能同时满足快速、 高效的检测要求。 随着生活水平的提高, 人们对食品安全问题越来越重视, 需要有一种方法能够快速检测食品是否安全。 因此, 快速检测鸡肉中磺胺类抗生素残留的方法具有重要的研究价值。
本研究采用的表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)是一种检测速度快、 敏感性高、 样品制备简单的新技术, 它能将原始拉曼光谱增强105~106倍。 因此, SERS技术常被运用到食品的快速检测中。 例如马海宽[9]运用SERS技术, 用乙酸乙酯提取某些干扰物质, 用银胶作为增强基底, 对鱼肉中磺胺类抗生素的残留进行快速检测, 确定了磺胺甲基嘧啶和磺胺二甲基嘧啶的最低检测限分别为0.16和0.59 mg· L-1。 有研究以金溶胶为表面增强活性基底, 运用SERS技术对两类硝基呋喃类药物进行快速鉴别, 确定了鉴别峰为1 420和1 456 cm-1, 最低检测限为5 ppm。 韩斯琴高娃[10]运用SERS技术检测牛奶中SM-2的残留, 确定了SM-2在牛奶中的拉曼特征峰以及最低检测限。 虽然目前已有运用SERS技术检测食品中磺胺类抗生素的研究, 但一般用来检测是否存在某一种抗生素的残留。 同时检测多种磺胺类抗生素的残留一般运用固相萃取、 高效液相等相关方法[11, 12], 未见运用SERS技术鉴别鸡肉中SM-2和SPD两种磺胺类抗生素残留的研究。 本研究以金溶胶为增强基底, NaCl溶液为活性剂采集鸡肉的SERS谱, 实现快速鉴别鸡肉中残留的两种抗生素, 即: SPD和SM-2。
DXRTM显微拉曼光谱仪(美国赛默飞世尔科技有限公司); T6新世纪紫外-可见分光光度计(北京普析通用仪器有限公司); JK-50B超声波清洗器(合肥金尼克机械制造有限公司); FA1004B电子天平(北京科伟永兴仪器有限公司); ZNCL-T智能恒温磁力搅拌器(郑州市亚荣仪器有限公司); FD-1A-50真空冷冻干燥机(北京博医康试验仪器有限公司)。
三水合四氯金酸(≥ 49.0%, 西格玛奥德里奇贸易有限公司); SM-2(纯度99.4%, 英国政府化学家试验室); SPD(纯度99.4%, 英国政府化学家试验室); 柠檬酸三钠和氯化钠(NaCl), 分析纯, 购于西陇化工股份有限公司。
(1)标准溶液(SM-2溶液、 SPD溶液)的配制: 将25 mg标准品溶解于500 mL超纯水, 得到两种50 mg· L-1的标准溶液。 利用此标准溶液配制其他不同浓度的SM-2溶液、 SPD溶液和SM-2+SPD混合溶液。
(2)鸡肉预处理: 先将鸡胸肉(购于江西省南昌华润万家超市)放在冰箱冷冻(温度为-20 ℃)5 h, 用切片机切片, 然后放在真空冷冻干燥器中干燥48 h, 取出备用。 分别用SM-2标准溶液、 SPD标准溶液、 SPD+SM-2混合标准溶液和超纯水浸泡干燥后的鸡胸肉, 然后晾干, 得到三类加标的鸡肉样本: 含SM-2的鸡肉、 含SPD的鸡肉、 含SM-2+SPD的鸡肉, 和一类未加标的鸡肉样本: 不含SPD和SM-2的鸡肉(即空白鸡肉)。 试验共得到400个样本用来进行分类鉴别, 其中, 267个样本作为训练集, 133个样本作为测试集。
(3)金溶胶的制备[13]: 参考Frens方法制备高分散性的金溶胶, 以三水合四氯金酸为金源, 通过改变还原剂柠檬酸钠的加入量来改变金溶胶粒径大小。 分别将四个含有100 mL浓度为1 mmol· L-1四氯金酸溶液的圆底烧瓶放至智能恒温磁力搅拌器中加热, 当四氯金酸溶液沸腾时分别迅速加入3.5, 3.7, 3.9和4.1 mL浓度为1%的柠檬酸三钠溶液, 打开旋转按钮, 带动圆底烧瓶中的搅拌子剧烈旋转, 15分钟后, 取出圆底烧瓶, 将金溶胶倒入烧杯中冷却至室温。 上述步骤共制得4种粒径不同的金溶胶。
(4)紫外-可见光谱: 取1 mL样本(金溶胶或金溶胶+SPD+SM-2+NaCl溶液), 加3 mL超纯水稀释, 用紫外分光光度计对稀释后的样本采集400~900 nm范围的紫外-可见光谱。
(5)拉曼光谱: 将经过预处理的鸡肉样本放到载玻片上, 把500 μ L金溶胶和100 μ L NaCl溶液一起加入微型离心管, 震荡后滴加到鸡肉上, 并将载玻片放到载玻台上, 吸附5 min后, 用DXRTM显微拉曼光谱仪采集拉曼光谱。 用于优化试验的样本每个采集5次, 取其平均值作为该样本的拉曼光谱。 用于分类鉴别的样本每个采集一次作为该样本的拉曼光谱。
显微拉曼光谱仪的参数设置: 激光能量: 20 mW; 采集曝光时间: 10 s; 预览采集时间: 10 s; 样品曝光: 10次; 背景曝光: 16次, 选择SERS研究范围为400~1 800 cm-1。
(6)样本的优化试验: 采用单因素实验方法对试验条件进行优化, 其中包括金溶胶粒径(通过改变柠檬酸钠的量控制)、 金溶胶加入量、 NaCl溶液加入量以及吸附时间, 通过比较937和1 188 cm-1处的SERS信号强度来确定最优试验条件。
制备金溶胶的柠檬酸钠加入量的优化: 分别将500 μ L用3.5, 3.7, 3.9和4.1 mL柠檬酸钠制备的金溶胶与100 μ L NaCl溶液混合均匀后滴加到放在载玻片上的含SM-2+SPD的鸡肉上, 然后将载玻片放到载玻台上, 吸附5 min后, 采集拉曼光谱。 每个样本采集5次, 取其平均值作为该样本的拉曼光谱。 比较937和1 188 cm-1处的SERS信号强度。
金溶胶加入量的优化: 分别将400, 450, 500和550 μ L的金溶胶与100 μ L NaCl溶液混合均匀后滴加到放在载玻片上的含SM-2+SPD的鸡肉上, 然后将载玻片放到载玻台上, 吸附5 min后, 采集拉曼光谱。 每个样本采集5次, 取其平均值作为该样本的拉曼光谱。 比较937和1 188 cm-1的SERS信号强度。
NaCl溶液加入量的优化: 将500 μ L金溶胶分别与50, 100, 150和200 μ L NaCl溶液混合均匀后滴加到放在载玻片上的含SM-2+SPD的鸡肉上, 然后将载玻片放到载玻台上, 吸附5 min后, 采集拉曼光谱。 每个样本采集5次, 取其平均值作为该样本的拉曼光谱。 比较937和1 188 cm-1的SERS信号强度。
吸附时间的优化: 将500 μ L金溶胶与100 μ L NaCl溶液混合均匀后滴加到放在载玻片上的含SM-2+SPD的鸡肉上, 然后将载玻片放到载玻台上, 分别吸附1, 5, 10和15 min后, 采集拉曼光谱。 每个样本采集5次, 取其平均值作为该样本的拉曼光谱。 比较937和1 188 cm-1处的SERS信号强度。
(7)数据处理方法: 首先采用自适应迭代惩罚最小二乘法(air-PLS)、 归一化和二阶导数对原始数据进行处理。 然后用主成分分析(principal component analysis, PCA)提取特征向量, 以前四个PCA得分值作为支持向量机(support vector machine, SVM)分类模型的输入值建立基于C-SVC类型的SVM分类模型, 对样本进行分类鉴别。
增强基底的性质是影响SERS信号强度的重要因素之一, 增强基底的制作方法、 制作材料以及外界条件等诸多因素都可能影响增强基底的性质, 以致SERS信号强度发生改变[14]。 常用的增强基底主要有金溶胶和银溶胶, 由于金溶胶制备简单, 且具有良好的增强性能, 所以本试验采用金溶胶作为增强基底。
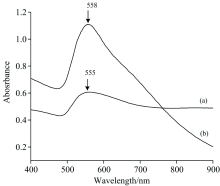
分别采集金溶胶、 金溶胶+SPD+SM-2+NaCl的紫外-可见光谱, 得到图1中的曲线a和曲线b。 由曲线a可知, 加入3.7 mL柠檬酸钠制备的金溶胶的最大吸收峰在555 nm处, 在其他位置没有出现明显的吸收峰, 说明金溶胶在其他地方没有发生明显的凝聚[15]。 对比曲线a和曲线b, 当金溶胶中加入SPD+SM-2混合溶液和NaCl溶液后, 由于SPD分子、 SM-2分子或Cl-与金纳米粒子相结合, 使得纳米粒子表面等离子体共振性质发生改变, 从而改变了金纳米粒子尺寸或聚集状态, 从而导致了吸收峰发生红移, 峰形变宽[16]。
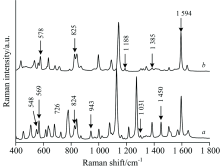
采集SPD标准品和SM-2标准品的拉曼光谱, 结果如图2曲线a和b所示。 对金溶胶+NaCl溶液、 SM-2水溶液+金溶胶+NaCl溶液、 SPD水溶液+金溶胶+NaCl溶液和SM-2+SPD水溶液+金溶胶+NaCl溶液进行测定, 得到的SERS光谱分别如图3曲线a, b, c和d所示。 由图2曲线a可知, SPD标准品在548, 569, 726, 824, 943, 1 031和1 450 cm-1处有的特征峰。 由图3曲线c可知, SPD水溶液+金溶胶+NaCl溶液在569, 820, 946和1 455 cm-1处有突出的特征峰, 同时图3曲线d在569, 946和1 455 cm-1处有突出的特征峰, 而曲线a在这些位移处没有突出的特征峰。 将SPD标准品配制成水溶液并加入金溶胶与NaCl溶液后, 由于SPD分子或Cl-1与金溶胶结合, 产生了表面等离子体共振, 使得943和1 450 cm-1处的特征峰发生了红移, 红移至946和1 455 cm-1。 因此, 可以根据569, 946和1 455 cm-1处是否有突出的特征峰来判断水溶液中是否存在SPD抗生素的残留。
由图2曲线b可知, SM-2标准品在578, 825, 1 188, 1 385和1 594 cm-1处有突出的特征峰。 由图3曲线b可知, SM-2水溶液+金溶胶+NaCl溶液在823, 1 178, 1 378和1 590 cm-1处有突出的特征峰, 同时图3曲线d在1 178, 1 378和1 590 cm-1处有突出的特征峰, 而曲线a在这些位移处并没有突出的特征峰。 将SM-2配制成水溶液并加入金溶胶与NaCl溶液后, 由于SM-2分子或Cl-1与金溶胶结合, 产生了表面等离子体共振, 使1 188, 1 385和1 594 cm-1处的特征峰发生了蓝移。 因此, 可以根据1 178, 1 378和1 590 cm-1处是否有突出的特征峰来判断水溶液中是否有SM-2抗生素的残留。 由于图3曲线d在822 cm-1处有突出的特征峰, 曲线b 823 cm-1处和曲线c 820 cm-1处都有突出的特征峰, 因此无法确定水溶液中822 cm-1处的特征峰究竟是SPD的特征峰, 还是SM-2的特征峰。
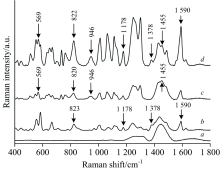
分别对空白鸡肉、 含SM-2的鸡肉、 含SPD的鸡肉和对含SM-2和SPD的鸡肉进行SERS信号的采集, 分别如图4中曲线a— d所示。 比较曲线a, b, c和d, 曲线d在697, 823, 937, 1 078, 1 188和1 271 cm-1处有突出的特征峰, 而曲线a在这些位置并没有特征峰, 因此这些峰可能是抗生素的特征峰。 观察曲线b可知, 在823, 1 188, 1 220和1 271 cm-1处有明显的特征峰, 而曲线a在这些位置没有明显的特征峰, 因此根据曲线b和d可知823, 1 188和1 271 cm-1处的峰可能是SM-2的特征峰。 但是由图2和图3可知, SM-2标准品的特征峰在825, 1 188, 1 385和1 594 cm-1处, SM-2水溶液的特征峰在1 178, 1 378和1 590 cm-1处, 因此可以确定1 188 cm-1处的特征峰为SM-2在鸡肉中的特征峰。 观察曲线c可知, 在697, 937和1 078 cm-1处有明显的特征峰, 而曲线a中这些位置并没有特征峰, 同时与图2、 图3比较可以确定, SPD分子与金溶胶、 NaCl溶液或者鸡肉相互影响, 使得SPD在鸡肉中的拉曼特征峰发生蓝移, 由946 cm-1蓝移至 937 cm-1处。 因此, 可用1 188 cm-1处的特征峰用来判别鸡肉中是否含有SM-2的残留, 937 cm-1处的特征峰来判别鸡肉中是否含有SPD的残留。
单因素实验方法用来对试验条件进行优化, 因为937和1 188 cm-1处的拉曼特征峰可以判定SPD和SM-2在鸡肉中的残留, 所以本试验选择通过比较937和1 188 cm-1处的SERS信号强度来确定最优试验条件。
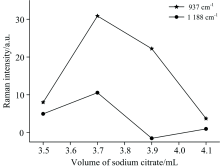
金溶胶的粒径大小对SERS信号的增强效果有着显著的差异。 本试验制备了四种不同粒径的金溶胶, 分别将四种金溶胶作为活性基底, 对鸡肉的SERS信号进行采集。 由图5可知, 937和1 188 cm-1处的SERS信号强度随着柠檬酸钠加入量的增加而增强。 当柠檬酸钠加入量为3.7 mL时, SERS信号强度达到最大, 随着柠檬酸钠加入量的继续增加, SERS信号强度减弱。 因此对于测定鸡肉中SM-2和SPD的残留的SERS检测, 柠檬酸钠加入量为3.7 mL时的金溶胶的增强效果更强。 当柠檬酸钠加入量继续增加时, 可能由于SPD和SM-2分子与金溶胶纳米粒子的表面发生了吸附或结合, 改变了金溶胶纳米粒子的表面等离子体共振性质, 降低了金溶胶的增强效果[17], 因此SERS信号强度减弱。 由图可知, 当柠檬酸钠加入量达到3.9 mL, 然后继续增加, 1 188 cm-1处的SERS信号强度有所提高, 但是还是明显低于用3.7 mL柠檬酸钠制备的金溶胶的SERS信号强度。 本试验采用加入3.7 mL柠檬酸钠制备的金溶胶作为活性增强基底。
SERS效应主要是由吸附在粗糙的金溶胶纳米粒子表面的待测分子产生电磁效应和化学效应所引起, 因此只有部分附着在金溶胶表面活性位置的待测分子才能产生增强效应, 金溶胶的加入量会影响SERS信号强度[18]。 本试验分别将待测物中加入不同量的金溶胶(400, 450, 500和550 μ L), 采集待测物进行SERS信号。 通过比较SERS信号强度来确定金溶胶最佳加入量, 结果如图6所示。 当金溶胶加入量增加时, 937 cm-1处的拉曼信号强度增强。 当金溶胶加入量达到450 μ L时, SERS信号强度达到最高, 当金溶胶的量继续增加时, SERS信号强度降低。 1 188 cm-1处的SERS信号强度变化由图6可知, SERS信号强度随着金溶胶加入量的增加而呈上升趋势, 500 μ L时SERS信号达到最强, 继续增加金溶胶SERS信号呈下降趋势。 产生这种现象的原因可能是随着金溶胶纳米粒子的增加, 待测分子不断吸附在金溶胶纳米颗粒表面活性位置, 使SERS效应不断增强, 当金溶胶纳米粒子继续增多后, 待测分子与金溶胶纳米粒子的体积比减小, SERS信号强度降低。 由图6可知, 当金溶胶加入量为450 μ L时, 937 cm-1处的SERS强度最强, 而金溶胶加入量为500 μ L时, 1 188 cm-1处的SERS强度才能达到最强, 确定一个金溶胶加入量不能保证两个特征峰的SERS信号强度同时达到最强, 因此只能选择一个相对效果更好的金溶胶加入量。 观察图6中两条曲线可知, 937 cm-1处的SERS信号强度整体比1 188 cm-1处的SERS信号强度高。 因此, 如果选择450 μ L为最优金溶胶加入量, 当SM-2浓度较低时, 1 188 cm-1处的SERS信号可能无法采集到。 但是如果选择500 μ L为最优金溶胶加入量, 对1 188 cm-1处的SERS信号增强效果最好, 并且937 cm-1处的SERS信号强度要高于1 188 cm-1处的SERS信号强度。 因此, 鸡肉中只要含有SPD, 937 cm-1处的SERS信号一定能采集到。 因此, 选择最优金溶胶加入量为500 μ L。
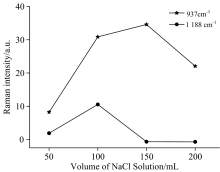
采集含SPD和SM-2鸡肉的SERS信号时, 吸附在金溶胶纳米粒子表面的SPD和SM-2分子产生的SERS效应很难直接被显微拉曼光谱仪器检测到。 当加入一定量的活性剂NaCl溶液时, SERS效应能被检测到。 因此, 本试验选择NaCl溶液作为活性剂。 对加入不同量NaCl溶液(50, 100, 150和200 μ L)的待测物进行SERS信号的采集, 试验结果如图7所示。 937和1 188 cm-1处拉曼特征峰显示, 当不断增加NaCl溶液加入量时, SERS信号不断增强。 这是因为Cl-1会使金纳米粒子产生凝聚, 使局域电磁场增强, 从而使SERS不断增强[19]。 当NaCl溶液的加入量为100 μ L时, 1 188 cm-1处的SERS信号强度达到最强, 而937 cm-1处的SERS信号强度还在持续增强, 当NaCl溶液加入量为150 μ L时, SERS信号强度达到最强。 这是因为Cl-促进了待测分子与金溶胶纳米粒子之间的吸附作用, 从而使SERS信号得到增强, 但是加入过量的NaCl溶液后, Cl-过多, 加剧金溶胶纳米粒子的凝聚作用而产生沉淀, 导致SERS效应减弱。 NaCl溶液加入量为100和150 μ L对937 cm-1处的SERS信号强度影响不大, 但是当NaCl溶液加入量为150 μ L时, 1 188 cm-1处的SERS信号强度相比加入量为100 μ L时的信号强度急剧减小。 因此, 本研究确定NaCl溶液的最佳加入量为100 μ L。
按照以上试验, 得到金溶胶最佳加入量为500 μ L, NaCl溶液最佳加入量为100 μ L, 将这两种溶液一起加入到微型离心管中, 震荡后滴加到待测物上, 采集待测物进行SERS信号的。 由图8可知, 鸡肉对金溶胶和NaCl溶液混合物的吸附时间不同会对SERS信号的强度产生影响, 并且当吸附时间为5 min时, SERS信号最强。 产生这种现象的原因是吸附时间过短, 不能使待测分子与金溶胶纳米粒子充分吸附, 吸附时间过长会使金溶胶纳米粒子凝聚过度从而产生沉淀。 因此, 选择最佳的吸附时间为5 min。
为了提高预测模型的分类精度, 在主成分分析之前对原始拉曼光谱进行了前处理。 选择了三种常见的前处理方法: air-PLS、 归一化和二阶导数对原始试验数据进行前处理。 Air-PLS在不改变有效特征峰的前提下扣除荧光等背景信号, 以消除干扰。 归一化主要是把数据变成[0, 1]之内的小数, 不仅不改变数与数之间的相对关系, 同时使数据可比性更强, 数据分析更加方便。 表1列出了PCA-SVM结合三种前处理方法对测试集(n=133)分类正确和错误的个数。 由表1可知, 对于三组不同的前处理方法, PCA-SVM模型对测试集分类精度分别为64.66%, 85.71%和93.23%。 其中, 以air-PLS+归一化+二阶导数作为前处理方法的分类精度最高。 因此, 选择air-PLS+归一化+二阶导数作为本研究的前处理方法。
| 表1 基于PCA-SVM的三种前处理方法对测试集鸡肉中残留的SM-2和SPD的分类结果 Table 1 Results of classification of SM-2 and SPD in chicken based on PCA-SVM with three pretreatment methods for test set |
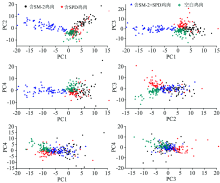
在损失较少信息的前提下, PCA利用降维的中心思想, 把多个指标转换成几个综合指标的多元统计方法[20]。 对经过前处理的SERS信号进行主成分分析, 绘制前四个主成分的PCA得分值如图9所示, PC1— PC2, PC1— PC3和PC1— PC4能将含SM-2+SPD的鸡肉区分出来, PC2— PC3能将不含两种抗生素的鸡肉区分出来, 但是没有一组得分图能将含SM-2的鸡肉或将含SPD的鸡肉区分出来。 因此, 在选择前四个PCA得分值作为分类模型的输入值的基础上还要利用SVM来扩大四类鸡肉样本之间的差异, 以便更有效地进行分类。
用SVM对三类加标的鸡肉和空白鸡肉进行分类。 选择C-SVC作为分类模型的类型, 选择多项式为分类模型的核函数, 以前四个PCA得分值作为SVM分类模型的输入值。 由于惩罚参数c和核参数g对分类模型的性能有很大的影响, 利用SVM中的自动优化功能确定了最佳的c和g分别为0.01和0.1。
SVM分类模型结合三种前处理方法得到测试集不同加标鸡肉的敏感性和特异性如表2所示。 经过air-PLS+归一化前处理后, 分类鉴别的敏感性的范围为51.61%~76.47%, 特异性的范围为81.37%~96.97%, 其中空白鸡肉的敏感性和特异性最强, 分别为76.47%和96.97%, 含SPD鸡肉的敏感性和特异性最低, 分别为51.61%和81.37%。 经过air-PLS+二阶导数前处理后, 分类鉴别的敏感性范围为70.59%~100%, 特异性范围为86.73%~100%, 其中含SM-2鸡肉的敏感性最高为100%, 空白鸡肉的特异性最高为100%。 经过air-PLS+归一化+二阶导数前处理后, 分类鉴别的敏感性范围为77.42%~100%, 特异性范围为96%~99.02%。 其中含SM-2+SPD鸡肉的敏感性最高, 为100%, 含SPD鸡肉的敏感性最低, 为77.42%。 对于特异性而言, 含SPD鸡肉的特异性最高, 为99.02%, 含SM-2鸡肉的特异性最低, 为96%。 综合考虑, 结合air-PLS+归一化+二阶导数前处理方法而建立的C-SVC分类模型能够更加精确地鉴别四种鸡肉。
| 表2 不同预处理方法建立的PCA-SVM模型对测试集不同加标鸡肉鉴别的敏感性和特异性 Table 2 Sensitivity and specificity of PCA-SVM model established by different pretreatment methods for identification of chicken with different labeling in test set |
建立了一种运用SERS技术快速鉴别鸡肉中两种磺胺类抗生素(即: SM-2和SPD)的方法, 直接对鸡肉进行检测, 不再需要制备鸡肉提取液, 节省了大量前处理时间, 提高了检测效率。 结合单因素实验方法对实验的条件进行优化, 得到了最佳试验条件。 在采用三种前处理方法的基础上, 结合PCA和SVM建立了PCA-SVM分类模型, 实现了对鸡肉中存在的SM-2和SPD的快速分类鉴别, 分类精度可以达到93.2%以上, 测试集中含SM-2+SPD鸡肉的敏感度最高达到100%, 含SPD鸡肉的特异性最高达到99.02%。 因此, 本方法能够满足对鸡肉中SM-2和SPD两种抗生素残留的快速鉴别, 并且应用SERS技术和分类建模方法可能开发出一种快速筛选的工具供需要者使用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|