作者简介: 张 昭, 1979年生, 西北农林科技大学机械与电子工程学院博士研究生 e-mail: gotoxn@nwsuaf.edu.cn
葡萄霜霉病是全球危害最严重的葡萄病害, 对该病进行早期检测和防治, 可提高葡萄品质和产量, 提出一种基于多光谱荧光成像技术(MFI)和支持向量机模型(SVM)的霜霉病早期检测方法。 对人工接种霜霉病的葡萄叶片(145个)和健康对照叶片(145个)从叶背面连续6天进行多光谱荧光成像, 获得试验叶片16个荧光参数(4个单独波段F440, F520, F690, F740及其相互比值)的图像。 在分析不同荧光波段图像随接种天数(DPI)变化规律基础上, 通过单因素方差分析和相关性分析, 优选出进行霜霉病早期检测的4个波段特征F520, F690, F440/F740, F690/740, 利用这4个特征构建基于SVM的霜霉病检测模型。 试验发现, 16个荧光参数都有早期检测霜霉病的潜力, 四个单独波段中F440和F520比F690和F740对霜霉病的侵染更敏感, 6DPI才显症的病斑能在F440和F520波段2DPI(接种后第二天)的荧光图像中凸显, 接种叶片F440和F520波段荧光强度均随着DPI增加快速升高, 在2DPI显著高于健康叶片( p<0.01), 并随着DPI增加更加显著( p<0.0001); 接种叶片F690和F740波段荧光强度均随着DPI增加逐渐减小, 1DPI—3DPI与健康叶片无显著差异, 从4DPI开始显著低于健康叶片( p<0.05), 并在5DPI—6DPI更加显著( p<0.01); 健康叶片荧光参数变化很小。 F440极易受干扰, 变异系数最大, F520最稳定。 随着DPI增加, 叶片被侵染程度加深, 4个特征融合的SVM模型对健康和接种叶片检测准确率逐渐提高, 1DPI的准确率为65.6%, 3DPI检测准确率为82.2%, 整个试验周期(1DPI—6DPI)的平均检测准确率达84.6%, 高于单一特征中最优波段F520的阈值检测结果(1DPI的准确率为61.1%, 3DPI检测准确率为78.9%, 整个试验周期为80.0%)。 结果表明利用MFI技术和SVM模型能实现霜霉病显症前的早期检测, 为便携式葡萄霜霉病早期诊断设备的开发提供了理论依据。
Grapevine downy mildew is the most serious grape disease worldwide. Early detection of this disease can achieve early control so that quality and yield are improved. A test method based on multicolor fluorescence images (MFI) on grape leaves and a Support Vector Machine (SVM) model was proposed in the current study. Multicolor fluorescence imaging was performed on 145 inoculated leaves and 145 healthy leaves from the backside at six consecutive DPI (Days Post Innoculation). 16 fluorescence parameters (F440, F520, F690, F740 and their respective ratios) were obtained. Based on the image variation of four independent fluorescence wavelengths as DPI proceeding, single-factor ANOVA and correlation analysis were conducted. Four wavelengths of F520, F690, F440/F740 and F690/F740 were best selected with stronger detection ability of early infection and low correlation. For better detection, an SVM model was constructed with all four features. The results showed that the four basic bands F440, F520, F690, F740 and their ratios had the ability to detect early infection of grapevine downy mildew. F440 and F520 were more sensitive to the infection than F690 and F740. Start from 2 DPI, the area of the lesion could be highlighted in the fluorescence images of F440 and F520, at which the fluorescence intensity of the inoculated leaves was significantly higher than that of healthy leaves ( p<0.01), and the difference increased with the increase of DPI ( p<0.000 1). At F690 and F740 bands, the fluorescence intensity of inoculated leaves decreased gradually with the increase of DPI, and there was no significant difference between inoculated and healthy leaves from 1DPI to 3DPI. At 4DPI, inoculated leaves’ fluorescence intensity was significantly lower than that of heathy leaves ( p<0.05) and the difference increased at 5DPI and 6DPI( p<0.01). The fluorescence parameters of healthy leaves changed little. F440 was the most susceptible to interference with the maximum coefficient of variation among the four bands, while F520 was more stable with the least coefficient of variation. With the increase of DPI, the detection accuracy of SVM model for distinguishing healthy and inoculated leaves was gradually improved, at 1DPI, the accuracy of SVM with multi-features was 65.6%, the accuracy of 3DPI achieved 82.2%, and the average accuracy was 84.6% in the whole experimental period (6 d), which was better than the best threshold method (F520 with 61.1% at 1DPI, 78.9% at 3DPI and 80.0% in the whole experimental period). In conclusion, the MFI technology with SVM model can achieve the early detection of downy mildew before the onset of symptoms, which provides a theoretical basis and proof for the development of portable equipment for early diagnosis of grape downy mildew.
霜霉病是全球第一大葡萄病害, 具有分布广、 流行性强, 危害大等特点。 该病是葡萄霜霉菌(P. viticola)引起的真菌病害, 在春夏多雨潮湿的地区发生, 由叶背面的气孔侵入寄主, 早期症状为叶背面上出现白色霜状霉层。 防治实践表明, 在侵染初期需要及时防治, 否则会造成病情难以控制, 颗粒无收甚至毁园。 为了实现在霜霉菌侵染初期进行早期预防, 要求对葡萄霜霉病侵染进行早期检测, 在病菌刚刚侵染、 病情容易控制的阶段检测出来, 为霜霉病的防治情报提供及时、 准确的信息, 对提高农药利用效果, 减少农药使用量, 控制和切断霜霉病大面积蔓延, 提高葡萄品质和葡萄园精细化管理水平, 增加生产效益等均具有重要意义。
目前, 生产中早期诊断葡萄霜霉病, 广泛采用田间观察和室内检验方法。 田间观察法只能由人对田间生长的葡萄叶片和果实进行肉眼观察后凭经验判断, 评价因人的经验而异、 主观性强, 且在病症不可见时无法做出判断。 室内检验法一般将疑似病叶离体培养, 在显微镜下进行形态观察, 确定病原菌。 此外, 也可利用PCR(polymerase chain reaction)技术进行更精确检测, 但该方法必须在实验室提取DNA, 并预先设计PCR引物, 操作复杂耗时, 需要专业的人员和设备。 以上方法均无法实现方便快捷的霜霉病早期检测。 近年来, 非侵入的光谱成像技术在农作物病害检测研究方面取得了许多成果, 能够在时间和空间维度上同时获取精准的病害信息[1]。 可见光、 热红外、 高光谱、 荧光等光谱成像技术都有检测葡萄霜霉病的潜力, 可见光图像简便快速, 但局限于肉眼可见病害的检测; 高光谱成像技术能同时检测到叶片表面和内部信息, 但设备复杂昂贵; 热红外图像技术受环境影响较大, 检测植物病害时需要严格控制环境温湿度。 荧光成像技术能实现病症出现前的潜育期检测[2, 3, 4], 对霜霉病早期检测更具优势。
受到病害侵染时, 植物的防御反应会产生抑制病菌的次生代谢产物, 多光谱荧光成像技术(multicolor fluorescence imaging, MFI)用固定波长的紫外光照射植物激发出荧光, 在荧光发射光谱有多个特征性波峰, 可以灵敏地反映植物次生代谢水平、 防御机制响应和叶绿素含量的变化, 从而便捷的检测植物胁迫状态。 Pineda M和Pé rez Bueno[5, 6, 7]等用MFI对受软腐病侵染的西葫芦和甜瓜叶片、 感染根腐病的向日葵幼苗成功进行了早期检测。 Yao[8]等用MFI和叶绿素荧光成像结合机器学习技术对受干旱胁迫3天和7天的拟南芥植株与对照植株的分类准确率分别为93.3%和99.1%。 Lei[9]等研发了叶片农药残留快速检测MFI系统, 在190~300 nm的紫外光激励下, 有机磷农药氧乐果污染叶片在440 nm的荧光发射光谱峰值与农药浓度具有良好的线性关系。 虽然MFI进行植物胁迫早期检测研究取得了一些成果, 但目前基于MFI进行葡萄霜霉病早期检测研究的报道很少。
为及时准确的对葡萄霜霉病侵染进行早期检测, 以“ 赤霞珠” 品种葡萄全叶片为研究对象, 研究基于MFI的葡萄霜霉病早期检测方法。 通过分析接种和健康叶片连续6天背面多光谱荧光图像, 试图揭示从接种到显症连续多天荧光波段的动态变化规律, 探明多光谱荧光参数对霜霉病早期检测的敏感程度和可靠性; 通过选出的多光谱荧光特征参数构建基于SVM(support vector machine, SVM)的多光谱荧光葡萄霜霉病早期检测模型, 为实现霜霉病症前早期检测提供依据。
2019年1月将20株一年生“ 赤霞珠” 葡萄幼苗移植在花盆中, 在温度为25 ℃温室中培养。 如图1(a, b, c)所示, 接种实验分为如下3个步骤:
(1)制备健康叶片。 摘取每个枝条上4~6节叶龄、 大小相近的健康叶片, 在实验室消毒后置于用滤纸保湿的培养皿中备用。
(2)接种霜霉菌。 按照霜霉病离体接种的方法[10], 将制好的孢子悬浮液(孢子浓度为5× 105个· mL-1)均匀喷施于选取的健康叶片背面, 同样数量的健康叶片喷等量无菌水作为对照。
(3)隔离培养。 装有健康和接种叶片的培养皿放置于同一个气候箱的不同层。 气候箱温度为18 ℃, 相对湿度为80%, 光照为18 000 Lx, 8 h黑暗, 16 h光照, 模拟自然光照节律[10]。
以上试验一共成功接种了145片葡萄叶片, 同时有145片健康叶片对照。
本研究采用的FluorCam FC800-O(Photon Systems Instruments公司)MFI系统由四个LED光源板、 支架、 控制单元及FluorCam成像分析软件组成(图2)。 成像面积为20 cm× 20 cm, 镜头到样本的距离为25 cm。 通过预试验对系统运行参数进行了设置, 多光谱荧光图像分辨率选择696× 520, 紫外光强100, 敏感度6%, 曝光时间为100 ms。 为消除外部光线干扰, 成像区域用黑布遮盖。
 | 图2 FluorCam FC800-O开放式荧光成像系统 (a): 设备外观; (b): 软件界面Fig.2 Open fluorescence imaging system of FluorCam FC800-O (a): Equipment appearance; (b): Software interface |
每天18:00— 22:00对所有试验叶片进行一次多光谱荧光成像, 采集290个叶片每个叶片16个荧光参数图像, 直到6DPI叶片出现肉眼可见霜霉层。 采集时首先对待测叶片暗适应20 min, 用吸水纸吸去叶片表面水分, 分别将健康和接种叶片逐一放入成像区域中央, 用338 nm的紫外光对葡萄叶片激发, 产生具有4个特征性波峰的荧光发射光谱, 通过转换四个滤波片获取这四个波段的荧光图像: 蓝光440 nm(F440)、 绿光520 nm(F520)、 红光690 nm(F690)和远红光740 nm(F740)。 同时系统自动获取了四个波段两两比值的12个荧光参数图像[图2(b)]。 用显微镜观察并拍摄叶片局部显微图像, 记录叶片发病状况。 最后将叶片放回培养皿, 喷无菌水保湿, 封口胶缠绕后继续培养。
用系统自带的Fluorcam软件进行图像和数据预处理: 设定假彩色图像的颜色模式和标尺, 选择全叶片为感兴趣区域(region of interest, ROI), 进行背景分割, 计算ROI平均光谱强度。 获取了试验叶片连续6天16个荧光参数的图像和荧光强度。 16个荧光参数包括4个单独波段的基础荧光参数F440, F520, F690和F740, 其余12个是基础荧光参数的两两之间的比值F440/F520, F440/F690, F440/F740, F520/F440, F520/F690, F520/F740, F690/F440, F690/F520, F690/F740, F740/F440, F740/F520和F740/F690。
分析对比健康和接种叶片不同DPI下四个荧光波段的图像, 用单因素方差分析评估不同荧光参数的检测霜霉病侵染的能力, 并对16个参数进行Pearson相关性分析, 从中筛选出检测霜霉病侵染的4个特征输入单波段特征阈值分类器和支持向量机模型进行健康和接种叶片的判别。 阈值分类采用最大类间方差法(大津法)分别计算4个优选特征的阈值。 SVM构建最优决策超平面, 使训练数据集中两类样本与该超平面的距离最大化, 具有良好的泛化能力, 特别适合于二分类小样本问题。 数据集为获取的290个叶片连续6天多光谱荧光16个参数值。 所有接种样本设置标签为“ 1” , 健康样本标签为“ 0” , 交叉验证取平均以增强分类器的准确率和鲁棒性[11]。 单因素方差分析、 阈值分类和相关性分析在matlab R2016a环境下完成, SVM模型用matlab R2016a神将网络工具箱和libsvm3.23matlab工具箱编程实现。
接种霜霉菌后每天用显微镜(OLYMPUS CX31)观察并拍摄霜霉病发展过程(图3), 发现1DPI— 3DPI叶片上没有病症, 从4DPI开始在最早显症的叶片区域出现菌丝和孢子囊[图3(b)], 直到6DPI叶片上布满霜霉层[图3(d)]。 健康叶片在整个试验周期内均保持鲜绿。
根据叶片发病症状和位置, 图4对比了病斑RGB图像和多光谱荧光图像, 发现在6DPI才显症的病斑妮在叶片2DPI的荧光图像中凸显: 在2DPI的F440和F520图像中, 红色高亮区域与6DPI显症病斑位置高度吻合, F690和F740图像中, 病斑区域与周围区域差异不明显。
 | 图4 病斑RGB图像和2DPI多光谱荧光图像Fig.4 RGB Images and MFI multicolor fluorescence images at 2dpi in lesion area |
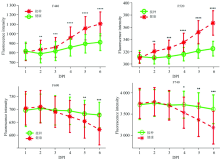
考察病斑区域的基础上, 分析连续多天健康和接病叶片在多光谱荧光各波段下的图像变化(如图5所示)随着DPI增加, 对于接种叶片, F440和F520图像逐渐从深蓝变向黄绿(荧光强度变大)。 而F690和F740则与之相反, 从黄绿变向浅蓝(荧光强度变小)。 F440和F520比F690和F740的变化更快速、 更显著。 健康叶片各波段图像随DPI增加变化则很小。
 | 图5 健康和接种葡萄叶片四个荧光波段连续6天图像Fig.5 Images of P. viticola infected and CK grape leaves at consequtive 6 DPIs evaluated with four wavelengths |
从病斑区域和全叶片连续6天的多光谱荧光图像变化可以看出: 霜霉病的侵染会导致F440和F520升高, F690和F740降低, F440和F520波段2DPI图像能准确确定6DPI肉眼可见的病斑位置, 健康和接种叶片荧光图像随DPI增加差异显著。
通过单因素方差分析能评估荧光参数对霜霉病侵染的敏感性。 4个多光谱荧光波段均值随DPI的变化和单因素方差分析表明(图6), 随着DPI增加, 接种叶片蓝绿荧光(F440与F520)均快速升高, 在2DPI接种叶片F520和F440显著高于健康叶片(p< 0.01), 并随着接种天数的增加显著性不断增强(p< 0.001)。 接种叶片红色荧光(F690)和远红荧光(F740)均随着DPI增加缓慢降低, 1DPI— 3DPI在F690和F740波段接种和健康叶片无显著差异, 从4DPI开始差异显著(p< 0.05), 5DPI— 6DPI差异迅速增加(p< 0.01)。 表明F740和F690能检测到霜霉病侵染, 但没有F440和F520波段敏感。
Oerke[12]等用高光谱成像方法能在葡萄叶背面出现霜霉菌孢子前1~2 d发现反射光谱的变化, 本研究在2DPI(叶背面出现孢子前4天)检测出健康和接种叶片多光谱荧光图像和荧光光谱强度的显著差异(p< 0.001), 比文献研究结果提前了2天, 而且本研究所用“ 赤霞珠” 品种相比文献使用的品种“ 米勒” 对霜霉病更具抗性, 更不易感染。 说明MFI比高光谱成像技术对霜霉病早期侵染更敏感, 能更早发现病害。 同时MFI技术采用固定波长的LED作为激发光源, 用滤波片提取病害敏感荧光波段就可以实现霜霉病早期检测, 比高光谱成像技术方法简便, 成本低廉。
变异系数等于标准差与平均值之比, 用来比较数据的离散程度, 能够消除不同测量尺度的影响, 反映各个波段数据的测量稳定性。 随DPI变化, 接种组F520波段的变异系数在2%~5%之间, F440的变异系数在11%~14%之间, F690的变异系数在7%~10%之间, F740的变异系数在8%~11%之间。 F520的变异系数最小, F440的变异系数最大。 试验过程发现F440极易受外界光线、 叶片表面不一致的影响, 而F520波段更稳定, 与变异系数的结果一致。
分析四个单独荧光波段变化的原因: F440和F520由表皮及叶肉细胞壁和叶脉发出, 与次生代谢产物密切相关, 许多是与植物防御有关的酚类物质。 霜霉病侵染葡萄叶片产生的羟基苯丙烯酸、 二苯乙烯类抗毒素等次生代谢产物不断累积造成叶片接种霜霉病后F440和F520快速升高[13]; F690和F740由叶绿素a发出的, 称为叶绿素荧光, F690和F740波段荧光强度与叶绿素含量正相关, 霜霉病侵染使叶绿素逐渐被降解, F690和F740减小, 但在霜霉病刚侵染时叶片的叶绿素含量变化较小, 接种叶片F690和F740在1DPI— 3DPI变化不大, 与健康叶片差异不显著, 随着侵染的深入, F690和F740快速降低, 从4DPI开始与健康叶片差异显著。 由方差分析发现4个独立波段之间的比值也有不同的检测霜霉病侵染的能力。
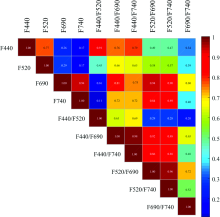
从多光谱荧光四个波段图像随DPI的变化和方差分析曲线可以看出F440和F520, F690和F740变化趋势一致。 说明不同荧光参数之间存在较强的相关性。 因此对叶片的16个多光谱荧光参数进行相关性分析, 其Spearman相关系数如图7所示。 可以看出各荧光参数间存在不同程度的相关性, 表明这些荧光参数包含了不同类型的信息, 但同时也存在重复性, 因此需要对这些参数进行筛选。 分析发现F690和F740, F440和F440/520, F440/740, F440/F690, F520/740和F520/F690两两之间相关系数均大于0.85, 属于极强相关; F440与F520, F690与F440/740相关系数均大于0.75为强相关。 根据方差分析获得的不同参数对霜霉病侵染的敏感性强弱和相关分析结果, 并通过模型准确率验证, 筛选出F520, F690, F440/740, F690/F740四个特征作为SVM的输入。
虽然根据多光谱荧光图像能够直观地对健康和感染霜霉病叶片做出评估, 但很难用量化分析方法准确判别健康和染病叶片。 本研究将优选的4个荧光参数输入SVM模型对健康和染病叶片进行检测, 并与单波段特征阈值检测方法进行对比。 数据集为290个葡萄叶片(145片接种, 145片健康对照)连续6 d的多光谱荧光光谱强度数据, 从中取出200个(健康和接种各100个)叶片连续6 d的数据作为训练集, 每天剩余90个作为测试集(健康和接种各45片)。 用大津法分别计算4个优选波段特征F520, F690, F440/740和F690/F740的阈值分别为315, 685, 0.22和0.187。 经过多次试验, SVM模型选择高斯核函数(t=2), 10折交叉验证, 核函数的系数g和为惩罚因子系数c分别为2和1。 表1给出了单一特征阈值检测和4个特征融合的SVM模型检测的结果。 在霜霉病侵染初期检测准确率不高, 随着DPI增加, 叶片被侵染程度加深, 检测准确率逐渐提高, 四个优选参数阈值检测1DPI的准确率分别为61.1%, 48.9%, 54.4%和54.4%, 3DPI的准确率分别为78.9%, 63.3%, 76.7%和70.0%, 6DPI的准确率分别为100.0%, 82.3%, 93.3%和87.8%, 整个试验周期(1DPI— 6DPI)平均分别为80.0%, 66.3%, 75.9%和70.6%。 F520对霜霉病侵染敏感, 且变异系数最小, 单独波段特征中F520的阈值检测效果最好。 SVM模型4个特征融合的SVM模型连续6天检测的准确率分别为65.6%(1DPI), 76.7%(2DPI), 82.2%(3DPI), 88.9%(4DPI), 94.4%(5DPI)和100.0%(6DPI), 整个试验周期(1DPI— 6DPI)平均为84.6%, 均高于单波段阈值检测方法, 这是由于叶片差异、 侵染程度不一致、 叶片表面曲率变化和环境光干扰等因素影响, 多光谱荧光参数方差大, 导致单波段阈值检测准确率不高; 四个优选参数同时输入到SVM模型中, 能综合多个参数的检测能力, 并通过用大量典型样本数据训练, 消除各类噪声的影响, 从而获得了更优的检测效果。
| 表1 单特征阈值和多特征融合SVM模型的健康和染病叶片检测结果 Table 1 Evaluation results of healthy (CK) and diseased leaves based on single feature threshold and multi-feature fusion SVM model |
考察分类错误的样本, 发现有两种检测错误类型: 第一, 接种叶片发病轻微, 导致接种和健康对照叶片荧光图像在霜霉层出现前没有显著差异, 易将接种叶片误分类为健康叶片。 如图8所示, 接种叶片只有零星部位出现霜霉层(A1, A2), 而发病严重叶片布满霜霉层(B1, B2); 第二, 检测过程中遮挡不严, 外部光线从缝隙进入成像区域, 使各波段荧光图像发生改变, 出现检测错误。 如图9所示, 外部干扰光线从右下方射入, 使叶片各波段荧光图像右下部均出现高亮, 其中F440受外部光线影响最大, F520受影响最小。
霜霉病对葡萄危害严重, 对其进行早期检测与防治, 可提高葡萄品质和产量。 利用MFI技术结合SVM方法进行了葡萄霜霉病早期检测方法研究。 结果表明利用MFI能在接种后2天(肉眼可见症状前4天)检测出霜霉病侵染, 四个单独荧光波段中F520最稳定, 检测效果最好, 融合四个优选特征的SVM模型显症前3天(3DPI)检测的准确率达82.2%, 全试验周期(6 d)的平均准确率为84.6%, 为便携式葡萄霜霉病的早期诊断设备的开发提供了理论依据。 后续研究可将多个葡萄品种作为研究对象, 建立适用范围更广的多光谱荧光葡萄霜霉病早期检测模型, 同时需要检测葡萄叶片内部的次生代谢产物, 研究多光谱荧光早期检测葡萄霜霉病的机理。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|