作者简介: 金 枝, 1987年生, 中国林业科学研究院木材工业研究所助理研究员 e-mail: 13661011605@163.com
倾斜阔叶木枝干弯曲部位的上端在拉伸应力影响下通常会形成受拉木。 区别于受拉伸部位下方的对应木, 受拉木细胞壁通常会出现理化特性变异的现象, 主要归因于细胞次生壁内侧胶质层的形成。 采用透射电子显微成像技术揭示了黑杨受拉木与对应木纤维细胞壁分层结构特点, 并借助532 nm共聚焦显微拉曼光谱成像(空间分辨率约为0.5 μm)及图像叠加技术在原位状态对比了受拉木与对应木纤维细胞壁主要组分分布规律、 分布相关性以及细胞壁水平的孔隙分布特点。 通过纤维素、 半纤维素及木质素—CH非对称伸缩振动(2 942 cm-1)特征峰峰面积积分成像成功地区分出受拉木与对应木纤维细胞壁各个亚层。 在此基础上采用数据归一化处理实现平均拉曼光谱中纤维素(1 094 cm-1)与木质素(1 598 cm-1)、 木聚糖(904 cm-1)与木质素(1 598 cm-1)特征峰成像叠加, 结果表明相比于临近的次生壁及胞间层, 受拉木胶质层含有更高浓度的纤维素; 与对应木相比, 受拉木纤维素和木聚糖浓度在整个细胞壁形态区域呈增强趋势, 木质素浓度在次生壁区域有所增强。 相邻细胞壁线扫描分析结果表明沿着细胞腔向复合胞间层区域过渡时纤维素、 木质素及木聚糖的浓度均呈现明显的区域选择性及梯度变化规律。 特征峰积分成像得出受拉木胶质层孔隙结构最为丰富, 但其次生壁及胞间层区域孔隙分布程度较对应木低。 以上研究结果有助于深化对受拉木特殊理化特性及形成机制的理解, 同时拓展了显微拉曼光谱技术在植物细胞壁孔隙结构研究领域的应用。
Tension wood is produced on the upper sides of the inclined trunk or branch of hardwood when its orientation is shifted from the vertical. Unlike the opposite wood formed on the lower sides, tension wood fiber is characterized by the presence of a specific layer, called the gelatinous layer which displays various physical and chemical properties. In this study, TEM imaging was used to reveal the variation in the cell wall layering structure between the Populus nigra tension wood and opposite wood. Furthermore, confocal Raman microscopy with 532 nm exciting laser (spatial resolution is about 0.5 μm) was used to visualize the variation in the distribution of fiber wall components and porosity between tension wood and opposite wood, meanwhile the topochemical correlation was innovatively revealed by Raman overlaid image. When integrating over the Raman band at 2 942 cm-1 (Cellulose, hemicelluloses and lignin C—H stretching vibration), the sublayers of tension wood and opposite wood were successfully distinguished. By integrating over the band at 1 094, 1 598 and 904 cm-1in the normalized average Raman spectra, the distribution of cellulose, lignin and xylan was visualized. Lignin-cellulose and lignin-xylan overlaid Raman images displayed that for the tension wood cellulose mainly existed in the gelatinous layer, and the concentration of cellulose and xylan within the cell wall regions was higher than that of opposite wood. Specifically, the secondary wall of tension wood had an increased lignin concentration. Double-wall line scan showed that the distribution of lignin, cellulose and xylan was highly regional dependence and displayed gradient changes along the adjacent cell wall. Moreover, line scan analysis revealed the variation in D2O concentration along the adjacent fiber secondary wall and confirmed the more abundant porosity distribution of the gelatinous layer compared with secondary wall and middle lamella. The above results are helpful to understand the forming mechanism of unique physical and chemical properties of tension wood and expand the application of micro Raman-spectroscopy technology in the field of plant cell wall pore structure research.
受拉木是指阔叶木发生倾斜、 弯曲和偏冠时, 树干和枝条上方受拉伸应力部位的木质部[1], 在天然阔叶林和杨树(Populus sp.)、 桉树(Eucalyptus sp.)等人工速生林中均有存在。 与正常木相比, 受拉木在微观结构和力学性能方面存在一定差异。 在微观结构方面, 受拉木中形成的具有特殊形态和化学组成的胶质层被认为是造成受拉木与正常木之间力学性能差异的主要原因。 受拉木的纵向硬度高达35 GPa, 明显高于正常木(平均为18 GPa), 而弦向和径向硬度较低, 分别为430和1 150 MPa, 该数值在正常木中分别达到530和1 500 MPa[2]。 此外, 胶质层产生的高拉伸应力及纵向干缩率[3]会降低木材的加工性能, 例如在干燥过程中出现的翘曲和开裂, 以及在切削过程中引起的夹锯和板面起毛等缺陷严重降低了木材的利用效率。
鉴于受拉木胶质层独特的壁层构造及其对木材相关性能的影响, 研究者们针对胶质层的化学组成、 解剖结构和孔隙结构等开展了一系列研究。 胶质层形成于纤维细胞次生壁内侧, 其化学组分主要包含纤维素[4], 木聚糖[5], 阿拉伯半乳聚糖和RG-I型果胶[6]等。 其中, 胶质层纤维素作为“ 骨架” 物质, 形成高定向和高结晶形态的微纤丝近乎平行于细胞主轴排列[7], 微纤丝之间和微纤丝非结晶区存在的纳米级孔隙赋予了胶质层丰富的孔隙结构[8, 9, 10]。 然而, 现有研究针对胶质层与细胞壁其他各层级化学组分浓度梯度变化、 分布相关性及孔隙分布差异鲜有报道, 本研究拟采用高空间分辨率的共聚焦显微拉曼光谱技术, 通过原位成像及图像叠加对黑杨受拉木与对应木各层级区域化学及相关性进行直观的比较研究, 特征峰积分原位成像揭示各层级孔隙分布差异, 从而深化对受拉木特殊理化特性及形成机制的理解, 为提升应力木加工质量、 实现木材高值高效利用提供理论依据。
十年生倾斜生长的黑杨(Populus nigra)采自西北农林科技大学植物园, 树高16 m、 胸径14.5 cm, 枝下高7.3 m。 在距基部5 m处茎部倾斜部分的上端及下端分别截取受拉木及对应木木块(15 mm× 5 mm× 10 mm)。 蒸馏水反复冲洗后, 利用滑走切片机(Leica RM2010R, Germany)切取厚度为20 μ m的样品横切面备用, 切片时所使用的刀片为Leica 810。
利用单面刀片将受拉木与对应木样品块切成火柴棒大小, 经梯度丙酮逐级脱水, 进行低黏度Spur树脂浸渍、 包埋及固化。 采用超薄切片机(Leica EM-UC6)连续切取90 nm的超薄切片, 然后置于过滤后的1%(w/v)高锰酸钾水溶液染色1 min, 蒸馏水反复冲洗, 自然晾干后在JEM-1230(JEOL)透射电子显微镜下进行显微成像, 成像时加速电压为80 kV。
将获取的20 μ m厚横切面切片置于载玻片上自然晾干后, 采用重水(D2O)(原子百分比99.9%, Sigma-Aldrich)预浸渍1 h后, 盖薄片封片, 采用共聚焦显微拉曼光谱仪(LabRamXplora, Horiba Jobin Yvon)进行光谱采集。 激发波长532 nm, 到达样品的激光功率为8 mW。 测试时光栅为300 mm-1, 狭缝宽度为100 μ m, 扫描步距为0.5 μ m, 单点光谱采集时间为1.5 s, 光谱测定范围为3 100~300 cm-1, 光谱分辨率为2 cm-1。 光谱采集时采用100倍油镜(Plan N 100× , Oil, NA=1.0), 获得的数据利用LabSpec6软件采用线性偏最小二乘法进行批量矩阵成像数据基线校正后归一化处理, 进而实现特征峰峰面积成像叠加。
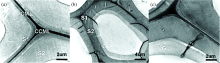
对比对应木[图1(a)]与受拉木[图1(b, c)]TEM图像发现两者的纤维细胞壁分层结构存在明显差异, 主要体现在次生壁的亚层组成及厚度差异。 与对应木次生壁三亚层结构(外层S1(0.5~1.0 μ m), 中层S2(3.0~5.0 μ m), 内层S3(0.05 ~0.12 μ m))不同, 受拉木的纤维次生壁仅分为S1(0.2~0.5 μ m)及S2(2.0~3.5 μ m)且厚度较小, 在其次生壁S2内侧还含有电子密度较低的胶质层(gelatinous layer, GL), 该层厚度约为1.2~2.5 μ m。 以上差异反映出受拉木纤维细胞因抵抗拉伸应力而产生的形变。
本研究中所使用的显微拉曼光谱仪的空间分辨率约为0.5 μ m, 在受拉木细胞角隅胞间层, 次生壁以及胶质层能够准确地抽取相应区域的平均拉曼光谱(图2), 涉及特征峰主要出现在2 942 cm-1(纤维素、 半纤维素及木质素— CH非对称伸缩振动), 2 897 cm-1(碳水化合物— CH, — CH2伸缩振动), 2 476 cm-1(O— D伸缩振动), 1 598 cm-1(木质素芳香环对称伸缩振动), 1 094 cm-1(纤维素C-O-C非对称伸缩振动), 904 cm-1(木聚糖)等波数区[11, 12, 13]。
2.3.1 细胞壁形态及主要组分分布相关性
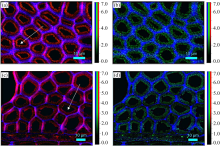
通过对2 942 cm-1纤维素、 半纤维素及木质素— CH非对称伸缩振动特征峰进行积分, 获得的拉曼光谱成像图中受拉木[图3(a)]与对应木[图3(b)]纤维细胞角隅胞间层(CCML)、 复合胞间层(CML)、 次生壁(S)及受拉木中特有的胶质层(GL)区域清晰可见, 且受拉木部分纤维细胞的细胞腔区域发生了明显的形变[图3(a)中三角形所示细胞]。
作为阔叶木细胞壁中的主要组成成分, 纤维素构建了细胞壁的“ 骨架” , 半纤维素及木质素分别构成了细胞壁的基体物质和结壳物质, 并填充于纤维素“ 骨架” 之中。 本研究分别对三大主要组分进行特征峰1 094 cm-1(纤维素)、 1 598 cm-1(木质素)、 904 cm-1(半纤维素木聚糖)峰面积积分成像, 并进行两两相互叠加探索其空间分布相关性。 叠加的木质素与纤维素, 木质素与木聚糖的显微拉曼光谱成像图表明三大组分在受拉木和对应木细胞壁不同形态区域中均有分布, 但各组分之间的分布相关性存在一定差异。 受拉木胶质层沉积了高浓度的纤维素(红)并存在一定浓度分布较均一的木聚糖(绿)。 在次生壁区域, 纤维素在受拉木每对应木中呈现均一分布但浓度明显低于胶质层; 木聚糖在受拉木次生壁中分布浓度普遍高于对应木, 且在次生壁临近胞间层一侧及胞间层中更为集中; 木质素仅在受拉木紧邻胞间层的次生壁区域呈现一定浓度分布, 这可能是细胞壁通过木质素的沉积从而增加刚度以抵抗外界拉伸应力而导致的。 在胞间层区域, 受拉木和对应木的主要成分均为木聚糖和木质素, 其中, 木聚糖在受拉木中的分布浓度普遍高于对应木, 而木质素在两者细胞角隅胞间层浓度最高。 受拉木和对应木不同形态区域三大组分浓度差异详见表1。 可以看出, 受拉木在形成过程中对纤维素与木聚糖的分布浓度产生了较大的影响, 在整个细胞壁形态区域中, 两者较对应木均呈现增强的趋势, 这可能与拉伸应力作用下纤维细胞壁中纤维素和半纤维素等链状分子的形变与分子间距的缩小而导致的单位面积内分子浓度增加有关。
 | 图3 受拉木(a)与对应木(b)纤维细胞形态拉曼光谱成像Fig.3 Raman images showing the cell wall morphology of tension wood (a) and opposite wood (b) |
| 表1 受拉木和对应木不同形态区域三大组分浓度差异 Table 1 The variation in the components concentration within the morphologically distinct cell wall of tension wood and opposite wood |
2.3.2 相邻细胞壁线扫描分析
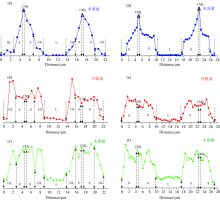
为了揭示受拉木与对应木纤维细胞壁主要组分沿各自相邻细胞壁的浓度梯度变化规律, 本研究针对木质素芳香环伸缩振动(1 598 cm-1)、 纤维素C— O— C非对称振动(1 094 cm-1)和木聚糖C— O— C(904 cm-1)进行相邻细胞壁线扫描(图5), 所提取的线扫描区域如图4(a)和(c)中所示虚线区域。 从图中可以看出沿着细胞腔向复合胞间层区域过渡时, 受拉木与对应木木质素、 纤维素和木聚糖浓度均呈现明显的区域选择性及梯度变化规律, 与表1结果一致。 在细胞壁沿胶质层向复合胞间层方向, 受拉木纤维素浓度呈下降趋势, 木质素和木聚糖浓度呈上升趋势; 在细胞壁沿次生壁向复合胞间层方向, 对应木纤维素浓度呈下降趋势, 木质素浓度呈上升趋势, 木聚糖浓度变化趋势不明显。
2.3.3 受拉木与对应木细胞壁孔隙分布
木材细胞壁孔隙测定的传统方法主要借助气体的吸附脱附法, 其获得的研究结果通常为样品孔隙的平均信息[3, 9, 14], 未能在更为微观的细胞壁乃至细胞壁亚层角度揭示受拉木与对应木的孔隙分布差异性。 针对传统研究的不足, 本研究采用D2O预浸渍的组织切片结合原位高空间分辨显微拉曼成像对受拉木细胞壁各层中的D2O浓度分布规律进行研究, 分别对受拉木与对应木中D2O特征峰2 476 cm-1峰面积积分成像(图6)。 图中黄色区域为细胞腔空腔区域, 其高浓度的D2O分布在一定程度上证实了该方法用于表征纤维细胞孔隙结构的适用性。 同时可以看出, 沿细胞腔经过胶质层向复合胞间层区域过渡时, 受拉木和对应木中D2O的浓度均呈现逐渐降低的梯度变化规律, 且前者更为明显。 在受拉木中, 胶质层D2O浓度明显高于次生壁及胞间层, 表明了胶质层的孔隙结构分布密集, 而对应木中的D2O在次生壁及胞间层均有较高浓度的分布且明显高于受拉木相应区域。 以上发现证实了受拉木孔隙主要来源于胶质层[9]。 同时可以推断, 由于拉伸应力的作用受拉木次生壁及胞间层孔隙结构发生一定程度的压缩, 而胶质层由于一侧紧邻细胞腔而大大减弱所受的外力作用从而利于多孔结构的生成。
采用高空间分辨显微拉曼光谱成像与叠加技术对比研究了黑杨受拉木与对应木中纤维细胞壁主要组分微区分布差异性及相关性, 通过引入D2O成功探索了受拉木与对应木纤维细胞壁不同形态区域中的孔隙分布差异。 纤维素、 木质素和木聚糖在受拉木与对应木的细胞壁形态区域中均存在不同程度的分布, 且沿着细胞腔向复合胞间层区域过渡时三者浓度均呈现明显的区域选择性及梯度变化规律。 与对应木相比, 胶质层主要成分纤维素呈现高浓度分布, 受拉木纤维素和木聚糖分布浓度在整个细胞壁形态区域呈增强趋势, 木质素分布浓度在次生壁区域有所增强; 受拉木胶质层孔隙分布密集但其次生壁及胞间层孔隙分布程度较低。 尽管D2O拉曼光谱成像图中的浓度梯度变化能够间接地反映出细胞壁各层孔隙分布的差异, 但该方法在细胞壁水平可视化、 定量研究孔隙分布及结构特点方面仍需进行更深入更完善的研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|