作者简介: 刘雪梅, 女, 1995年生, 山东农业大学化学与材料科学学院硕士研究生 e-mail: 2018110540@sdau.edu.cn
人体内的生物小分子对维持生命体健康具有重要影响, 此类分子参与生命体的血液循环及免疫系统, 因此检测生命体中生物小分子对研究小分子在生命体中的生理功能有着重要的意义。 傅里叶变换-表面等离子体共振(Fourier transform-surface plasmon resonance, FT-SPR)光谱技术具有操作简便、 灵敏度高、 所需样品少、 可实时检测等优点, 近年越来越多应用于分子的检测。 对于部分分子尤其是分子量非常小的生物小分子, FT-SPR直接检测法存在信号稳定性差、 灵敏度不高等缺点, 因此可以针对不同的检测目标构建系列SPR小分子生物传感器通过信号扩增弥补以上缺点。 该研究分类并列举了用于小分子检测的SPR免疫传感器(直接检测法、 “三明治”法、 竞争检测法以及抑制检测法)、 SPR分子印迹传感器以及其他基于SPR传感器, 系统综述了SPR技术检测小分子的研究进展, 并对其发展远景进行了展望。
Small biomolecules in the human body have important effects on the health of the living body. Some of them are involved in the blood circulation and immune system of the living body Therefore, the detection of small molecules in living organisms in the study of small molecules in the physiological function of life is of great significance. Fourier Transform Surface Plasmon Resonance (FT-SPR) spectroscopy has been widely used in molecular detection in recent years due to its advantages of simple operation, high sensitivity, few samples required and real-time detection But for different molecules, especially those with very small molecular weight, FT-SPR direct detection has some disadvantages, such as unstable signal and low sensitivity. Therefore, a series of SPR small molecule sensors can be constructed for different detection targets to remedy the above shortcomings. In this paper, the research progress in the detection of small molecules by SPR technology is reviewed from the aspects of immunosensor (direct detection, Sandwich detection, competitive detection and inhibition detection), SPR molecular imprinting sensor and other SPR based sensors. The prospect of its development is also given.
广义上定义小分子为分子量不大于500的分子[1], 但关于小分子一直都没有比较科学和确定的定义, 如在化学方面, 即分子量很小的天然化合物; 在生物方面, 小分子是具有生物学意义的一类物质。 由以上定义可知, 人体中存在着无数小分子, 其对维持生命体健康有着重要的意义[2]。
在生物体中, 小分子物质具有非常小的分子量, 某些小分子具有一定的生物活性, 例如激素[3, 4]。 同时, 伴随着社会经济的发展, 环境和食品安全都已经成为社会严峻的挑战。 在环境检测中, 特殊小分子的检测正成为环境及食品安全检测的重要指标[5]。 目前检测小分子的传统技术有色谱法、 光谱法等, 传统的技术方法通常存在以下缺点: 样品处理周期长﹑检测仪器昂贵、 不能实时快速检测[6]。 而部分光谱分析法, 未能对分子间的相互作用及其作用动力学参数进行有效的采集。 表面等离子体共振技术(SPR)具有灵敏度高、 所需试样少、 能够实时检测等优点, 可以实现小分子的准确快速检测, 弥补传统检测方法的缺点。 目前基于SPR技术的小分子检测技术的研究报道比较少, 本文系统的综述了表面等离子体共振技术对小分子检测的研究进展, 并对其发展前景进行了展望。
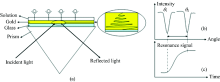
由于SPR具有灵敏度高、 所需试样少、 能够实时检测等优点, 越来越引起分析学者的重视。 目前SPR技术已经应用于生物学、 化学等不同领域, 并随着技术的发展不断改进[7]。 在实际应用方面, SPR技术通常用于检测蛋白质与蛋白质之间、 抗原抗体之间、 受体与配体之间的相互作用[8], 其检测的原理如图1(a)所示, 当入射光线从光密介质照射到光疏介质时会发生光的反射与折射, 当入射角达到一定角度时, 折射角成90° , 折射在界面会发生全反射现象, 即所有能量转移到反射光线上。 因为入射光线是先移动半个波长才发生的反射进入光密介质, 同时在光疏介质产生的振幅随着与界面距离的增加而呈指数形式衰减的消逝波[9][如图1(b)所示]。 因为消逝波的强度与渗透距离成反比, 所以SPR的渗透距离一般约为几百纳米[8]。 SPR用于分子相互作用检测机理研究选用一对相互作用的分子, 其中一种分子连接在芯片上, 另一种分子流经SPR芯片的表面, 若两种分子发生相互作用, 则溶液中的分子会结合在芯片表面, 使界面厚度发生改变, 从而引起折射率的改变, 进而引起SPR谱线的变化[如图1(c)所示]。 因此利用SPR传感技术可以很好地应用于小分子的检测以及分子与分子之间相互作用机理的研究。 本文将从SPR免疫传感器(直接检测法、 “ 三明治” 法、 竞争检测法以及抑制检测法), 分子印迹SPR传感器以及其他基于SPR技术的传感器三个框架入手, 系统的综述SPR技术应用于小分子检测的研究进展。
SPR免疫传感器主要包含四种方法, 分别为直接检测法、 “ 三明治” 法、 抑制型以及竞争型[10], SPR免疫传感器主要利用了抗原抗体的结合, 通过信号的变化来检测待测物浓度。 检测原理如图2(a, b, c, d)所示。
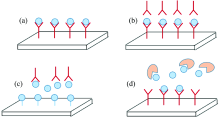 | 图2 (a) 直接检测法原理图, (b) “ 三明治” 法原理图, (c) 免疫抑制法原理图, (d) 免疫竞争法原理图Fig.2 (a) Direct detection method image, (b) Sandwich method image, (c) immunosuppression image, (d) competitive immunoassay image |
2.1.1 直接检测法
直接检测法是直接检测目标抗原与抗体的结合能力, 通过信号变化得出待测物浓度, 这种方法简单快捷[11], 直接检测法一般用于大分子的检测。 由于检测小分子时SPR响应信号弱, 限制了SPR仪器的灵敏度, 甚至部分小分子检测时未能达到仪器检测限[12], 最近几年, 研究人员通过方法的改进实现了直接检测小分子。
Wang等[12]利用典型的四环素小分子, 制备出抗四环素适配体(具有更好的亲和力), 从而提高了灵敏度, 达到了直接检测的目的; Abdullah S等[13]利用金纳米颗粒(AuNPs)修饰的SPR生物传感芯片上接生物聚合物卡拉胶(κ Carr), AuNPs-κ Carr能够提供检测Pb(II)离子的活性位点, 实现对Pb(Ⅱ )离子的检测, 且有较高的灵敏度(1.3535× 10-6 nm), 线性响应为R2=0.972 2; Dong等[14]将对磺化亚硝基芳烃(PSC4)作为百草枯(PQ)的识别分子, 由于PQ可以诱导PSC4-AuNPs的聚集, 在SPR芯片上形成分析物诱导网状结构, 显著提高了检测的灵敏度, 检出限为2.2 pmol· L-1; Yao等[15]利用适配体技术设计了一种无酶SPR传感系统, 并在表面修饰了金纳米颗粒以增强其灵敏度, 用来特异性的检测腺苷, 其检出限低; Shim等[16]利用SPR传感技术用直接检测法测定了几种小分子环肽与人血清蛋白(HSA)的结合常数, 通过对不同肽段检测的实验分析将结构变化与结合常数联系起来; Laia等[17]通过SPR传感器手段检测河豚毒素, 最低检测量0.43 mg· kg-1, 低于规定要求的最高含量2 mg· kg-1; Urusov等[18]使用BSA与赭曲霉素A合成的抗原作为固定相通过生物偶联法固定在纳米金表面, 然后合成凝胶金纳米颗粒, 使用胶体金纳米颗粒结合抗体增敏的SPR传感器检测限为0.06 ng· mL-1; Liu等[22]利用SPR直接检测法定量检测小分子核酸, 通过共振角度的改变可以准确的检测到表面结合位点被覆盖的情况。
综上所述, 虽然小分子直接检测所引起的SPR信号较弱, 但随着技术的改进, 利用直接检测法检测小分子越来越普遍, 例如利用传感器增敏的方式来提高SPR信号。 该方法多利用制备适配体来提高亲和力, 从而增强其灵敏度, 运用制备的纳米金颗粒等增强灵敏度[20]。 此类方法通常利用金纳米材料具有良好的表面等离子体共振效应来实现检测信号的放大, 最终通过信号的增敏实现对目标分析物的检测[21]。
2.1.2 “ 三明治” 法
“ 三明治” 法是通过连接两种抗原最终实现抗体的检测。 此方法检出限及特异性都得到了有效的提高, 通常用来检测不只一种抗原结合位点的物质[22]。 传统的“ 三明治” 法一般用于大分子的检测[23]。 但随着技术的发展, 人们通过技术的改进及增敏材料的引入同样实现了小分子的检测, 且获得了很好的效果。
Melaine等[24]从大量的DNA和RNA中提取出与目标物有亲和力的短寡核苷酸, 通过筛选并设计出对目标物具有亲和性能的适配体并将其切成两部分, 利用“ 三明治” 法对目标物进行检测。 结果发现与原始的单链相比, 这种方法在没有损失亲和力的情况下实现了目标物的检测; Li等[25]设计了一种基于两层氧化石墨烯金纳米颗粒复合材料的多功能增敏SPR生物传感器, 用于检测小分子腺苷和RNA, 实现了双放大策略, 获得检测限为0.1 fmol· L-1短寡核苷酸; Zeidan等[26]通过纳米材料对SPR传感器增敏, 利用夹心法对磷酸缓冲溶液中孕酮的含量进行了测定, 检出限达到了5 nmol· L-1。 Hu等[27]利用氧化石墨烯设计了双重信号放大的传感器, 通过“ 三明治” 法检测聚多巴胺, 检出限低至500 pg· mL-1。
综上所述, 利用“ 三明治” 法检测小分子, 通常适配体的亲和性能以及通过结合纳米材料的增敏作用达到增敏的效果。 查阅文献发现, 通过氧化石墨烯进行增敏的效果尤为明显, 主要由于氧化石墨烯具有表面积大且富含有羟基、 羧基、 环氧基等官能团, 使其具有良好的生物相容性。
2.1.3 抑制型检测法
抑制型检测首先已知抗体的浓度并与待测物混合, 将混合溶液通过已经修饰待测物的传感器芯片, 混合液中未结合的游离抗体会与芯片上的待测物结合, 最终根据检测机理建立检测信号的变化值与待测物的浓度成反比关系, 此方法可以用于小分子物质的检测[28]。 抑制型检测法用来检测小分子具有灵敏度高的优势, 通常可应用于环境监测、 食品检测等领域[29]。
Cao等[30]利用SPR抑制免疫定量测定E2, 使用BSA-E2为偶联物, 通过偶联物的主氨基与琥珀酰亚胺基(NHS)在金表面形成硫醇-NHS单分子层而引入的反应, 固定化到SPR芯片上, 自由E2分子与芯片表面的BSA-E2竞争单克隆抗E2抗体提供的结合位点, 结果表明, 抗体对BSA-E2偶联物的结合亲和力随着BSA-E2偶联物表面覆盖度的降低而增加。 Li等[31]通过利用金纳米颗粒制备传感器, 通过抑制检测法检测缺血修饰白蛋白, 检出限小于5.0 ng· L-1, 与其他方法相比具有检出限低, 操作简便等优点。
2.1.4 竞争型检测法
竞争型检测机理是通过竞争关系来实现目标分析物的检测方法。 其实验流程是将大分子的分子物通过生物偶联的方法共价结合在传感器芯片上, 然后通入待测物质, 让两种物质通过对抗体的竞争来实现的检测方法。 此方法得到的信号变化与待测物浓度成反比, 通常可用小分子物质的检测[32]。 但是将竞争法应用于大分子目标分析物检测时会面临信号变模糊的缺点。
Cao等[33]将一种用于识别的同质结合蛋白质与具有竞争性的叶酸(FA)检测的靶修饰金纳米颗粒(Au NPs)相结合, 通过与功能化Au NPs竞争表面结合位点, 可以定量测定溶液中游离FA, 而且证明, 通过降低FA共轭Au NPs的浓度, 可以将动态范围从微摩尔降低到纳摩尔, 从而将检测限降低到2.9 nmol· L-1; Moon J等[34]将半胱氨酸蛋白G、 黄曲霉毒素B1 (AFB1)以及牛血清蛋白(BSA)修饰于SPR芯片, 然后将样品溶液与AFB1-BSA偶联物按顺序流到Au芯片上, 利用竞争性免疫分析实现对AFB1的检测, 检出限达到2.51 μ g· L-1, 这种方法也可用于食品中霉菌毒素的检测; Luo等[35]用单链DNA适配体和未修饰的AuNPs来修饰传感器, 用小分子竞争性结合引起的AuNPs聚合及其相应的适配体作为检测指标来检测小分子物质, 灵敏度大幅度增加, 并且还可以通过将不同的适配体与AuNPs结合, 很容易地用于其他小分子的检测, 例如氨苄青霉素; Yockell-Lelievre等[36]利用金纳米颗粒和竞争法, 简单地直接比较了SPR和LSPR传感器对睾酮的检测, 发现SPR比较适合于宽范围检测, LSPR比较适合较低浓度下检测; Hirofumi Kawazumi等[37]设计了一种多通道小型SPR传感器并利用间接竞争法同时检测了苯并[a]芘和2-羟基联苯两种物质, 检测灵敏度达到μ g· L-1的水平, 与传统的SPR检测方法相当; Noemí delos-Santosá lvarez等利用SPR作为转导技术通过竞争检测法检测新霉素B, 得到了10 nmol· L-1~100 μ mol· L-1的定量范围, 证明了用高灵敏度适配体检测小分子的可行性[38]。
分子印迹技术又称为分子烙印技术, 其检测原理常被称为“ 钥匙” 和“ 锁” 的关系[39]。 传感器检测原理: 首先利用模板分子制备分子印迹聚合物(MIP), 然后进行洗脱, 即在聚合物上留下特定的“ 空穴” , 相当于“ 锁” 。 而目标分子相当于开这把“ 锁” 的钥匙, 能够与MIP完全匹配, 从而达到检测的目的。 此方法可以有效检测小分子物质, 其检测原理如图3所示。
由于分子印迹法具有良好的特异性, 近几年来利用此方法来实现小分子检测的研究报道较多。 Jun Matsui等[40]在芯片上制备了金纳米颗粒的分子印迹聚合物凝胶, 测定了对多巴胺响应的影响, 发现SPR信号明显增强; Mehmet Lü tfi Yolaa等[41]构建了以丁胺卡那霉素分子印迹聚合物为特异性识别元件的MIP-SPR传感器, 检测人体血浆中抗生素丁胺卡那霉素的含量, 传感器对目标物质的检测限为0.002 5 μ g· mL-1(4.3× 10-9 mol· L-1), 在丁胺卡那霉素浓度为0.01~0.15 μ g· mL-1范围内线性关系良好; Zhang等[42]利用分子印迹法制备了SPR传感器来检测卡那霉素, 卡那霉素印迹传感器线性范围为1.0× 10-7~1.0× 10-5 mol· L-1 (R2=0.994 1), 与非印迹传感器相比, 该传感器对卡那霉素有更好的印迹效果和选择性; 有报道[43]将铁纳米颗粒引入到分子印迹聚合物的合成中, 搭建了MIP-SPR传感器用于尿酸的检测, 传感器在尿酸浓度为0.5~40 μ g· mL-1范围内有良好的线性关系, 检测限为0.247 μ g· mL-1; Jiang等[44]使用旋涂法将引发剂包覆在45 nm的SPR金纳米层表面, 放置在混合溶液中, 65 ℃条件下孵化16 h, 干燥后分子印迹聚合物包覆在金片表面, 制成分子印迹聚合物表面等离子体共振(MIP-SPR)传感器, 作为特异性识别元件来特异性检测组胺, 实验对比了不同浓度比的分子印迹聚合物性能, 发现组胺∶ 甲基丙烯酸(MAA)∶ 乙二醇二甲基丙烯酸酯(EGDM)物质量比为1∶ 2∶ 4时SPR信号响应最大, 并对比了分子印迹聚合物与非分子印记聚合物(NIP), 用来观察特异性, 发现MIP-SPR传感器对组胺检测的SPR信号响应约为NIP-SPR对组胺的5倍, 制备的MIP-SPR传感器检测限为25 ng· mL-1, 在25~1 000 nm· mL-1浓度范围内线性关系良好, 成功完成了组胺的高灵敏度特异性检测; 有报道在光纤未包覆的芯上涂覆一层银膜来制备探针, 然后在光纤芯上进一步涂覆以三聚氰胺为模板分子的分子印迹聚合物(MIP), 产生结合位点, 检测了浓度范围为10-7~10-1 mol· L-1的三聚氰胺, 发现该传感器具有响应速度快和灵敏度高等特点; Tan等[45]在SPR芯片上修饰了对硫磷甲基(PM)印迹聚合膜检测PM, 发现其具有较高的灵敏度, 检出限为10-13 mol· L-1。
除了以上所述的免疫传感法和分子印迹法之外, 人们还用了很多其他的方法来检测小分子物质, 例如Stefan Schmieder等[46]利用一次性、 注塑成型的传感器芯片/微流体混合和横向成像光学系统, 并行分析三个一维斑点阵列, 利用改进后的紧凑型SPR生物传感器平台, 成功地开发一种利用固定在SP芯片上的LNA探针检测miRNA-93的方法, 并对其进行了增敏, 使检出限达到了1 fmol· L-1; Kyaw等[47]设计出一种电场辅助SPR系统, 通过监测信号位移的时间动态, 获得了较高的系统灵敏度。 该方法利用基于离子在水中迁移率的理论模型, 讨论了离子沉积动力学, 在施加适当的力时, 目标离子根据目标溶液的离子浓度、 离子质量和流速堆积到传感器表面, 此方法可以检测到水中目标镉离子(Cd2+)且检测范围很广, 从mg· L-1到μ g· L-1; Patil等[48]利用SPR技术和分子对接技术的联合, 对人体的酪氨酸酶小分子进行了筛选和检测, 研究发现这种方法可用于快速筛选和优化各种先导化合物作为人酪氨酸酶活性的结合剂、 抑制剂和调节剂等; Wang等[49]利用SPR光谱和电化学结合的方法, 通过在SPR金膜上催化金属离子沉积来检测生物小分子, 并以抗坏血酸介导的银在金膜上沉积为例进行了检测, 通过SPR的信号变化反映出金膜上沉积的银原子的量, 而银原子的量又可以反映抗坏血酸的浓度, 抗坏血酸的检测浓度为2× 10-5~1× 10-3 mol· L-1。
| 表1 不同检测方法的检测性能 Table 1 Performance of different detection methods |
小分子检测对于人类的身体健康、 食品安全及生存环境安全都有重要的意义。 目前常规的小分子检测技术如色谱技术、 光谱法等, 都存在自身的缺点。 如色谱技术的样品前处理复杂而且需要根据不同的目标分析物选择不同检测器类型。 而传统的光谱法无法实现对分子之间的相互作用及结合动力学参数的测定。 作为SPR生物传感器在检测小分子时, 由于小分子的分子量较小, 通过SPR生物传感器直接进行检测引起的信号变化非常小, 因此很难通过此方法实现对目标分析物的检测。
针对上述问题, 系统地综述了几种检测小分子的SPR生物传感的器构建、 检测原理及在实际检测中的应用。 通过综述相关文献, 对比其他检测方法, SPR生物传感器具有操作简便, 不需要提前处理样品、 检出限低、 无需标记、 能够实现实时监测等优点, 但该技术仍然存在需要改进的地方, 例如增强传感器稳定性﹑进一步提高灵敏度﹑实现多通道法检测等。 在仪器性能改进方面, 通过对传感器的仪器硬件及增敏材料的研发, 增强传感器的检测限及仪器灵敏度。 在研究生物小分子代谢方面, 建立血液及代谢分子的快速检测方法。 随着生命科学的发展, 分子水平上研究小分子间的相互作用对于研究分子在生命体中的机理具有重要的意义, 而SPR生物传感器的优点恰好弥补了其他检测技术的短板, 相信随着芯片制备技术和检测技术进一步的提升, SPR生物传感技术在分子检测及生命分析中会有更显著的进展。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|