作者简介: 王晓彬, 1989年生, 南昌师范学院物理与电子信息学院教师 e-mail: tawangxiaobin@126.com
抗坏血酸是一种常见的面粉品质改良剂, 用于改善面团的流变学特性及面包的烘焙品质。 本研究以面粉中含不同浓度抗坏血酸的混合样品为研究对象, 通过拉曼成像技术实现面粉中抗坏血酸的检测、 识别和定量分析。 分别采集面粉、 抗坏血酸和面粉-抗坏血酸混合样品的拉曼图像, 确定感兴趣区域及光谱范围, 以抗坏血酸拉曼光谱中强度较高且区别于面粉的3处拉曼峰(631, 1 128和1 658 cm-1)为依据对混合样品的平均拉曼光谱进行分析, 结果显示其不能有效评估面粉中抗坏血酸含量, 研究探索对图像中各像素点对应的拉曼光谱进行分析以实现面粉中抗坏血酸的有效检测。 以混合样品图像中各像素点拉曼光谱作为校正集、 面粉平均拉曼光谱和抗坏血酸平均拉曼光谱的线性组合光谱作为验证集建立偏最小二乘模型, 模型的回归系数用于将混合样品的三维拉曼图像重建为二维灰度图像, 通过阈值分割实现面粉中抗坏血酸的检测和识别, 根据识别结果建立定量分析模型。 结果显示, 偏最小二乘模型的最高和最低回归系数分别对应于抗坏血酸和面粉的最强拉曼峰, 所有回归系数应用于混合样品拉曼图像将其转换为灰度图像后面粉和抗坏血酸的像素点仍难以识别, 阈值分割方法将灰度图像转换为用于分类面粉像素和抗坏血酸像素的二值图像实现了面粉中抗坏血酸的有效检测。 通过分析各浓度混合样品对应子样品中识别到的抗坏血酸像素点数确定本研究对面粉中抗坏血酸的最低检测浓度为0.01%(100 mg·kg-1), 混合样品中抗坏血酸浓度同图像中识别到的抗坏血酸像素点在0.01%~0.20%范围内具有良好的线性关系, 决定系数为0.996 0。 研究结果可为面粉中抗坏血酸添加剂的定量检测提供方法支持, 为大规模快速筛查提供了技术参考。
Ascorbic acid is a common flour quality improver, which is used to improve the rheological properties of dough and the baking quality of bread. In this study, the mixed samples containing different concentrations of ascorbic acid in flour were used as the research object, and the detection, identification and quantitative analysis of ascorbic acid in flour were explored by Raman imaging technology. Raman images of flour, ascorbic acid and flour-ascorbic acid mixed samples were collected respectively, and the region of interest and spectral range were determined. The average Raman spectra of the mixed samples were analyzed based on the three Raman peaks (631, 1 128 and 1 658 cm-1) of the ascorbic acid Raman spectrum with higher intensity and different from the flour. The results showed that it could not effectively evaluate the content of ascorbic acid in flour. The Raman spectrum corresponding to each pixel in the image was analyzed to detect ascorbic acid effectively in flour. The partial least squares (PLS) model was established by using the Raman spectra of each pixel in the mixed sample image as the correction set and the linear combination spectra of flour average Raman spectra and ascorbic acid average Raman spectra as the verification set. The regression coefficients of the model were used to reconstruct the three-dimensional Raman image of the sample into a two-dimensional grayscale image. The threshold segmentation method was used to classify flour pixels and ascorbic acid pixels in the image, and a quantitative analysis model was established based on the classification results. The results showed that the PLS model’s highest and lowest regression coefficients correspond to the highest Raman peaks of ascorbic acid and flour respectively. After all regression coefficients were applied to Raman images and converted into grayscale images, the flour and ascorbic acid pixels were still difficult to recognise. The threshold segmentation method transforms the gray image into a binary image to classify flour pixels and ascorbic acid pixels, which realizes the effective detection of ascorbic acid in flour. The minimum detection concentration of ascorbic acid in flour in this study was determined to be 0.01% (100 mg·kg-1) by analyzing the number of ascorbic acid pixels identified in the corresponding sub-samples of mixed samples with different concentrations of ascorbic acid. There was a good linear relationship between ascorbic acid concentration in the mixed sample, and the identified ascorbic acid pixels in the image in the range of 0.01%~0.20%, and the coefficient of determination was 0.996 0. The research results provide method support for the quantitative detection of ascorbic acid additives in flour and provide technical reference for large-scale rapid screening.
小麦是人类最主要的粮食作物之一, 全世界1/3以上的人口以它为主粮。 面粉是小麦的主要加工品, 常用于制作馒头、 面条、 面包、 方便面、 水饺等食品。 为满足市场对不同面制品的需求, 面粉生产企业需要在加工过程中配以各种添加剂, 而添加剂的使用直接关系到面粉质量的优劣及消费者的饮食安全[1]。 抗坏血酸亦称维生素C, 是一种中速氧化剂, 可用于面粉品质的改良。 在加入面粉中进行搅拌时, 抗坏血酸被面粉中的部分氧化酶及空气中的氧气氧化变为脱氢抗坏血酸, 其在面粉中发挥氧化作用, 将— SH基氧化为— S— S键从而增加面筋筋力、 改善面团性质[2, 3]。 抗坏血酸因其自身及分解物的无毒无害性而被各国允许加入面粉中, 我国现行标准GB 2760— 2014限定其在面粉中最大使用量为200 mg· kg-1。 目前, 面粉中抗坏血酸的常规检测方法主要以高效液相色谱为主, 该方法具有检出限低、 特异性强、 灵敏度高等优点, 但其需要溶剂提取、 离心净化和滤膜过滤等一系列前处理过程, 程序复杂、 检测时间长、 成本高, 并且对样品具有破坏性, 不适于现场的快速检测。
随着光电技术的发展, 一些光谱方法在面粉添加剂的检测中展示了良好的应用前景, 如近红外光谱法[4, 5, 6]、 太赫兹光谱法[7]和拉曼光谱法[8, 9]等。 但这些方法均是对样品局部信息的获取, 存在取样代表性问题; 此外, 获得的信息中仅包含样品的光谱信息, 无法获取样品内部物质的分布信息。 拉曼成像技术融合拉曼光谱和数字成像技术的优势, 在对样品扫描过程中可同时获取拉曼信息和空间分布信息[10, 11]。 目前, 拉曼图像的获取主要有三种形式: 点扫描、 线扫描和面扫描, 其中线扫描方式检测速度优于点扫描方式, 可较好的应用于平整样品的检测, 在粉末状食品的质量安全检测中展示出良好的应用前景。 目前, 采用拉曼成像技术对面粉中添加剂的检测以过氧化苯甲酰(增白剂)为主[12, 13, 14], 这些报道均提供了面粉中过氧化苯甲酰的空间分布及定量检测模型, 但其数据处理方法均是通过选择添加剂单一拉曼特征峰对应的单波段校正图像进行阈值分割生成二值图像实现的, 但一些添加剂(如抗坏血酸)的拉曼光谱中拉曼峰数量较多且强度差异较小, 此时需考虑各波段对检测结果的影响, 因此本文基于偏最小二乘模型(partial least squares, PLS)回归系数对样品拉曼图像中抗坏血酸添加剂的定量检测进行了探讨。
本研究采用拉曼成像技术获取面粉中含抗坏血酸添加剂样品的拉曼图像, 将PLS模型的回归系数应用于面粉-抗坏血酸混合样品拉曼光谱的所有波段, 结合阈值分割实现拉曼图像中面粉像素和抗坏血酸像素的分类, 建立抗坏血酸浓度和抗坏血酸像素点数之间的线性关系模型, 为面粉中抗坏血酸添加剂的定量检测提供方法支持。
线扫描拉曼成像系统, 主要由以下部件组成: 785 nm线激光器, 美国Innovative Photonic Solutions公司; 785 nm分光片, 美国Semrock公司; InSpector R10E型光谱仪, 芬兰SPECIM公司; iKon-MDU934P-BEX2-DD型CCD相机, 英国Andor公司。 FA2204B型电子天平, 上海精密科学仪器有限公司; Vortex-Genie2型涡旋混合器, 美国Scientific Industries公司; 定制方形铝合金容器, 内部尺寸为45 mm× 45 mm× 2 mm; 50 mL离心管, 购于北京东南仪诚实验室设备有限公司。 抗坏血酸, 99%, 购于东北制药集团股份有限公司。 面粉, 超市购买, 采用GB 5009.86— 2016国家标准中高效液相色谱法进行测定未检出抗坏血酸。
利用电子天平准确称取0.02 g抗坏血酸和9.98 g面粉, 装入50 mL离心管中通过涡旋混合器混合均匀, 获得面粉中含0.20%抗坏血酸的混合样品。 以相同的方式, 在保持每种混合样品总质量为10 g的前提下, 调整抗坏血酸和面粉的质量, 制备面粉中含6种不同浓度抗坏血酸(0.01%, 0.02%, 0.05%, 0.08%, 0.10%, 0.20%)的混合样品。 将制备好的混合样品转入方形铝合金容器中, 使混合样品充满整个容器并使得样品的上表面与容器的上平面保持平齐。 经过称量, 方形容器中混合样品的质量约为2.10 g, 为使制备的10 g混合样品得到充分利用, 将每种混合样品装入4个相同的方形容器中, 获得每种混合样品的4个子样品。 同时, 制备纯面粉样品和纯抗坏血酸样品, 分为4个子样品采集拉曼图像。
将制备好的混合样品放置于成像光谱仪镜头下方的单轴移动滑台上, 调整滑台高度, 使样品表面与镜头的距离为20 cm, 设定样品采集的起始位置及结束位置。 线扫描拉曼成像参数: 相机曝光时间1 000 ms, 拉曼光谱采集范围785~1 000 nm(对应拉曼位移0~2 728 cm-1), 光谱分辨率为0.54 nm, 空间分辨率为0.125 mm· pixel-1, 单轴移动滑台的移动速度为0.082 3 mm· s-1。 相机的采集区域为128 mm× 45 mm, 数据被保存为1 024× 360× 512的拉曼图像立方体。
为减少数据量提高有效信息的获取效率, 首先确定拉曼图像的感兴趣区域(region of interest, ROI)及光谱范围。 在方形样品区域内, 以其中心作为ROI的中心, 选择40 mm× 40 mm的方形区域(对应像素点为320× 320, 共102 400个像素), 以确保只包含样品区域, 排除背景区域的影响。 抗坏血酸拉曼峰主要集中于400~2 000 cm-1, 因此选择该光谱范围用于后续的分析。 激光和样品相互作用, 产生拉曼信号的同时还伴有荧光信号, 较高的荧光背景信号对拉曼峰的识别产生极大的干扰, 本文采用自适应迭代重加权惩罚最小二乘(adaptive iteratively reweighted penalized least squares, airPLS)方法实现拉曼光谱的基线校正。
建立混合样品中添加剂浓度与拉曼图像中各像素点拉曼光谱之间的PLS模型, 其中校正集为不同浓度混合样品的平均拉曼光谱, 验证集为面粉平均拉曼光谱和抗坏血酸平均拉曼光谱的组合光谱, 通过式(1)实现
式(1)中:
PLS模型使用相关系数(校正集为
式(2)中: I为计算得到的强度值; R1— Rn为PLS模型中每个波段对应的回归系数; X1— Xn是拉曼光谱中各波段对应的强度值; R0为截距。
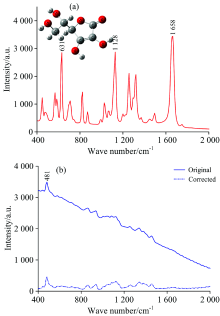
图1所示为抗坏血酸和面粉的平均拉曼光谱。 由图可看出, 两者的拉曼光谱具有显著差异, 抗坏血酸拉曼谱峰较多[图1(a)], 强度较高的拉曼峰分别位于631, 1 128和1 658 cm-1处。 图1(a)中的插图为抗坏血酸的分子结构, 主要由C— C, C=C, C— O, C=O, C— H, O— H等官能团组成。 每种官能团包含不同的振动模式, 归属3处拉曼峰的振动模式: 631 cm-1归属于C— C环伸缩振动, 同时伴随有O— H面外弯曲振动; 1 128 cm-1归属于C— O骨架伸缩振动和五元脂杂环的变形振动的耦合; 1 658 cm-1处为最强拉曼峰, 由C=C伸缩振动引起[15]。 面粉拉曼光谱信号中存在较强的荧光背景, 导致基线发生漂移, 如图1(b)所示。 基线漂移影响了真实拉曼强度的确定, 采用airPLS方法去除荧光背景的干扰, 图中校正后的拉曼光谱具有较为平坦的基线。 面粉的拉曼谱峰相对较少, 最强拉曼峰位于481 cm-1处, 归属于C— C— C骨架弯曲振动和C— O扭曲变形振动的耦合。
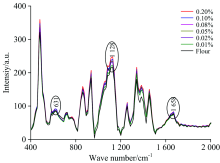
图2所示为面粉-抗坏血酸混合样品的平均拉曼光谱。 由图1可看出, 在各拉曼光谱中既包含面粉的拉曼信号又包含抗坏血酸的拉曼信号, 但抗坏血酸的拉曼信号相对于面粉是十分微弱的, 这是因为混合样品中仅含有微量的抗坏血酸。 在混合样品的拉曼光谱中, 仅有抗坏血酸的3处拉曼特征峰(631, 1 128和1 658 cm-1)可观察到。 在0.20%浓度的混合样品中, 抗坏血酸的3处显著拉曼峰强度最高; 当抗坏血酸浓度从0.20%降低到0.01%时, 其拉曼强度不断降低且不容易观察。 因此, 本研究对拉曼图像中各像素点对应的拉曼光谱进行评估, 以实现面粉中抗坏血酸的有效检测。
共制备了6种不同浓度的面粉-抗坏血酸混合样品, 采集每种浓度4个子样品的拉曼图像; 将每种浓度4个子样品重新混合和制备, 采集拉曼图像; 再次混合和制备混合样品, 获取图像。 计算每个子样品ROI内的平均拉曼光谱, 共得到72条光谱(6× 4× 3), 作为校正集。 面粉和抗坏血酸同样包含4个子样品, 将面粉和抗坏血酸子样品的平均拉曼光谱应用式(1)得到新拉曼光谱, 6种浓度可获得24条拉曼光谱(4× 6), 作为验证集。 利用校正集和验证集的拉曼光谱建立PLS模型, 因子数为3时具有最佳的建模效果, 校正集的
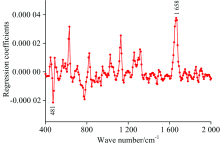
PLS模型中回归系数绝对值应用于混合样品图像中各像素点对应的拉曼光谱波段, 通过式(2)计算得到像素点对应的强度值, 将三维拉曼图像转换为二维灰度图像。 在混合样品的灰度图像中, 面粉和抗坏血酸的像素点仍然难以识别, 采用阈值分割方法将灰度图像转换为用于分类面粉像素和抗坏血酸像素的二值图像。 阈值同样采用PLS模型回归系数进行确定, 即将回归系数绝对值通过式(2)用于面粉拉曼图像各像素点的拉曼光谱中, 像素点强度的最大值为0.233 7, 该数值确定为阈值。 基于该阈值, 在抗坏血酸的图像中也没有发现分类为面粉的像素, 同样在面粉的图像中没有发现分类为抗坏血酸的像素, 表明该阈值可正确分类面粉像素和抗坏血酸像素。
在不同浓度的混合样品中, 高于该阈值的分类为抗坏血酸, 以黑色像素表示; 低于该阈值的分类为面粉, 以白色像素表示。 图4所示为混合样品的分类图像。 在最低浓度0.01%的混合样品中仍可观察到黑色像素(抗坏血酸), 说明该方法对面粉中抗坏血酸的最低检测浓度为0.01%。 随着抗坏血酸浓度的增加, 混合样品中检测到的抗坏血酸像素点数量不断增加; 在0.20%浓度的混合样品中, 检测到的抗坏血酸的像素最多为228个, 最少为212个, 4个子样品的平均像素数为221个。 同一浓度样品, 检测到的抗坏血酸像素点数量不同是由混合物中抗坏血酸颗粒的随机分布引起的。 此外, 像素点数量的差异性, 说明需要使用多个子样本对混合样品进行定量分析。
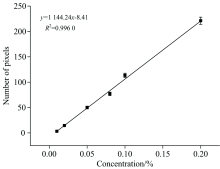
为计算不同浓度混合样品的检测结果, 统计分类图像中抗坏血酸像素点的数量。 表1所示为混合样品图像中抗坏血酸的检测结果。 由表1可看出, 随着混合样品中抗坏血酸浓度的升高, 检测到的抗坏血酸像素点数量不断增加, 以平均值代表该样品的像素点数量, 建立两者之间的关系模型, 如图5所示, 图中混合样品中抗坏血酸浓度同检测到抗坏血酸像素点的平均值之间具有良好的线性关系, 决定系数为0.996 0, 表明拉曼成像技术可用于定量分析面粉中抗坏血酸添加剂。
| 表1 混合样品图像中抗坏血酸的检测结果 Table 1 Detection results of ascorbic acid in mixed sample images |
通过线扫描拉曼成像技术实现了面粉中抗坏血酸的检测、 识别和定量分析。 抗坏血酸的拉曼光谱中拉曼峰数量较多且存在强度相近的3处显著拉曼峰, 不便于采用单一显著拉曼特征峰对应的灰度图像识别抗坏血酸像素。 为考虑各波段对检测结果的影响, 建立PLS模型并将回归系数用于样品图像的重建, 灰度图像结合阈值分割方法实现了面粉-抗坏血酸混合样品中面粉像素和抗坏血酸像素的分类。 该方法对面粉中抗坏血酸的最低检测浓度为0.01%(100 mg· kg-1), 在0.01%~0.20%的浓度范围内建立了抗坏血酸浓度同检测到的抗坏血酸像素点数量之间的线性关系模型, 决定系数为0.996 0。 同面粉中添加剂的其他光谱检测方法相比, 线扫描拉曼成像技术具有检测面积大、 可视化识别和易于操作的优点。 研究结果可为面粉添加剂的无损定量检测提供方法支持, 为现场快速检测设备的开发提供了理论基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|