作者简介: 林 艳, 女, 1982年生, 湖南中医药大学药学院实验师 e-mail: linyan198210@163.com
何首乌有生首乌和制首乌之分, 生首乌能解毒, 润肠通便; 制首乌能补肝肾, 益精血, 乌须发, 强筋骨, 化浊降脂。 生/制首乌都含有二苯乙烯苷类、 蒽醌类、 磷脂类等化学成分, 但其含量存在一定差异。 生首乌炮制后其毒性减弱。 生/制首乌的功效、 主治和毒性都存在一定的差异, 在外观性状上差异较易识别, 但其磨成粉末后两者不易区分。 因此, 寻找一种快速简单的判别方法来区分生/制首乌十分必要。 中红外光谱法具有检测速度快, 对样品无损等优势, 已在中药质量控制和鉴别中得到广泛的应用。 该研究建立生/制首乌中红外光谱的指纹图谱, 并采用正交偏最小二乘-判别分析对其进行鉴别。 在4 000~700 cm-1范围内采集38批不同来源生/制首乌中红外光谱数据, 分析其主要的特征峰, 并用simca13.0软件对数据进行正交偏最小二乘-判别分析。 建立38批不同来源生/制首乌中红外指纹图谱, 并分析出主要化学成分包括蛋白质类、 核酸类、 脂肪酸类、 蒽醌类、 二苯乙烯苷类、 磷脂类。 对红外光谱峰形和峰强度进行分析, 生首乌和制首乌的峰形差异比较少, 但峰强度具有一定的差异。 为了建立生/制首乌红外光谱差异模型, 采用正交偏最小二乘-判别分析法, 其结果能很好地将生/制首乌分成两类, 左边为制首乌, 右边为生首乌。 根据变量在项目中的重要性(VIP值)筛选差异化学成分, 并利用SPSS17.0统计软件进行t检验, 以VIP>1及 p<0.05确定差异性化学成分。 生/制首乌的差异性化学成分为二苯乙烯苷类、 蒽醌类、 磷脂类, 表明何首乌炮制后二苯乙烯苷类、 蒽醌类、 磷脂类的含量都发生变化。 中红外光谱结合模式识别筛选出差异性化学成分和文献报道基本一致, 表明此法可用于生/制首乌鉴别。 本研究成功采用中红外光谱对生/制首乌进行快速检测和整体质量评价, 结合模式识别能将其鉴别, 可为中药质量控制和快速鉴别提供依据。
The roots of Polygonum multiflorum are traditional Chinese medicinal herbs in processed form or raw state. Raw Polygonum multiflorum can detoxify and loosen the bowel and relieves constipation, but processed Polygonum multiflorum can benefit blood, hair, strong muscles and bones, turbidness and lipid lowering. The raw and processed Polygonum multiflorum contain chemical components such as stilbene glycosides, anthraquinone and phospholipid, but their contents are different. The toxicity of raw Polygonum multiflorum decreased after processing. The chemical composition, efficacy and hepatotoxicity of raw and processed Polygonum multiflorum are different. It was easy to recognize the difference in appearance between raw and processed Polygonum multiflorum, but it was not easy to distinguish the power of raw and processed Polygonum multiflorum. Therefore, it is necessary to find a fast and simple method for distinguishing them. Mid-IR has the advantages of fast detection speed and nondestructive. Mid-IR has been widely used in the identification of traditional Chinese medicine. This paper aimsf to establish the fingerprint of the mid-infrared spectrum of raw and processed Polygonum multiflorum and identify them by orthogonal partial least-squares discriminant analysis (OPLS-DA). The chemical composition in 38 batches of raw and processed Polygonum multiflorum were determined by mid-IR of 4 000~700 cm-1, and the characteristic peaks of chemical composition were analyzed. OPLS-DA of simca13.0 software analyzed the data. The mid-infrared fingerprints of 38 batches of polygonum multiflorum from different sources were established, mainly including protein, nucleic acid, fatty acid, anthraquinone, stilbene glycosides and phospholipids. The peak shape and peak intensity of the infrared spectrum were analyzed, and the difference of peak shape between the raw and the processed radix aconitum was less, but the peak strength was different. OPLS-DA was used to establish the infrared spectral difference model of raw/processed Polygonum multiflorum. The results showed that the raw and processed Polygonum multiflorum could be well divided into two categories. The left was raw Polygonum multiflorum, and the right was processed Polygonum multiflorum. SPSS 13.0 statistical software was used to perform the t-test. Constituents with VIP>1 and p<0.05 ( t-test) were considered statistically significant. The differential constituents of raw and processed Polygonum multiflorum were stilbene glycosides, anthraquinone and phospholipid. The results showed that the content of stilbene glycosides, anthraquinone and phospholipid were different in the raw and processed Polygonum multiflorum. The differential constituents of raw and processed Polygonum multiflorum found by mid-IR and pattern recognition is consistent with the literature reports. The results showed that this method was feasible. In this study, the medium infrared spectrum was successfully used for the rapid detection and overall quality evaluation of Polygonum multiflorum. Identifying Polygonum multiflorum with Mid-IR and pattern recognition could provide the basis for the quality control and rapid identification of Traditional Chinese medicine. The study can successfully identify theraw and processed Polygonum multiflorum by mid-IR and pattern recognition and provide a reference for quality control and quick identification of TCM.
何首乌有生首乌和制首乌之分。 生首乌的制法为何首乌除去杂质, 洗净, 稍浸, 润透, 切厚片或块, 干燥。 制首乌的制法为何首乌片或块, 照炖法(通则0213)用黑豆拌匀, 置非铁质的适宜容器内, 炖至汁液吸尽; 或照蒸法(通则0213), 清蒸或用黑豆拌匀后蒸, 蒸至内外均呈棕色, 或晒至半干, 切片, 干燥。 生首乌能解毒消痈、 截疟、 润肠, 制首乌能补肝肾、 乌须发、 化浊降脂, 其功效和肝毒性都有所不同[1, 2, 3, 4]。 生/制首乌都含有二苯乙烯苷类、 蒽醌类、 磷脂类, 但其在种类和含量方面都存在一定的不同[5, 6]。 生首乌与制首乌在外观性状上有差异较易识别, 但其磨成粉末后两者不易区分, 且功效、 毒性不同不可混用。 生/制首乌鉴别依赖于感官体验, 或更复杂的化学检测方法, 前者较为主观, 后者操作复杂, 因此, 寻找一种快速简单的判别方法来区分生/制首乌十分必要。
红外光谱是一种可以检测物质中特殊分子不同吸收频率的化学分析工具, 不同的分子结构可以产生不同的吸收谱带。 光谱技术在中药化学成分分析方面有着快速、 简单、 灵敏等优势。 中红外光谱是波数为4 000~400 cm-1的电磁波, 由分子基频振动组成的光谱, 其吸收带多而窄, 吸收强度大, 有显著的吸收特性, 能提供更多的频率和强度信息, 且大多数典型官能团的特征振动峰大多分布于中红外区。 物质在中红外区的吸收峰可表征分子结构特征性, 不同化合物的吸收峰有足够清晰独立的特征吸收峰或谱带, 其组份含量和其对应的吸光度成正比关系[7]。 相比显微、 薄层色谱等鉴别方法, 中红外光谱法具有检测速度快速, 对样品无损的优势, 已在中药鉴别中得到广泛应用。 红外分析技术结合化学计量分析已成为中药材样品检测分析的一种简便方法[8, 9, 10]。 利用中红外光谱技术结合化学计量分析对薄荷的产地进行识别, 识别结果最高可达90%[11]。 利用中红外光谱和化学计量学相结合可以鉴别核桃的产地及品种[12]。 本文将采用中红外光谱对不同来源生/制首乌进行分析, 再结合模式识别方法找出生/制首乌差异性化学成分类型, 为生/制首乌鉴别提供一种快速检测方法, 为生/制首乌的质量控制提供依据。
Niclet-iS5红外光谱仪(Thermo Scientcific公司), 灵巧型粉碎机DJ-10A(上海隆拓仪器设备有限公司), 101型电热鼓风干燥箱(北京市永光明医疗仪器厂)。 38批饮片购自各省大药房和市场, 所有实验样品均经湖南中医药大学龚力民副教授鉴定为蓼科植物何首乌Polygonui Multiflori Radix的干燥块根, 样品信息见表1。
| 表1 不同来源何首乌 Table 1 The sources of Polygonum multiflorum |
取样品粉末在40 ℃下充分烘干, 过200目筛, 得极细粉。 取不同批次何首乌各0.1 g, 混合均匀得到质控样本。 取烘干后的样品粉末置于中红外光谱ATR附件上, 调节压力塔, 设置分辨率4 cm-1, 扫描次数32次, 空白背景光谱扫描64次, 扣除大气背景干扰。 采用ominc8.0对不同来源生/制首乌的中红外光谱进行自动平滑。
取质控样本进行方法学考察, 考察指标为仪器精密度、 操作重复性、 样本稳定性、 中间精密度。 按1.2节对样本进行处理和检测, 取红外图谱中吸收强度最大的6个特征峰作为评价峰, 以对应波数计算的相对标准偏差作为评判依据。
1.3.1 精密度
质控样本连续扫描6次, RSD均小于0.31%, 表明仪器精密度良好。
1.3.2 重复性
质控样本平行扫描6次, RSD均小于0.25%, 表明样品测定方法重复性良好。
1.3.3 稳定性
质控样本分别在0, 1, 2, 4和6 h进行红外测定, RSD均小于0.18%, 表明样品在6 h内的稳定性良好。
1.3.4 中间精密度
质控样本在不同时间由不同操作人员操作, RSD均小于0.15%, 表明仪器精密度良好。
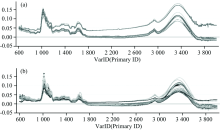
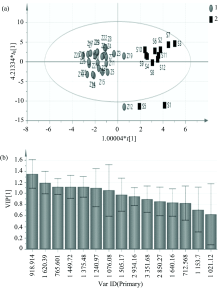
红外指纹图谱分为特征区和指纹区, 分别在4 000~1 300和1 300~400 cm-1。 对不同来源生/制首乌的红外光谱峰形和峰强度进行分析, 生首乌和制首乌的峰形差异比较少, 但峰强度具有一定的差异(图1, 表2)。 建立了生/制首乌红外光谱差异模型, 采用正交偏最小二乘-判别分析, 结果能很好地将生/制首乌分成两类, 左边为制首乌, 右边为生首乌[图2(a)]; 根据变量在项目中的重要性(VIP值)筛选差异性化学成分, 并利用SPSS17.0统计软件进行t检验, 以VIP> 1及p< 0.05确定差异性化学成分。 918 cm-1处为— C=C— H变形振动, 可能为何首乌中二苯乙烯苷类的— C=C— H变形振动, 表明何首乌炮制后其二苯乙烯苷类的含量发生变化; 1 620 cm-1处为C=O伸缩振动, 可能为何首乌中蒽醌的伸缩C=O振动, 表明何首乌炮制后其蒽醌的含量发生变化; 1 449, 1 375和1 240 cm-1处可能为何首乌中磷脂的— CH3基团C— H变形振动和— O— P— 伸缩振动, 表明何首乌炮制后其磷脂类的含量发生变化[图2(b)]。
| 表2 生/制首乌主要的特征峰 Table 2 The main characteristic peaks of crude/processed Polygonui Multiflori radix |
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|