作者简介: 刘沁荣, 1995年生, 河南中医药大学药学院硕士研究生 e-mail: qinr1106@163.com
无机元素是自然界植物生长过程中所必需的物质, 也是中药材的基本组成成分, 在中药质量控制和评价应用中是不可或缺的参数。 原子吸收分光光度技术作为无机元素测定方法, 在中草药及成药分析中起到重要的作用。 根际是植物和土壤进行物质能量交换的结点, 根际土壤中营养元素与中药材内在品质密切相关。 研究以5个省份9个主产区的丹参及根际土壤为样品, 采用原子吸收分光光度法对样品中Na, Mg, K, Ca, Mn, Fe, Cu和Zn八种无机元素含量进行检测, 采用聚类分析、 主成分分析和偏最小二乘判别分析等化学模式识别方法进行探讨。 结果表明: 建立的原子吸收分光光度方法线性关系良好, 具有较高的准确度和精密度; 比较各产地样品无机元素含量, 发现山东丹参中Mn元素含量颇高, 四川丹参中Fe和K元素含量较高, 陕西丹参根际土壤中Ca元素含量较高; 聚类分析显示不同产地丹参存在明显差异, 且根际土壤中的K, Na, Mn和Zn元素与药材中多个无机元素呈现相关关系; 主成分分析结果表明土壤中元素影响着药材成分元素含量若以这八种元素为评价指标山东产区丹参质量较佳; 偏最小二乘判别分析结果发现Na, K, Fe和Mg四个元素可能是造成不同产地丹参质量差异的主要影响因素。 采用原子吸收分光光度技术建立不同产地丹参及根际土壤中无机元素含量方法, 探讨道地药材质量与生长环境两者间关系, 为丹参药材质量控制及标准建立提供科学参考。
Inorganic elements are essential substances in the growth process of plants in nature and are also the basic components of Chinese medicinal materials. Their composition and content determine the efficacy and properties of Chinese medicine and are an indispensable parameter in the quality control and evaluation of Chinese medicine. The rhizosphere is the node of material and energy exchange between plants and soil. The nutrient elements of the rhizosphere soil are closely related to the intrinsic quality of Chinese medicinal materials. The changes in the composition of medicinal materials and the law of action due to differences in soil, production areas and other ecological factors are issues worthy of study. As an important element determination method, atomic absorption spectrophotometry plays an important role in analysing Chinese herbal medicines and finished medicines. The study used samples of Salvia miltiorrhiza and rhizosphere soil from 9 main producing areas in 5 provinces were used. The atomic absorption spectrophotometry was used to detect the contents of eight inorganic elements of Na, Mg, K, Ca, Mn, Fe, Cu and Zn in the samples. Use cluster analysis, principal component analysis, orthogonal partial least square discriminant analysis and other chemical pattern recognition methods to discuss and summarize. The results show that the established atomic absorption spectrophotometric method has a good linear relationship and has high accuracy and precision. The content of Mn in the Salvia miltiorrhiza from the Shan-dong area is higher than that in other producing areas. Salvia miltiorrhiza from the Si-chuan area have higher Fe and K elements, while the content of Ca in the rhizosphere soil of Salvia miltiorrhiza from Shan-xi province is slightly higher. Cluster analysis showed that there were significant differences between different origins of Salvia miltiorrhiza. The K, Na, Mn and Zn elements in the in root soil showed correlations with several elements in the herbs. The results of the principal component analysis showed that the elements in the soil influenced the variation of the constituent elements of the herbs. If these eight elements were used as evaluation indexes, the quality of Salvia miltiorrhiza in the Shan-dong area would be better. The results of partial least squares discriminant analysis results revealed that four elements, Na, K, Fe and Mg, might be the main influencing factors for the difference in quality of Salvia miltiorrhiza from different production areas. In this study, methods and evaluation systems for the accurate and efficient analysis of inorganic element content in Salvia miltiorrhiza from different producing areas and rhizosphere soil and the evaluation system were to explore the relationship between the quality of authentic medicinal materials and the growth environment. It provides a scientific basis for the quality control and standard establishment of Salvia miltiorrhiza and a reference for other studies.
丹参始载于《神农本草经》, 为临床常用大宗中药材, 具有活血祛瘀、 清心除烦、 养血安神的功效[1]。 化学成分种类丰富, 包括丹参酮类、 丹酚酸类、 多糖类和无机元素等[2, 3, 4], 药理研究表明丹参具有心肌保护、 抗氧化、 抗肿瘤、 抗炎等作用[5]。 其临床应用广泛, 现以丹参为主的复方制剂约几十种, 涉及传统丹膏丸散, 注射液、 滴丸、 胶囊、 片剂等。 丹参因具有较高药用价值市场需求量颇高, 但随着野生资源的减少现以人工栽培为主, 其道地产区有山东、 河南、 四川、 陕西等[6]。
国家药典规定丹参入药部位为根及根茎, 根部作为植物和土壤进行物质能量交换的结点, 对土壤养分需求较高。 目前关于不同产地丹参的研究有相关报道, 邵远洋等通过测定不同产地鲜丹参活性成分含量, 结果得出丹参质量存在产地特异性[7]; 赵琦等以不同产地和品系丹参为研究对象, 以产量和含量为考察指标, 表明生长环境、 土壤对丹参质量影响较大[8]; 有学者对丹参化学成分和土壤进行比较, 发现土壤元素影响着丹参酮成分的合成积累且与药材活性成分存在相关性[9]。
原子吸收分光光度法作为一项重要的元素测定方法, 在中草药及成药分析中起到了重要的作用。 无机元素是自然界植物生长过程中所必需物质, 是中药的基本成分和药材质量控制中不可或缺的特征参数[10], 已有对不同产地中药材的矿物元素进行研究报道[11], 但尚未见对丹参药材元素和土壤元素间相关性进行探讨。 以根际土壤和药材为切入点, 采用原子吸收分光光度法对不同产地丹参药材及根际土壤中无机元素进行分析, 总结丹参药材与根际土壤两者间关系, 以期深入了解因土壤产区所产生的质量差异。
Z-2300原子吸收光谱仪(日立高新技术公司); WX-4000微波消解仪(上海屹尧科技有限公司); DKQ赶酸电热板(上海屹尧科技有限公司); 单元素Na, Mg, K, Ca, Mn, Fe, Cu和Zn对照溶液(国家有色金属及电子材料分析测试中心, 质量浓度均为1 000 mg· L-1), 批号分别为(GSB0417202004, GSB0417711079, GSB0417382004, GSB0417304112, GSB0417011111, GSB0417710079, GSB0417210073, GSB0417805026)。
丹参药材从全国各产区采集, 经河南中医药大学生药学董诚明教授鉴定为唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎。 为避免生长区域肥力均匀性差异, 进行多点采样; 采用“ 抖根法” 收集根际土壤, 经四分法进行风干处理收集备用, 药材、 土壤信息见表1。
| 表1 药材及土壤样品信息 Table 1 Sample information |
检测原子吸收光谱的最佳仪器工作参数: 空气流量为15 L· min-1, 空气压力为0.16 MPa, 其他参数见表2。
| 表2 原子吸收光谱仪工作参数 Table 2 Using parameters of atomic absorption spectrometer |
供试品溶液制备[12]: 取各产地丹参样品粉碎过3号筛精密称取丹参样品粉末约0.5 g, 加10 mL硝酸置聚四氟乙烯消解罐, 放置6 h后至微波消解仪; 精密称取根际土壤样品约0.5 g, 加6 mL硝酸、 3 mL盐酸、 2 mL氢氟酸置聚四氟乙烯消解罐, 放至微波消解仪进行消解, 消解程序见表3。 将消解完毕的样品置80 ℃电热板赶酸冷却30 min, 加5%硝酸溶液至25 mL容量瓶。 精密量取5%稀硝酸溶液10 mL稀释至50 mL容量瓶, 密封待测。 空白溶液制备同上。
| 表3 微波消解仪工作参数 Table 3 Operating parameters of microwave digestion instrument |
标准溶液制备: 取Na, Mg, K, Ca, Mn, Fe, Cu和Zn八种元素标准溶液, 精密吸取0, 0.05, 0.10, 0.15, 0.20和0.25 mL于25 mL容量瓶中5%稀硝酸稀释, 5%稀硝酸为空白。
采用SPSS Statistics 22.0和SIMCA14.1软件对数据进行整理分析。
将Na, Mg, K, Ca, Mn, Fe, Cu和Zn八种元素标准溶液用5%稀硝酸逐级稀释, 5%稀硝酸为空白, 测定各元素不同浓度标准溶液的吸光度值, 以浓度为横坐标, 吸光度为纵坐标绘制标准曲线, 求回归方程及相关系数。 单元素同浓度溶液连续进样11次进行检出限实验, 线性方程及检出限结果见表4。
| 表4 线性回归方程、 检出限 Table 4 Linear regression equation and detection limit |
取Na, Mg, K, Ca, Mn, Fe, Cu和Zn八种元素各中间浓度标准溶液按照仪器工作参数重复测定6次, 计算吸光度值相对标准偏差(RSD)值分别为0.25%, 0.29%, 0.12%, 0.28%, 0.12%, 0.17%, 0.86%和0.38%, 均小于1.0%, 表明仪器精密度良好。
按1.4节处理丹参样品6份, 按照1.3节仪器工作参数测定Na, Mg, K, Ca, Mn, Fe, Cu和Zn八种元素, 结果所得8种元素吸光度的RSD值分别为0.09%, 0.72%, 0.15%, 0.34%, 1.07%, 0.25%, 0.98%和0.35%, 均小于1.10%, 表明该法重复性良好。
称取已知浓度的丹参样品粉末, 精密加入Na, Mg, K, Ca, Mn, Fe, Cu和Zn八种元素标准溶液至一定浓度进行实验, 回收率为100.58%, 97.88%, 97.04%, 101.16%, 97.54%, 97.03%, 99.35%和96.91%, RSD值为1.08%, 0.19%, 1.67%, 1.58%, 2.10%, 1.23%, 0.79%和0.43%, 均小于3.0%。
按照1.4节处理不同产地丹参样品, 在1.3节连续进样3次计算平均值, 结果见表5。
| 表5 不同产地丹参无机元素含量 (mg· g-1) Table 5 Content of inorganic elements in Salvia miltiorrhiza |
按照1.4节处理不同产地根际土壤样品, 按1.3节最佳仪器工作参数连续进样3次计算平均值, 结果见表6。
| 表6 不同产地根际土壤无机元素含量(mg· g-1) Table 6 Content of inorganic elements in root soil |
2.7.1 聚类分析
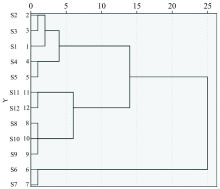
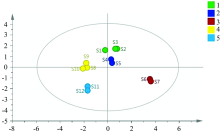
以不同产地丹参8种无机元素含量结果为原始数据, 采用组间连接法, 以Euclidean距离为分类依据进行系统聚类分析。 结果显示当Euclidean距离为25时, 河南、 陕西、 山东、 山西丹参被分为一类, 四川单独一类; 当Euclidean距离为8时, 河南和陕西丹参被分为一类, 山东、 山西丹参分为一类、 四川单独成类; 当Euclidean距离为3时, 各产地丹参均被单独分为一类, 表明不同产地丹参之间存在明显差异。 结果如图1所示。
2.7.2 根际土壤元素与丹参元素相关性分析
运用SPSS Statistics 22.0分析软件Pearson分析根际土壤和丹参元素含量相关性, 见表7。 结果显示根际土壤中的Fe、 K元素与药材中的K元素存在正相关关系, 根际土壤中Na、 Mn和Zn元素与药材中Mn元素含量呈现正相关关系; 根际土壤中Mg、 K、 Ca元素与药材中Ca元素含量与呈正相关关系, 但Mn、 Zn元素含量与药材中Ca元素呈现负相关; 另外根际土壤中Mn、 Zn元素含量与药材中Mg、 Ca、 Mn有一定的相关关系。
| 表7 根际土壤元素与药材间元素相关性分析 Table 7 Correlation analysis of elements between soil and medicinal |
2.7.3 不同产地丹参元素主成分分析
运用SPSS Statistics 22.0分析软件对不同产地丹参8种元素含量标准化处理后进行主成分分析, 见表8和表9。 主成分特征值大于1的因子有2.738, 2.231和1.756, 总贡献率84.058%, 可代表丹参样品大部分信息。 故选择对该三个主成分进行分析, 第一主成分特征根2.738, 贡献率为34.220%, 元素Fe、 Cu、 Zn在第一主成分有较高载荷, 反映此三种元素信息; 第二主成分特征根2.231, 贡献率为27.887%, 元素Na、 K、 Mn在第二主成分有较高载荷, 反映此三种元素信息; 第三主成分特征根1.756, 贡献率为21.951%, 元素Mg和Ca在第三主成分有较高载荷, 反映此二种元素信息。
| 表8 主成分分析的特征值和贡献率 Table 8 The characteristics of the principal component value and contribution |
| 表9 初始因子载荷矩阵 Table 9 The initial factor loading matrix |
根据主成分得分计算综合得分, 综合得分越高药材品质越高, 综合得分以主成分的贡献率对主成分得分进行加权平均, 即主成分总和得分=(主成分1得分×34.220+主成分2得分×27.887+主成分3得分×21.951)/84.058。 结果显示S8, S9和S10样品综合得分明显高于其他, 若以这八种元素作为评定指标, 则山东产丹参质量较优, 具体见表10。
2.7.4 不同产地丹参元素偏最小二乘判别分析(PLS-DA)
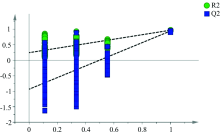
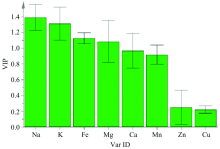
为了进一步筛选不同产地丹参样品质量差异的元素, 采用SIMCA14.1软件分别对不同产地丹参样品的元素含量进行PLS-DA分析, 得到变量重要性投影值图(variable important project, VIP), 见图2—图4。 其中横坐标为无机元素编号, 纵坐标为VIP值, VIP值越高, 对模型贡献率越高, 由此筛选VIP值> 1的元素, 结果显示对整体模型差异贡献由大向小排序为Na, K, Fe和Mg, 推测以上无机元素可能是造成不同产地丹参质量差异的主要影响因素。
药用植物的生长发育和成分合成积累与生态环境关系密切, 其中土壤是形成中药材产量高及质量优的基础, 土壤的质地、 pH值及有机物质等指标对植物的根系活力和生长分布有着重要影响, 研究验证土壤质地直接影响根类中药材的质量品质[13]。 由中药材资源调查结果显示四川、 山东、 河南、 陕西、 山西为丹参的主产区[14], 本研究以5个省份9产区的丹参及根际土壤为样品, 建立原子吸收分光光度法测定样品中无机元素含量, 含量测定结果显示四川丹参样品中Fe、 K元素含量较高, 且该地区土壤以黏壤土为主, 在黏壤土中内部阳离子大量交换使得土质中钾元素较为丰富, 本实验结果与之吻合。
中药材质量品质和临床疗效与生长区域环境息息相关, 因土壤、 气候、 产区等生态因子差异而发生成分转化规律和物质积累变化是现研究阶段值得探索的问题。 以各无机元素含量为依据对5个产地各样品进行聚类分析, 结果显示河南和陕西丹参被分为一类, 山东、 山西丹参分为一类, 四川单独成类, 其分类结果表示道地产区分布与土壤质地差异有一定关联性。 另外发现, 丹参根际土壤中的K, Na, Mn和Zn元素与药材中多个无机元素呈现相关关系, 且丹参药材中Na, K, Fe和Mg无机元素可能是导致不同产地丹参质量差异的主要影响因素。 在种植过程中是否可以对根际土壤或植株叶面进行相关元素肥料的喷施, 通过控制用量或配比来改善丹参药材产量和质量, 以期全面提升中药材品质, 是值得探讨且深入研究的课题。
生态环境土壤是产生药材道地差异主要因子之一, 创造良好的土壤环境改良土壤性状, 提供适合不同中药植物生长发育的土壤条件, 是加强中药材生产种植培优技术的关键。 本研究通过原子吸收分光光度法对不同产地丹参及根际土壤的无机元素进行测定, 以期为丹参质量控制和品质评价相关研究提供参考, 然而本研究就土壤和药材中元素成分进行了探讨, 后期会结合化学成分和药效活性进行全面研究, 以期为药材质量控制和评价提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|