作者简介: 王思远, 1993年生, 燕山大学信息科学与工程学院博士研究生 e-mail: 1814735271@qq.com
近年来, 我国沿海赤潮发生的次数和面积持续增加, 经济损失严重。 根据赤潮的毒性特点, 通常分为三类, 分别为无毒赤潮、 鱼毒性赤潮和有毒赤潮。 其中有毒赤潮产生的毒素主要是麻痹性贝毒, 其由于分布广, 毒性强成为危害最大的生物毒素之一。 根据麻痹性贝毒的摄入量不同, 人类误食染毒的贝类后, 身体各部位会出现刺痛或灼热的感觉, 然后全身麻痹, 严重者甚至在短时间内死亡。 近年来, 多地出现人类误食染毒的贝类后死亡的事件。 麻痹性贝毒的摄入量主要取决于产麻痹性贝毒藻的浓度, 因此, 对产麻痹性贝毒藻浓度的监测就显着尤为重要。 提出了用三维荧光光谱结合化学计量学方法建立产麻痹性贝毒藻定量分析模型。 首先, 利用F-4600荧光光度计采集微小亚历山大藻(Alexandrium minimum)、 链状裸甲藻(Gymnodinium catenatum)和太平洋亚历山大藻(Alexandrium pacificum)三种典型的产麻痹性贝毒藻类三维荧光光谱数据, 获取藻类样本的三维荧光光谱等高线图, 并进行图谱分析; 然后, 利用不同激发波长下的发射光谱数据建立产麻痹性贝毒藻三维荧光光谱的串行表示模型, 提取新的特征; 最后, 将新的特征数据分别作为粒子群优化最小二乘支持向量机算法(particle swarm optimization-least squares support vector machine, PSO-LSSVM)和偏最小二乘回归(partial least squares regression, PLSR)的输入, 建立产麻痹性贝毒藻的定量分析模型。 结果表明, 运用粒子群优化最小二乘支持向量机算法建立的产麻痹性贝毒藻的定量分析模型普遍优于偏最小二乘回归算法。 当激发波长选择460和530 nm, 发射波长选择650~750 nm作为PSO-LSSVM的输入数据, 建立的产麻痹性贝毒藻的定量分析模型效果最好, 结果显示 Rc=0.999 9, RMSEC=0.017 1, Rp=0.949 2, RMSEP=0.291 0。 这体现出三维荧光光谱结合PSO-LSSVM定量分析模型可有效地监测活体产麻痹性贝毒藻的浓度数值, 为产麻痹性贝毒藻浓度检测提供了一种在线检测的新方法。
The frequency and area of red tide in China’s coastal areas continue to increase, resulting in serious economic losses. According to the toxic characteristics of red tide, it is usually classified into three categories: non-toxic red tide, ichthyotoxic red tide and toxic red tide. Among them, paralytic shellfish poison is the main toxin produced by toxic red tide. Because of its wide distribution and strong toxicity have become one of the most harmful biological toxins. According to the different intake of paralytic shellfish poisoning, people will feel tingling or burning in various parts of the body after eating shellfish poisoning, and then they will be paralyzed or even die in a short time. Many people have died after eating shellfish. The intake of paralytic shellfish poisoning mainly depends on the concentration of paralytic shellfish poisoning algae. Therefore, it is particularly important to monitor the concentration of paralytic shellfish poison producing algae. In this paper, a quantitative analysis model of paralytic shellfish poison producing algae was established by three-dimensional fluorescence spectroscopy combined with chemometrics. Firstly, The three-dimensional fluorescence spectrum contour map of algae samples were analyzed by f-4600 fluorophotometer, including Alexandrium minimum, Gymnodinium catenatum and Alexandrium. Then, the new features of the three-dimensional fluorescence spectrum of paralytic shellfish poisoning algae were established using the emission spectrum data under different excitation wavelengths. Finally, the new feature was the input of particle swarm optimization least squares support vector machine and partial least squares regression respectively, and the quantitative analysis model of paralytic shellfish poisoning algae was made. The results showed that the quantitative analysis model established by Particle Swarm Optimization- Least Squares Support Vector Machine algorithm was generally better than the partial least squares regression algorithm when using the emission wavelength of 650~750 nm under an excitation wavelength of 460 and 530 nm. The results show that RC=0.999 9, RMSEC=0.017 1, RP=0.949 2, RMSEP=0.291 0. It shows that the three-dimensional fluorescence spectrum combined with the quantitative analysis model of Particle Swarm Optimization- Least Squares Support Vector Machine can effectively monitor the concentration value of paralytic shellfish poison producing algae in vivo, which provides a new online detection method for the concentration detection of paralytic shellfish poison producing algae.
赤潮(red tide)是指水中的微生物由于水体环境及气候等原因大量繁殖导致水体变色的现象[1]。 近年来, 我国沿海地区发生赤潮次数及面积持续增加, 经济损失严重[2]。 其中, 有毒赤潮产生的毒素可以通过食物链的传递导致人体中毒甚至死亡, 在我国东海海域和长江口, 多次发生大规模有毒藻赤潮, 近岸海产贝类的食用安全风险增加[3, 4]。 有毒赤潮产生的毒素中, 麻痹性贝毒(paralytic shellfish poisoning, PSP)由于其分布广, 毒性强而成为危害最大的生物毒素之一[5]。 自1937年, 首次发现链状裸甲藻可产生PSP后, 随后又发现多种藻类可产生PSP, 如亚历山大藻属中的塔玛亚历山大藻(A. tamarense)、 链状亚历山大藻(A. catenella)、 微小亚历山大藻(A. minutum)是产PSP的主要藻类[6, 7]。 PSP是一种神经毒素, 通过与动物神经细胞膜上的钠离子通道位点结合, 抑制钠离子的内流, 阻断神经细胞之间膜电位的传递[8]。 根据PSP摄入量不同, 人类误食染毒的贝类后, 身体各部位会产生不同程度的刺痛甚至麻痹, 中毒严重者会在短时间内死亡。 因此, 产麻痹性贝毒藻浓度是检测PSP摄入量大小的重要指标, 也是后期对产麻痹性贝毒藻预警的关键参考指标。
目前已建立的PSP检测方法[9, 10, 11]有很多种, 应用较广泛的主要有生物检测方法、 免疫法、 化学分析法。 但由于测量时间过长、 速度慢、 产生二次化学污染、 检测频率低等缺陷, 不能实现现场、 快速分析的实时连续测量。 随着近年来荧光检测技术的进步, 三维荧光光谱技术在藻类定量分析方面得到快速发展, 且三维荧光光谱技术日益成熟, 目前已开发出多种应用于石油、 多氯联苯、 生物激素和微藻识别等方面的专业设备[12, 13, 14]。
本文主要基于三维荧光光谱技术结合化学计量学方法对产麻痹性贝毒藻进行浓度值的测量。 通过测量活体产麻痹性贝毒藻的三维荧光光谱, 对荧光光谱矩阵数据进行图像分析, 并将不同激发波长数据进行组合获取产麻痹性贝毒藻类特征, 将特征数据分别作为粒子群优化的最小二乘支持向量机算法[15]和偏最小二乘回归的输入, 建立产麻痹性贝毒藻定量分析模型。
实验所需的活体藻类样本均由暨南大学赤潮与海洋生物学研究中心藻种室于2019年11月份提供; 选取三种产麻痹性贝毒藻类, 包括微小亚历山大藻、 链状裸甲藻、 太平洋亚历山大藻, 共36个样本; 活体藻样本均在海水(将自然海水使用0.45 μm微孔滤膜过滤于锥形瓶中, 121 ℃、 15 psi下灭菌25 min, 冷却到室温)中培养, 其培养液(f/2改良配方配制)、 温度(25 ℃)、 光照强度(60 μmol· m-2· s-1)和光暗循环(L:D=12 h:12 h)均按理想条件设定; 每天固定时间取样于显微镜下用0.1 mL浮游植物计数框进行藻细胞计数, 绘制生长曲线, 确定藻类的生长期; 待产麻痹性贝毒藻处于对数期浓度最高时取出, 用过滤后的海水稀释10倍、 100倍、 1 000倍, 摇匀, 获得不同浓度梯度下的产麻痹性贝毒藻的样本。
采用日本日立公司生产的F-4600荧光光谱仪采集光谱。 光程为10 mm×10 mm的无荧光石英比色皿中, 激发波长λ ex范围设置为400~600 nm, 步长为10 nm, 发射波长λ em范围设置为650~750 nm, 步长为10 nm, 狭缝宽度5 nm, 扫描速率为30 000 nm· min-1, 光电倍增管电压为700 V, 激发光源为150 W的氙灯; 为减小荧光强度随仪器和光源使用时间变化引起的差异, 保证测量的准确性, 每次采集之前光谱仪先预热20 min, 测量3次后取平均值作为最终测量结果。 以上数据采集均与活体藻类样本取出为同一时间。
实验测得三种产麻痹性贝毒藻不同浓度下共36个样本的三维荧光光谱数据。 其中微小亚历山大藻的浓度分别为103, 104和105 cells· mL-1; 链状裸甲藻浓度分别103, 104, 105和106 cells· mL-1; 太平洋亚历山大藻浓度分别为103, 104, 105和106 cells· mL-1, 利用origin2017软件绘出藻类的三维荧光光谱图。 图1(a)—(d)为不同浓度下链状裸甲藻的等高线图; 图2(a)—(d)为不同浓度下太平洋亚历山大藻的等高线图; 3(a)—(c)为不同浓度下微小亚历山大藻的等高线图。
从图1中可以看出, 产麻痹性赤潮藻的荧光峰位置分布在激发波长为410~560 nm范围内, 不同浓度的产麻痹性贝毒藻因为藻种的不同, 相同浓度下的荧光强度值也会存在差异。 因此, 需要探寻最优发射波长取值范围以及借助化学计量学方法建立产麻痹性贝毒藻的定量分析模型。
为了确定产麻痹性贝毒藻定量分析模型的最佳发射波长范围, 本文利用产麻痹性贝毒藻发射波长范围为650~700和650~750 nm的三维荧光光谱数据进行产麻痹性贝毒藻浓度建模, 选取最优的光谱区间。
获取36个产麻痹性贝毒藻样本的单一激发波长下, 发射波长范围分别为650~700和650~750 nm的光谱数据作为PSO-LSSVM的输入数据; 随机选取24个样本作为训练集, 其余12个样本作为预测集; 为了减少浓度值的量级差给模型带来的影响, 将产麻痹性贝毒藻浓度值103, 104, 105和106 cells· mL-1统一取对数得到浓度值对应的输出值分别为3, 4, 5和6; 基于PSO-LSSVM算法构建产麻痹性贝毒藻特征数据与新浓度值数据之间的相互关系, 得到的预测浓度值再取10的幂次方, 恢复原始等量级浓度值, 进行模型评价。
从建立的产麻痹性贝毒藻定量分析模型中得到训练集和预测集的相关系数(correlation coefficient, R)和均方根误差(root mean square error, RMSE)如表1所示。 其中RMSEC, RMSEP, Rc和Rp分别是训练集均方根误差、 预测集均方根误差、 训练集相关系数和预测集相关系数。
| 表1 单一激发波长下产麻痹性贝毒藻的PSO-LSSVM定量模型结果 Table 1 Results of PSO-LSSVM quantitative model for paralytic shellfish algae under single excitation wavelength |
从表1中可以看出, 在单个激发波长下, 对比发射波长范围在650~700 nm的产麻痹性贝毒藻定量模型, 发射波长范围在650~750 nm的产麻痹性贝毒藻定量模型的相关系数更趋近于1, 均方根误差也较小。 因此, 以下选择发射波长范围在650~750 nm的产麻痹性贝毒藻分别建立PSO-LSSVM和PLSR的定量分析模型。
针对36个产麻痹性贝毒藻样本, 选取激发波长是410~560 nm, 发射波长在650~750 nm范围内的三维荧光光谱数据作为PLSR算法的输入, 随机取得24个样本作为训练集, 其余12个样本作为预测集, 建立单一激发波长下的产麻痹性贝毒藻的定量分析模型, 得到基于PLSR算法的部分预测集的均方根误差和相关系数如表2所示。
| 表2 单一激发波长下PLSR算法的定量模型结果 Table 2 Quantitative model results of PLSR algorithm under single excitation wavelength |
从表1和表2中可以看出, 对比PLSR算法, 单一激发波长下利用PSO-LSSVM对产麻痹性贝毒藻建立的定量分析模型误差较小, 相关系数也更高。 因此, 以下采用PSO-LSSVM算法对产麻痹性贝毒藻进行定量分析。
针对36个产麻痹性贝毒藻样本, 根据穷举法从410~560 nm中选取两个激发波长, 发射波长范围在650~750 nm的产麻痹性贝毒藻数据进行串行组合, 建立基于PSO-LSSVM算法的定量分析模型, 得到的RMSEC、 RMSEP、 Rc和Rp部分结果如表3所示。
| 表3 两个激发波长下PSO-LSSVM算法的定量模型结果 Table 3 Quantitative model results of PSO-LSSVM algorithm with two excitation wavelengths |
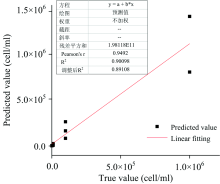
从表3中可以看出, 当激发波长选择460和530 nm, 发射波长选择650~750 nm作为PSO-LSSVM的输入数据, 建立的产麻痹性贝毒藻的定量分析模型效果最好。 产麻痹性贝毒藻类训练集和预测集中预测值和真值的关系如图4所示, 其中横坐标为样本个数, 纵坐标为真实浓度值取对数所对应的输出数值。
从图4可知, 训练集中预测值和真值几乎重合, 模型训练效果较优; 预测集中预测值和真值也有较好的相关性。 将图4中输出浓度值取10的幂, 恢复成产麻痹性贝毒藻的原始浓度值, 并将预测值与真实值做线性拟合, 拟合结果如图5所示。 从图5中可以看出, 虽然预测集中预测值和真值的相关系数Rp为0.9492, 但也需要进一步优化模型。
采集实验室培养的不同浓度下的微小亚历山大藻、 链状裸甲藻和太平洋亚历山大藻, 共36个产麻痹性贝毒藻的三维荧光光谱数据; 建立激发波长为410~560 nm、 发射波长范围为650~750 nm的单一激发波长和两个激发波长组合的表示方法; 基于串行组合后的产麻痹性贝毒藻三维荧光光谱数据, 随机选取24个样本作为训练集, 其余12个样本作为预测集, 建立PSO-LSSVM和PLSR的产麻痹性贝毒藻定量分析模型。 结果表明, 当激发波长选择460和530 nm, 发射波长选择650~750 nm作为PSO-LSSVM的输入数据时, 建立的产麻痹性贝毒藻的定量分析模型中训练集的决定系数为0.999 9, 建模均方根误差RMSEC为0.017 1; 预测集的决定系数为0.949 2, 预测均方根误差RMSEP为0.291 0; 建立的定量数学模型效果较好, 可以通过得到的三维荧光数据较准确地检测活体产麻痹性贝毒藻浓度数值, 为产麻痹性贝毒藻的监测提供了一种新方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|