作者简介: 周子皓, 1995年生, 华东师范大学精密光谱科学与技术国家重点实验室硕士研究生 e-mail: zihaozh1995@163.com
当前, 有关量子点pH响应方面的研究主要集中在含Cd(镉)类量子点, 且都是研究其稳态荧光光谱对pH值的响应。 然而, Cd类量子点对生物体系具有一定的毒性, 且稳态荧光光谱法由于受浓度等因素的影响具有一定的不稳定性, 因此应用于生物体系中作为pH探针具有明显的缺点。 基于以上分析, 通过水相合成法, 我们制备出了基于谷胱甘肽配体的水溶性ZnSe量子点, 该量子点具有毒性小, 生物兼容性好等特点, 适合被应用于生物体系中。 利用所制备的ZnSe量子点, 采用时间相关单光子计数技术, 结合紫外可见吸收光谱和稳态荧光光谱, 对pH值在5~11不同环境下的ZnSe量子点荧光动力学进行了系统性的研究。 ZnSe量子点荧光衰减具有两个寿命组分, 拟合得到分别为4和24 ns。 通过采集不同探测波长下ZnSe量子点荧光衰减曲线, 发现其长寿命组分随探测波长的增加而增加, 而短寿命组分基本不随探测波长的改变而改变, 结合有关报道分析判断, 短寿命和长寿命组分分别来源于核内非局域载流子复合和表面态局域载流子复合。 实验发现, 处于不同pH值的环境下的ZnSe量子点具有不同的荧光寿命, 其荧光寿命与pH值的变化呈负相关。 通过比较ZnSe量子点两种荧光寿命组分随pH值的变化关系, 发现ZnSe量子点的荧光寿命对pH值的响应主要来源于长寿命组分即表面态寿命, 且在不同pH值范围内响应的灵敏度不同, 在6~8的pH值范围内响应最为显著, 表现为长寿命组分随pH值的增加出现一个较大幅度的衰减。 实验进一步发现, ZnSe量子点两个寿命组分的比值在不同pH值范围内具有较好的线性相关性, 但在不同pH值范围内斜率不同, 通过比较, 最大值在pH值为6~8的范围内。 另外, 与金属钠离子相互作用实验及相关报道表明, 金属离子对ZnSe量子点荧光寿命的影响较小。 以上研究表明, ZnSe量子点在生物体系pH值检测中具有良好的应用前景。
At present, the research on the pH response of quantum dots mainly focuses on quantum dots containing Cd, and study only the response of steady-state fluorescence spectrum to pH value. However, quantum dots containing Cd have certain toxicity to the biological system, and the steady-state fluorescence spectrometry has certain instability due to the influence of concentration and other factors, so the application of quantum dots containing Cd as pH probes in biological systems has obvious disadvantages. Based on the above analysis, water-soluble ZnSe quantum dots based on glutathione ligand were made by the water phase synthesis method, showing the characteristics of low toxicity and good biological compatibility, which is suitable for application in biological systems. The fluorescence dynamics of ZnSe quantum dots under different pH values from 5 to 11 have been systematically studied by using time-correlated single-photon counting technique, UV-VIS absorption and steady-state fluorescence spectroscopy. Two fluorescence decay lifetime components of ZnSe quantum dots were found around 4 and 24 ns. By collecting fluorescence decay curves of ZnSe quantum dots at different detection wavelengths, it was found that the long-lifetime components increased with the increment of detection wavelength, while the short-life components did not change with the change of detection wavelength. It is concluded that the short life and long-life components were derived from non-local carrier recombination in the nucleus and local carrier recombination in the surface state, respectively. In addition, it was found that ZnSe quantum dots under different pH values showed different fluorescence lifetimes, and the fluorescence lifetime was negatively correlated with pH change, which was mainly derived from the surface state lifetime components. The sensitivity responding to the pH values was different, which maximized in the pH value range of 6~8, showing a large decay with the increase of pH value for the surface state lifetime components. It was further found that the ratio of two-lifetime components of ZnSe had a good linear correlation with all the pH values, but the slope was different in different pH ranges. The maximum value was within the range of 6~8. The interaction experiments with metal sodium ions and related reports show that metal ions have little influence on the fluorescence lifetime of ZnSe quantum dots. The above studies show that ZnSe quantum dots have a good application prospect in the pH detection of biological systems.
大量研究表明, 生物体系所处环境的pH值, 对生物体许多生命活动具有十分重要的影响。 例如, 细胞内酶活性的调节[1]、 细胞的生长与分化, 以及细胞凋亡等[2], 生物体中某些疾病的发生也与生物系统内pH值的异常变化有关[3]。 所以, 监测生物体内pH值的变化, 对了解生物体所处状态具有重要意义。 目前, 较为常用的几种测定生物体系pH值的方法有核磁共振影像法、 微电极法、 荧光光谱法等等[4]。 其中, 由于荧光光谱技术具有操作简单、 重复性好等优点, 常被用做实验中pH值的检测[4]。
半导体量子点是众多纳米材料的一种, 其三维空间尺寸均在纳米量级, 因此具有许多独特的物理化学性质。 比如, 量子点具有较大的比表面积, 其内部包含原子较少, 几乎所有原子都处于表面状态[5], 量子点的表面剩余价键增多[6], 出现较多的活性中心, 导致其具有较强的表面与界面效应, 使得量子点表面对周边环境具有较大的灵敏性[7]。
研究发现, 量子点由于表面结构对pH值具有较强的灵敏性[8], 因而人们常利用其对pH值的响应来研究生物体系pH值的变化[9]。 目前, 量子点对pH值的响应在生物领域已有较多实例。 Deng等[10]通过制备pH敏感的CdTe量子点作为pH值荧光探针来实现对病毒的检测; Li等[11]通过合成对巯基苯胺包覆的CdSe/ZnS量子点, 被用来作为检测水相中pH值的荧光探针; 当前有关量子点pH响应方面的研究主要集中在含Cd类量子点, 且都是研究其稳态荧光光谱对pH值的响应。 然而, Cd类量子点对生物体系具有一定的毒性, 且稳态荧光光谱法由于受浓度等因素的影响具有一定的不稳定性, 因此应用于生物体系中作为pH探针具有明显的缺点。
研究证实[12], ZnSe量子点具有生物毒性小, 生物相容性好等特点, 非常适合应用于生物体系中。 本文通过水相合成法制备了以谷胱甘肽为配体的ZnSe量子点并研究了其荧光寿命对不同pH值的响应规律。
研究所使用的主要化学试剂, 均来源于商业购买, 且使用时均未进一步纯化。 硒粉(Selenium, Se), 分析纯, 98%, 上海阿拉丁试剂公司; 二水合醋酸锌(Zinc acetate dehydrate, ZnAc2· 2H2O), 分析纯, 98%, 国药试剂有限公司; 谷胱甘肽(L-glutathione, GSH), 分析纯, 98%, 阿拉丁试剂公司; 硼氢化钠(Sodium borohydride, NaBH4), 分析纯, 98%, 阿拉丁试剂公司。
稳态吸收光谱数据的采集是使用紫外-可见分光光度计(TU1901, 北京普析通用仪器有限责任公司)。 仪器可在190~900 nm波长范围内进行探测, 波长准确度± 0.3 nm。
稳态荧光光谱采用的是Horiba公司生产的FluoroMax4型荧光光谱仪, 稳态荧光光谱激发波长为298 nm, 狭缝宽度设定为光谱分辨率1 nm/1 nm。 因为不同波长光源的发射功率不一样, 且探测器在不同波长下的探测效率也不一样, 所以我们在检测样品的稳态荧光光谱时选用S1c/R1c。
时间分辨荧光光谱的采集使用的时间相关单光子计数(TCSPC)设备为我们课题组自行搭建[13], 实验中使用的激发光源为半导体脉冲激光器(PDL 800-B, PicoQuant), 中心波长为298 nm, 功率为1 μW, 重复频率为10 MHz, 系统仪器响应时间分辨率为200 ps。
(1)ZnSe量子点的合成及提纯
ZnSe量子点的合成主要参照Zhang等[14]的研究工作, 通过水热合成法合成出了以谷胱甘肽作为配体的水溶性ZnSe量子点, 合成所用Zn2+:Se+:GSH为1:0.4:1.3。 将22 mg硼氢化钠和700 μL水加入5 mL的玻璃瓶中, 向其中加入15.8 mg硒粉, 使之充分反应, 得到硒氢化钠溶液。 再将109.75 mg醋酸锌和200 mg谷胱甘肽溶于20 mL水中, 用1 mol· L-1的氢氧化钠调节pH值到11.5, 将反应制得的硒氢化钠溶液加入其中, 混合溶液在100 ℃油浴下, 磁力搅拌加热2 h, 制得ZnSe量子点原液。 将所合成的ZnSe量子点原液, 加入1.5倍体积的异丙醇, 以8 000 r· min-1离心3 min, 去除上层清液, 将所得白色固体真空干燥, 得到提纯后的ZnSe量子点固体并保存于4 ℃冰箱中, 以备后续实验使用。
(2)ZnSe量子点的表征
取上述制备的ZnSe量子点固体1 mg, 加入去离子水并稀释至1 mmol· L-1(以Zn2+浓度计), 得到ZnSe量子点溶液。 取1 mL所配制的ZnSe量子点溶液, 使用稳态荧光光谱仪和紫外吸收可见分光光度计测量其荧光光谱和吸收光谱。
取200 μL所配制的ZnSe量子点溶液, 滴在超薄微型铜网上, 晾干后, 采用透射电子显微镜对其形貌特征进行表征。
(3)ZnSe量子点在不同pH值中及与Na+相互作用的光谱表征
分别取所配制的不同pH值的0.2 mol· L-1的PBS缓冲液2 mL, 依次向其中加入配制的浓度1 mmol· L-1的ZnSe量子点溶液200 μL, 摇匀, 静置2 min后, 采用稳态荧光光谱仪和时间单光子计数分别采集其荧光光谱和时间分辨荧光光谱。 取两份2 mL的pH值为7的PBS缓冲液, 并分别向其中加入200 μL量子点溶液, 然后, 向其中一份加入200 μL配制的1.8 mol· L-1的NaCl溶液, 另一份加入200 μL去离子水, 分别摇匀, 静置2 min后, 分别测定其时间分辨荧光光谱。
图1为ZnSe量子点吸收、 荧光光谱及TEM形貌表征。 从图1(a)可以看出, 所制备的ZnSe量子点荧光发射峰在375 nm附近且半峰宽在20 nm左右, 第一激子吸收峰在360 nm处, 该结果与文献报道吻合。 通过透射电子显微镜观察[图1(b)], 合成的ZnSe量子点近球形, 分散性较好, 粒径尺寸在3 nm左右且分布较集中。 以上结果证明制备出了较好的纳米级ZnSe量子点。
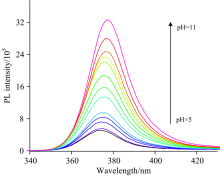
通过调节不同pH值的PBS缓冲液, 我们每间隔0.5, 分别测定了5~11范围内不同pH值下ZnSe量子点的稳态荧光光谱, 在此pH值范围ZnSe量子点能够稳定存在, 测量的结果如图2所示。 图2展示了ZnSe量子点不同pH值下的荧光峰, 从图中可以看出, 在所考察的pH值范围内, ZnSe量子点荧光强度随pH值的增加而增强, 变化趋势呈正相关, 并且荧光峰伴随pH值的增加产生稍微的红移, 峰的位置由374 nm移动到377 nm处。 究其原因, 可能是由于在较低pH值下, 表面配体质子化从配体表面脱落, 脱离表面时带走表面原子, 使得量子点尺寸减小, 从而在较低pH值下, 量子点发光峰波长较短。 ZnSe量子点荧光特性随pH值的变化说明pH值对量子点的发光态具有影响, 其机制是不同pH值下, 配体具有不同的状态[8, 15]。 相关文献报道, 由于谷胱甘肽分子在不同pH值下, 其分子内羧基和氨基基团的质子化和去质子化程度不同, 导致谷胱甘肽配体分子在不同pH值下与Zn2+的配位结构不同[14], 使得配体分子对量子点表面的包覆程度不同, 进而使量子点的表面出现不同状态。 当pH值增加时, 谷胱甘肽配体分子更易去质子化, 其与Zn2+配位程度将更加紧密, 导致ZnSe量子点表面缺陷态减少, 使得ZnSe量子点荧光强度增加。
从ZnSe量子点的稳态荧光光谱可以看出, 其荧光强度随pH值增大而增加。 为此, 我们从荧光动力学的角度考察了pH值对ZnSe量子点荧光特性的影响。 图3是在不同pH值下, ZnSe量子点在发射波长为375 nm处的时间分辨荧光动力学曲线。 从图中可以看出, ZnSe量子点的荧光寿命随pH值的增加变小。 对不同pH值下得到的荧光动力学曲线我们通过双指数函数可以得到很好的拟合
拟合得到两个荧光寿命组分, 分别为一个大约为24 ns的长寿命组分τ 1和一个大约为4 ns的短寿命组分τ 2, α 1和α 2分别为荧光寿命组分的振幅, 并通过式(2)
计算得到了整体的平均寿命[16]。 图4(a)为平均寿命随pH值的变化曲线, 可以看出, ZnSe量子点的平均寿命随pH值的增加而呈减小趋势, 且pH值在6~8的范围内, 其平均寿命随pH值的改变最为明显, 出现一个较大幅度的衰减。 从图4(b)中可以看出, 长寿命τ 1随pH值的变化曲线和平均寿命变化曲线一致, 而短寿命τ 2随pH值的变化不明显, 但总体有上升的趋势。 另外, 从表1中可以看出, τ 1组分占比下降, τ 2组分则占比上升, 且同样在6~8的pH值范围内出现一个较显著的变化。 以上实验结果表明, pH值的改变主要影响ZnSe量子点τ 1所对应的荧光衰减组分, 且在6~8的pH值的范围内, ZnSe量子点的荧光寿命对pH值的响应较为灵敏。
 | 图4 ZnSe量子点平均寿命(a)和两种荧光寿命组分(b)随pH值的变化曲线Fig.4 Fluorescence average lifetime (a) and two lifetimes (b) vs. pH values |
| 表1 拟合得到的各组分的荧光寿命及其振幅 Table 1 Fluorescence lifetimes and amplitudes of each component at different pH values |
为了确认拟合得到的两个不同的寿命的来源, 我们进一步考察了pH值分别为6, 7和8的环境下, 不同探测波长的荧光动力学并进行拟合得到荧光寿命, 其结果展示于图5。 在三种pH值下, ZnSe量子点的τ 1均随探测波长的增加而增大, 而τ 2与波长的相关性不大。 Zhao等[17]的研究结果证实, 量子点的长寿命会随波长的变化而变化, 而短寿命则不依赖于波长的改变而改变。 τ 1的来源为表面态的局域载流子的复合, 而τ 2则来源于核内非局域载流子的复合[16, 17]。 以上分析进一步说明, pH值对量子点表面态产生了显著影响进而导致量子点的荧光特性的改变。 对于ZnSe量子点来说, 由于表面谷胱甘肽配体对pH值敏感, pH值的改变会导致谷胱甘肽配体的质子化程度的变化, 从而影响与量子点表面的配位方式, 导致其表面状态的改变[6]。 当pH值减小时, 谷胱甘肽配体质子化, 导致其与ZnSe量子点表面Zn2+配位紧密程度下降, 从而导致其表面态的增加, 载流子将更多的迁移到表面, 使得τ 1组份增加。 另外, 由于实验所测量的荧光衰减曲线包含辐射弛豫和无辐射弛豫, 是两种弛豫方式综合叠加的结果, 所以荧光衰减寿命由辐射跃迁速率Γ r和无辐射跃迁速率Fnr来表示
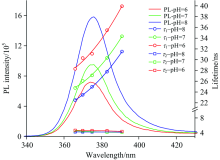 | 图5 pH值为6, 7, 8时ZnSe量子点稳态荧光光谱及荧光寿命随发射波长的变化曲线Fig.5 Steady-state fluorescence spectra and fluorescence lifetimes of ZnSe quantum dots vs. emission wavelength when pH value is 6, 7 and 8 |
辐射和非辐射跃迁速率的改变都会影响整体荧光寿命的改变。 通过稳态荧光实验得到, 当pH值增加时, ZnSe量子点荧光强度上升, 说明其辐射跃迁速率Γ r上升, 且无辐射跃迁速率Γ nr下降[18]。 根据式(3)并结合时间分辨荧光光谱实验结果分析得出, pH值的增加使ZnSe量子点表面态辐射跃迁速率的增加量要大于无辐射跃迁速率的减小量, 从而ZnSe量子点表面态荧光寿命随pH值的增加而减小。
由于ZnSe量子点荧光寿命对pH值的变化具有响应, 我们对拟合得到的两种不同的寿命组分进行比值τ 1/τ 2计算, 发现其比值在不同的pH值范围内随pH值的变化具有一定的线性相关性, 结果展示于图6。 从图中可以看出, 在不同pH值范围内, τ 1与τ 2的比值所呈的线性斜率不同, 在pH为6~8的范围内, 其随pH值变化的线性斜率最大(k=-0.63, R2=0.993), 说明在此范围内ZnSe量子点的寿命对pH值的变化最为灵敏, 可作为pH值探针应用于生物体系中。
另外, 生物体系中由于存在多种金属离子, 需要考察这些金属离子是否会对量子点荧光寿命产生影响。 为此我们研究了生物体系中存在最多的金属钠离子Na+对ZnSe量子点荧光寿命的影响。 由于生物体系pH值一般在7附近, 为了与生物体系相符合, 我们在pH值为7的环境下, 测定了有无NaCl时, ZnSe量子点溶液的荧光动力学, 拟合得到平均寿命分别为24.7和24.9ns, 两者寿命差别不大, 表明Na+对ZnSe量子点的荧光寿命影响较小。 另据文献报道, 其他金属离子对ZnSe量子点会产生猝灭效应, 但其猝灭方式为静态猝灭[19, 20], 因此说明金属离子对ZnSe量子点的荧光寿命影响不大。 综上分析, ZnSe量子点荧光寿命对pH值的响应作为一种pH值的检测方法应用在生物体系中具有一定的潜力。
通过测定ZnSe量子点在不同pH值下的荧光衰减曲线, 我们发现其在不同pH范围内对pH具有不同的响应灵敏性。 通过拟合荧光动力学曲线, 得到两个一快一慢的寿命组分τ 1和τ 2。 分析两寿命组分各自随pH值变化规律, 发现长寿命组分对pH值的变化响应较大, 并确定长寿命组分来源于量子点表面态发光, 说明ZnSe量子点荧光寿命对pH值的响应主要因其表面状态的改变。 另外, τ 1和τ 2的比值在不同pH值范围内具有一定的线性相关性, 且在不同pH值范围内线性斜率不同, 在pH值为6~8的范围内具有最大的线性斜率, 表明在此范围内其荧光寿命对pH值的变化最为灵敏。 由于荧光寿命相较于稳态荧光强度不受溶液浓度及强度等影响, 所以ZnSe量子点荧光寿命对pH值的响应特性在生物体系pH值检测中具有良好的应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|