作者简介: 叶若柏, 1979年生, 福建农林大学食品科学学院博士研究生 e-mail: 354650728@qq.com
拟设计在体内低毒、 靶向肿瘤细胞的抗癌多肽(记: GPG), 克服在抗癌治疗中使用化学类药物存在的缺点, 探讨用荧光光谱评价靶向肽对肿瘤肿块包覆状况的方法; 进行仅用一组基于双报告基团的小鼠模型(用EGFP转染的鼠肝肿瘤细胞H22, 记: H22-EGFP与荧光染料Cy7标记的GPG, 记: Cy7-GPG, 作报告基团), 就能完成抗癌肽体内主要性能监测的研究。 用H22-EGFP构建小鼠移植瘤模型, 尾静脉注射Cy7-GPG后, 用成像仪(Ex=750 nm)观察到肿瘤的荧光光子数不断增大, 从第4 h的(3.90±0.260)×106 photons·(s·cm2)-1(单位下同)升至第24 h的(1.28±0.330)×108, 橙色荧光全部聚集到肿瘤上, 而对照组中Cy7的荧光没有聚集在肿瘤上, 且肿瘤上光子数也无明显变化; 此时, 用成像仪在实验组同一只鼠上, 分别用750和488 nm激发波长录得包覆状物和实际肿瘤肿块的图片, 表明它们的大小和形状一致; 以上两项测定后, 再每2 d一次往上述实验组鼠体内注射GPG, 在成像仪上(Ex=488 nm)监测到它们的肿瘤变小, 荧光光子数逐渐降低, 从第2 d的(4.15±0.291)×106降至第56 d的(4.75±0.283)×104, 空白对照组正相反。 GPG与化学药物环磷酰胺抗癌活性相当, 但后者对小鼠毒副作用严重; 最后, 往上述GPG药效实验组鼠体内注射Cy7-GPG, 48 h后处死小鼠, 取出内脏器官及肿瘤肿块, 在成像仪上(Ex=750 nm)录得它们的荧光光子数。 实验表明GPG靶向性强、 对肿瘤肿块包覆程度高、 药效强, 对其他主要脏器无毒副作用。 本文构建的基于双报告基团荧光成像模型, 可监测靶标被包覆状况, 克服了传统只能对靶向肽靶向功能进行评价的弊端, 增进对药物作用机理的认识; 本文仅消耗一组实验鼠模型, 节约实验成本、 简捷地监测了靶向肽主要性能, 表明GPG在体内性能较好, 具有应用价值。
This paper explores the in vivo action of an anti-cancer polypeptide (denoted by: GPG) with low toxicity that targets tumor cells. This aims to overcome the limitations of current anti-cancer therapy, and explores tumor evaluation and mass coverage status with the targeting peptide, by the use of spectrofluorimetry. The study focuses on monitoring the main actions of the anti-cancer peptide in vivo, with only one set of mouse models based on dual reporter dyes (H22 hepatocarcinoma cell transfected with EGFP, denoted by H22-EGFP, and GPG labeled with fluorescent dye Cy7, denoted by Cy7-GPG, were used thereof). A transplanted tumor mouse model was constructed with H22-EGFP and Cy7-GPG was injected in the tail vein. The imager(Ex = 750 nm) revealed that the number of fluorescent photons in the tumor increased continuously from (3.90±0.260)×106 photons·(s·cm2)-1 at the 4th hour (the same unit below) to (1.28±0.330)×108 at the 24th hour. Orange fluorescence accumulated on the tumor completely, with no fluorescence accumulation on the tumor in the Cy7 control group. There was no significant change of fluorescent photon number on the tumor as well. At this time, images of the coating Cy7-GPG and actual tumor mass in the same experiment mouse were recorded, at 750 and 488 nm excitation wavelength respectively, indicating that they were of the same size and shape. Subsequently, GPG was injected into the mice in each of the experimental groups every 2 days. The imager(Ex = 488 nm) revealed the tumor had become smaller, while the number of fluorescent photons gradually decreased from (4.15±0.291)×106 on the 2nd day to (4.75±0.283)×104 on the 56th day. However, the condition of the blank control group was just the opposite. The anti-cancer activity of GPG was comparable to cyclophosphamide. However, the latter had more serious toxic side effects on mice. Finally, mice in the GPG efficacy experiment group were injected with Cy7-GPG and were then sacrificed 48 hours later, with the internal organs and tumor masses extracted for recording the number of fluorescent photons using the imager(Ex=750 nm). The experiment showed that GPG had precise targeting, wider coverage, and strong efficacy, with no toxic or side effects on other organs. The fluorescence imaging model constructed using dual reporter dyes used in this paper was utilized to monitor the coverage of targets; it overcame the limitations of the traditional evaluation method for targeting the function of peptide and improved the understanding of the mechanism of drug action. Only one set of mouse models was used in this experiment. Hence the main performance of the targeting peptide was monitored in a simple and cost-effective manner, indicating that GPG has excellent performance and useful application in vivo.
人类至今还未找到理想的抗肿瘤方法, 化学药物抗肿瘤是重要的治疗癌症的方法之一[1], 但由于其在治疗中存在的不足, 使得在临床应用受到限制[2]。 很多多肽具有抗癌活性, 且无化疗药物的缺点[3]。 然而天然多肽不完美[4], 设计低毒、 靶向肿瘤细胞、 抗癌活性强的多肽是研究的热点领域[5], 据此设计了阳离子多肽(记: GPG, 其氨基酸序列为GRGDSPKFLHSAKKFGKAFPAVLKVLTTG)[6], 探讨对多肽(GPG)进行体内性能评价的方法。
传统一般只对多肽活性进行体外评价[7], 然而生物体内环境复杂, 对多肽在体内活性影响很大, 导致多肽大多被开发成用于体表的临床药物[8]。 具有快捷、 选择性好, 且灵敏度高的分子荧光光谱技术已应用到很多研究领域[9], 用绿色荧光蛋白(如EGFP)转染的肿瘤细胞构建荷瘤小鼠模型[10], 在小动物活体成像仪上可以评价药物的药效[11]。 用成像仪跟踪被荧光染料(如: Cy7)标记的药物在荷瘤模型上的行踪, 可以评价药物的靶向性[12], 但上述两种单报告基团的实验模型不能同时反映靶向药物靶向至肿瘤肿块后, 形成的对肿瘤肿块包覆物的大小与形状及由绿色荧光蛋白转染的肿瘤细胞所呈现的肿瘤肿块本身的大小和形状, 因此无法比较被包覆物与肿瘤肿块的大小与形状, 从而无法评价靶向物对靶标的包覆程度。 靶向肿瘤细胞多肽对被靶肿瘤肿块的包覆程度决定了靶向肽对肿瘤细胞膜的作用面积, 其直接影响靶向肽的药效[13]。 且用单报告基团模型评价药物靶向性及药效时, 一般使用不同的实验小鼠模型, 浪费了资源与时间。
探讨在同一小鼠体内构建基于双报告基团的荧光光谱实验模型, 在成像仪上监测靶向肽对被靶肿瘤肿块的包覆状况, 克服传统方法只能评价靶向肽靶向功能的弊端, 对多肽的作用机理进行更深入研究; 研究仅消耗一组荷瘤小鼠实验模型, 可连续对多肽在体内的靶向性、 包覆肿瘤肿块状况、 抗肿瘤药效和在体内分布及代谢情况进行简单、 快捷的分析, 节约实验成本, 为设计性能更优的抗癌肽提供实验基础。
小动物活体成像仪(IBCX.Scientia); Cy7购自Lumiproble; 荧光染料Cy7标记的GPG(记: Cy7-GPG, Ex=750 nm), 含量96.2%, 上海生工公司加工; 绿色荧光蛋白EGFP转染的小鼠肝肿瘤细胞H22(记: H22-EGFP, Ex=488 nm), 转染率为99.73 %, 购自武汉百翼生物有限公司; 实验鼠(清洁级, (15~20) g·只-1)向凯学科技公司(上海)购买。
取浓度为1×107个·mL-1处于对数生长期的H22-EGFP悬浮液接种于小鼠背部(0.5 mL·只-1), 12 d后, 用成像仪(Ex=488 nm)观察到鼠背部形成直径约(0.6~0.8) cm的肿瘤肿块, 肿块荧光光子数达(8.12±0.233)×106 Photons·(s·cm2)-1(单位下同), 表明荷瘤模型建立成功。
靶向性实验: 实验组由5只模型鼠组成, 尾静脉注射浓度为1 mg·L-1的Cy7-GPG(0.1 mL·只-1)。 同法建立注射Cy7的对照组。 在不同检测时点前6 h, 全部禁食, 到时点麻醉, 用成像仪(Ex=750 nm)录得它们的荧光图片, 在各组荧光图片肿瘤区勾画出感兴趣区, 录得它们的荧光光子数, 实验进行至48 h结束。 表1为部分不同时点各组荧光光子数平均值。 图1(a)为在不同时点上实验组中一只鼠的荧光图片, 图1(b)为对照组的图片。
| 表1 不同时点实验组和对照组感兴趣区荧光光子数 Table 1 Fluorescence intensity in tumor region for experiment group and control group at different time |
 | 图1 不同时点实验组(a)与对照组(b)小鼠体内荧光分布Fig.1 The distribution of fluorescence intensity in experiment (a) and control (b) groups of mice at different time |
包覆状况实验: 当上述实验进入第24 h测定时点时, 先将Cy7-GPG实验组鼠进行本项实验。 任取其中一只鼠, 用成像仪分别在488和750 nm激发波长下, 录得肿瘤区荧光图2(a)和图2(b), 并以图2(a)中的A, B和C为感兴趣区, 录得它们的荧光光子数, 以图2(b)中的D, E和F为感兴趣区, 录得它们的荧光光子数。
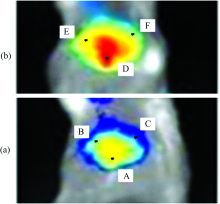 | 图2 同一肿瘤肿块在488 nm(a)和750 nm(b)下荧光图Fig.2 Fluorescence photographs for the same tumor mass under 488 nm (a) and 750 nm (b) wavelength |
体内药效实验: 本项试验由A, B, C和D四组组成。 A组: 荷瘤空白对照组; C组: 由原靶向实验中5只注射Cy7-GPG实验鼠组成, 在靶向实验结束后的第2天用于本组实验; 为比较GPG的药效还设置了B和D两实验组, A, B和D各组均5只模型鼠。 各实验组每2 d从尾静脉注射药剂一次, B: 环磷酰胺(CTX, 1.44 mg·mL-1, 0.5 mL·只-1); C: GPG(100 μmol·L-1, 0.5 mL·只-1); D: (CTX 1.44 mg·mL-1, 0.25 mL·只-1; GPG 100 μmol·L-1, 0.5 mL·只-1)。 全部鼠在每次给药前6 h禁食、 到时点麻醉, 先用成像仪录得它们的荧光图片(Ex=488 nm波长激发下), 后给药。 在各鼠荧光图片肿瘤上的感兴趣区读得它们各时点上的荧光光子数, 各组部分时点荧光光子数平均值见表2, 图3为各组任一只鼠在用药2和48 d时录得的荧光图片。 实验中每天记录小鼠的生活状况。
| 表2 不同时点各组小鼠肿瘤上感兴趣区的荧光光子数 Table 2 Fluorescence intensity in the tumor region for each group of mice at different tim |
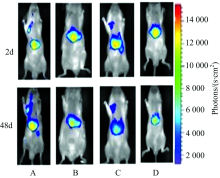 | 图3 A, B, C和D组小鼠给药2 d与48 d荧光图Fig.3 Fluorescence photograph for A, B, C and D group of mice at the 2nd and 48th day |
GPG在体内脏器的分布及代谢实验: 将药效实验时的C组全部小鼠, 在药效实验结束3天后用于本项实验, 从尾静脉注射Cy7-GPG(1 mg·L-1, 0.1 mL·只-1), 48 h后处死小鼠, 取出主要内脏及肿瘤肿块, 在成像仪上(Ex=750 nm)测得它们的荧光光子数, 结果如图4所示。
以SPSS19.0软件处理数据, p< 0.05, 差异有统计学意义。
Cy7是荧光染料, 根据荧光强度的线性分布理论, 其由低到高按“ 紫→蓝→绿→黄→红→橙” 的颜色依序变化, 由图1(a)可见, 实验组注射Cy7-GPG后, 随着时间推移, 橙色荧光向小鼠肿瘤区聚集, 到24 h时橙色荧光全部聚集到肿瘤上, 体内其他部位没有发现橙色荧光聚集。 表1示出, 随着Cy7-GPG向肿瘤聚集过程, 小鼠体内肿瘤处荧光光子数不断增加, 到第24 h达最大值, 然后又逐渐下降。 此间对照组图1(b)小鼠体内肿瘤上颜色及表1示出的小鼠肿瘤处荧光光子数均无明显变化, 表明GPG有较强的靶向性。
H22-EGFP的转染率高达99.73%。 生物之所以发光是基于活细胞环境的酶促反应, 因此图2(a)中肿瘤肿块的大小与形状是H22-EGFP活细胞本身呈现的。 图2(b)中在肿瘤肿块位置处所呈现的形状是Cy7-GPG靶向至肿瘤肿块上, 包覆了肿瘤肿块后呈现的包覆物实际大小与形状, 比较图2(a)与图2(b)可见它们的大小与形状一致, 肿瘤的大小与形状相当于包覆物标示出的肿瘤肿块大小与形状, 说明GPG对肿瘤包覆程度很高。 该实验模型属移植瘤模型, 肿瘤长在浅表层, 肿瘤背面的生长环境与正面基本一致, 故Cy7-GPG在肿瘤背面上的包覆程度也是很高的, 即靶向至肿瘤的多肽对肿瘤的作用面积很大。 一般认为多肽对肿瘤细胞膜的作用是决定药效的关键因素[13], 因此, 了解靶向肽对肿瘤的包覆程度是很重要的。
H22-EGFP和Cy7-GPG均带有荧光基团, 它们的密度大之处, 荧光强度强。 图2(a)中肿瘤上H22-EGFP发射出的荧光颜色深浅不同, 肿块上感兴趣区A, B和C处所录荧光光子数分别为(85.6±8.47)×105, (83.9±7.98)×104, (77.1±7.29)×104, A与B, A与C的荧光光子数差异显著, 表明肿瘤肿块上活的肿瘤细胞密度分布是不均匀的。 图2(b)中包覆在肿瘤肿块上Cy7-GPG荧光颜色深浅也不同, 前述表明小鼠体内肿瘤肿块大小与形状与包覆物是一致的。 选取图2(b)包覆物上与图2(a)肿瘤肿块上A, B和C位置相对应的D, E和F为感兴趣区, 录得它们的荧光光子数分别为(44.5±6.69)×107, (30.2±5.96)×106, (21.9±4.99)×106, D与E, D与F由Cy7-GPG发射出的荧光光子数差异也显著, 这些变化规律与图2(a)一致, 表明肿瘤肿块上活的肿瘤细胞密度大的区域, Cy7-GPG的浓度也高, 荧光强度也强, 反之相反。 GPG序列中含有整合素αν β 3受体的配体RGD肽链, 其对多种肿瘤细胞均有靶向性[14], 观察靶向在肿瘤肿块上的Cy7-GPG荧光光子数的变化, 有助于判断靶向肽是否有效地杀死活的肿瘤细胞, 明确这一点对研究抗癌药物的疗效很有意义。 因为传统方法是通过在小鼠体内建立转染了荧光蛋白的肿瘤细胞模型, 评价抗癌肽杀死活的癌细胞的能力[10, 11], 这种实验不可能在人体内进行, 人体内环境复杂, 模型的不同可能影响实验结果, 因此该法具有临床应用价值。
由图3可见, 实验过程对照组A的肿瘤肿块变大, 荧光颜色加深, 表2示出其荧光光子数不断增强。 B, C和D组给药后, 肿瘤均明显减小, 荧光颜色变浅, 表2示出这些组肿瘤荧光光子数明显减小, 表明实验各组药效均较强。 从图3中B和C组小鼠体内肿块变化大小和表2中它们荧光光子数的变化, 可见CTX的药效与GPG相差不多, 但在实验过程中CTX组的小鼠生命状况不断恶化, 实验到第48天时, 小鼠食量与饮水量都很少, 基本不能动, 这可能是化学类药物CTX对体内正常细胞有毒副作用所致[2]。 GPG是阳离子多肽, 其所带净正电荷可选择性地对带负电性的肿瘤细胞膜产生作用[3], 且它的氨基酸序列中又嵌入了RGD, 因此对肿瘤细胞具有较强的靶向性[14]。 由本文2.4可知, GPG主要分布并作用在肿瘤上, 基本不对其他主要脏器产生影响。 GPG组不仅药效强, 而且该组小鼠在实验过程中表现出的自发活动行为正常。 图3和表2还表明, 在D组中GPG和CTX配合使用, 可收到比C组更好的抗癌效果, 降低了CTX用量, 对小鼠的伤害比B组弱很多, 综上, GPG在体内的药效较理想。
为了排除小鼠体内各种因素产生的背景干扰荧光分辨, 将小鼠处死, 取出内脏及肿瘤肿块, 测量它们的荧光光子数。 由图4可见, GPG主要分布在肿瘤上, 其余绝大多数在肝、 肾被分解并排出体外, 基本不对其他主要脏器产生毒副作用, 这主要由于GPG靶向并作用于肿瘤, 导致了其在肿瘤上聚集[15]。
(1)本文构建基于H22-EGFP与Cy7-GPG双报告基团荧光活体成像模型, 通过成像仪可以判断靶向肽Cy7-GPG对肿瘤肿块的包覆状况, 克服了传统方法只能评价其靶向功能的弊端, 对靶向肽进行更全面的评价, 增进对靶向肽在体内作用机理的认识; 通过该模型监测表明, 可由标记了荧光染料的靶向肽(如本文Cy7-GPG)在肿瘤肿块上荧光光子数的变化, 判断靶向肽有效杀死活的肿瘤细胞的能力, 该结果有临床应用价值。
(2)仅用一组基于双报告基团荧光活体成像模型, 可代替使用不同的单报告基团模型, 连续进行多肽在体内的靶向性、 对肿瘤肿块覆盖状况、 药效、 分布及代谢的监测, 节约实验成本, 简单快捷。
(3)对GPG在体内的性能监测表明其性能较好, 有应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|



