作者简介: 王璐璐, 女, 1990年生, 安徽中医药大学研究生院硕士研究生 e-mail: 790989352@qq.com
通过比较分析正常大鼠与膝骨关节炎模型(KOA)大鼠血清、 膝关节肌肉和滑膜组织的表面增强拉曼光谱(SERS), 为KOA生物学改变提供实验基础。 同条件下饲养普通级健康雄性SD大鼠20只, 随机分为正常对照组(简称“正常组”)和KOA模型组(简称“模型组”), 每组10只。 采用左膝关节腔内注射0.03 mol·L-1的L-半胱氨酸与4%木瓜蛋白酶混合物方法制备KOA模型, 并于复制成功4周后取材。 采用银纳米基底液检测大鼠血清和膝关节肌肉、 滑膜组织中的表面增强拉曼谱峰, 应用NGLabSpec软件比较两组拉曼频移和特征峰的差异, 应用OriginPro 8.5软件分析拉曼光谱图。结果在血清中, 拉曼频移400~2 000 cm-1区间内, 正常组特征峰有12个, 模型组有14个, 且模型组大部分特征峰强度低于正常组, 两组在495, 883和1 447 cm-1等处出现较为显著的差异性特征峰; 在膝关节肌肉组织中, 正常组特征峰有12个, 模型组有13个, 二者的同质性特征峰的拉曼强度存在显著差异, 模型组以950和1 237 cm-1为代表的多处同质性特征峰的峰强显著升高; 在滑膜组织中, 正常组特征峰有10个, 模型组有15个, 两组共性特征峰的峰强变化多不明显, 但在655, 950, 1 335和1 447 cm-1处的同质性特征峰表现出峰强的明显差异, 在655和950 cm-1峰为模型组显著升高, 而1 335和1 447 cm-1两峰相对强度为模型组显著降低。 结果表明: KOA模型导致血清、 膝关节肌肉和滑膜组织的同质性特征峰数量显著减少, 差异性物质增多, 物质代谢平衡被严重打破, SERS是一种快速准确的检测方法, 可以用于KOA模型的检测。
Surface-enhanced Raman Spectorscopy (SERS) spectra of serum, knee muscles and synovial tissues of normal rats and Model of Knee Osteoarthritis (KOA) are analyzed, providing an experimental basis for biological changes of KOA. Twenty normal healthy male SD rats were raised under the same conditions and randomly divided into normal control group (referred to as “normal group”) and KOA model group (referred to as “model group”), with 10 rats in each group. The KOA model was prepared by intra-articular injection of 0.03 mol·L-1 of l-cysteine and 4% papain. The classification of surficial enhanced Raman spectra in serum, knee muscle and synovial tissue of rats was detected by silver nanometer substrate fluid. NGLabSpec software was used to compare the differences of Raman frequency shift and characteristic peaks between the two groups, and OriginPro 8.5 software was used to analyze Raman spectra. In the serum, within the range of Raman frequency shift 400~2 000 cm-1, there were 12 characteristic peaks in the normal group and 14 in the model group, and the peak strength of most characteristic peaks in the model group was lower than that in the normal group, and significant difference characteristic peaks appeared in 495, 883 and 1 447 cm-1 of the two groups; in the muscle tissue of the knee joint, there were 12 characteristic peaks in the normal group and 13 in the model group, there were significant differences in the Raman strength of the characteristic peaks of homogeneity between the two groups; in synovial tissues and the normal group has 10 characteristic peaks, has 15 model group, two groups of the common characteristic peak of peak intensity change is not obvious, but in the 655, 950, 1 335, 1 447 cm-1 of the homogeneous characteristic peaks show that the peak strength of significant differences, in 655 and 950 cm-1 of a significant rise in the model group, and 1 335 and 1 447 cm-1 model is the relative strength of two groups decreased significantly. KOA model led to a significant decrease in the number of homogenous characteristic peaks of serum, knee muscle and synovial tissue, and an increase in different substances. Thus the metabolic balance of substances was seriously broken. SERS is a fast and accurate detection method, which can be used for the detection of KOA model.
膝骨性关节炎(knee osteoarthritis, KOA)是一种主要表现为膝关节疼痛和活动障碍的慢性退行性关节疾病, 也是全球公认的主要致残原因之一, 也与精神心理疾病、 心血管疾病等多种疾病的发生密切相关, 近年来更有年轻化的趋势[1, 2, 3]。 在我国, 由于KOA发病过程不可逆且随人口老龄化对人口结构特征的改变, KOA发病数呈递增趋势, 这种发病趋势将给社会带来巨大的医疗负担。 当前的KOA诊断主要依靠症状和影像学方法, 虽然有代谢组学研究表明KOA患者滑膜组织液的支链氨基酸和精氨酸表达增多[4, 5], 但仍缺乏特异性的生物标记物检测方法, 尤其是对早期的病程诊断存在局限性, 因此临床也在积极寻求更加简便快捷的诊断方法[6, 7]。
表面增强拉曼光谱(surface-enhanced Raman spectroscope, SERS)技术是一种可以快速分析检测的方法, 能够提供丰富的化学分子结构信息, 具有高灵敏度、 高选择性、 携带方便、 受水和荧光信号干扰小等优点, 而广泛应用于生化、 物理等领域[8, 9, 10], 在医学领域也处于发展应用的阶段[11], 例如SERS探针的不断发展与优化, 增强了多元化检测的能力, 实现了DNA分子检测、 细胞内特定生物分子定位检测、 细胞和组织的双重成像等生物标记检测, 用于识别单个癌细胞, 确定体内的肿瘤定位及检测[12]。 目前, 通过对人体唾液进行SERS分析, 有助于对常见的鼻咽癌、 胃癌、 肝癌、 乳腺癌、 宫颈癌等多种癌症进行早期简便快速诊断[13]。 在KOA的应用中仍较少, 一项关于KOA患者关节滑膜积液的初步研究表明, SERS具有辅助关节炎的分级诊断应用潜力[14]。
本工作前期观察了KOA模型大鼠的膝关节软骨超微结构变化[15], 并分析了膝关节组织液、 滑膜的炎性因子表达, 但对血清、 滑膜组织和膝关节局部肌肉组织的生物化学物质的变化研究相对不足, 通过比较分析正常大鼠与KOA模型大鼠血清、 膝关节肌肉和滑膜组织的SERS变化, 以期为KOA生物学改变和临床诊断治疗应用提供实验基础。
同条件普食喂养普通级健康雄性SD大鼠20只[购自安徽省实验动物中心, 许可证号: scxk(皖)2011-002], 体质量为(250±20) g, 随机分为正常组、 模型组, 每组10只。 实验过程严格遵循中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》。
拉曼光谱仪(美国奥林巴斯公司, 型号: BX41); -80 ℃冰箱(大连三洋冷链有限公司, 型号: MDF-382E(CN) ); 低速离心机(安徽中科中佳科学仪器有限公司, 型号: SC-3610); 电子天平(赛多利斯科学仪器有限公司, 型号: BSA124S); 微量移液器(德国Eppendorf公司, 型号: 0.5-10ul); 超声波细胞粉碎机(宁波新芝生物科技股份有限公司, 型号: JY92)。
0.9%氯化钠注射液(安徽双鹤药业有限公司, 批号: H34023609); 75%消毒酒精(合肥市盛杰生物制品有限公司, 批号: 20140107); 碘伏(山东华鲁制药有限公司, 批号: 151002); 水合氯醛(国药集团化学试剂有限公司, 批号: 20180305); L-半胱氨酸(上海源叶生物科技有限公司, 批号: H23O8H46139); 木瓜蛋白酶(上海源叶生物科技有限公司, 批号: P08A9B67156)。
1.3.1 模型复制
实验采用10%水合氯醛麻醉大鼠, 用量为0.3 mL/100 g。 参考文献[8]方法将配置好的0.03 mol·L-1的L-半胱氨酸与4%木瓜蛋白酶以1:2比例混合, 置常温下30 min后对大鼠进行膝关节腔注射。 在实验第1, 4和7 d分别麻醉固定大鼠, 剃左膝关节周边1 cm区域的毛, 消毒脱碘, 屈曲45°后从髌骨下髌腱外缘为进针点向髁间窝方向进针, 至股骨髁后回撤2 mm后注射0.15 mL混合溶液诱导左膝骨关节炎模型, 右膝不注射。
1.3.2 纳入标准
①造模4周后大鼠出现左膝关节肿胀; ②造模4周后大鼠左后肢关节运动受损; ③造模4周后大鼠步态改变。 符合以上标准大鼠纳入研究范围。
1.3.3 剔除标准
①模型复制中死亡者剔除; ②模型复制后未出现关节局部肿胀、 活动障碍或步态改变等任何KOA症状者剔除。
1.4.1 样本留取
正常组与KOA模型组大鼠于KOA 模型复制4周后一同取材。
血清: 大鼠麻醉后用无抗凝剂真空采血管采集大鼠腹腔动脉血5 mL。
膝关节肌肉与滑膜组织: 碘伏消毒大鼠膝骨关节处再用酒精脱碘, 剪开皮肤, 暴露大鼠左膝骨关节处肌肉以手术刀切取膝关节外侧肌肉1 cm3大小, 沿髌骨上沿约0.3~0.4 cm处向下切割并沿着两侧分离至胫骨取下滑膜组织, 生理盐水冲洗、 液氮研磨、 超声碎解、 匀浆。
血液样本及肌肉和滑膜组织匀浆后均以4 ℃, 3 000 r·min-1离心20 min, 提取上清液后液氮速冻, 置于-80 ℃低温冰箱待测。
1.4.2 SERS检测
取银纳米基底液1 mL, 3 000 r·min-1离心15 min, 提取离心后的纳米银基底液底物至特制硅片格板上制备SERS基底片。 梯度复温待测样本各取20 μL移至制备后的基底片上, 采用 BX41拉曼光谱仪对各样本进行检测分析, 参数设置为激发功率2.5 mW、 50倍长焦的633和785 nm激光, 光圈为100 μm, SERS光谱范围为400~2 000 cm-1。 对各组样本采用随机选择激光照射点多次检测, 将得到的各组拉曼光谱图汇总, 因随机选择激光照射点, 故在对各组拉曼光谱进行进一步对比分析前, 需先排除因物质浓度差异而导致的异常光谱, 选择具有稳定性的数据进行纠偏和基线归一等处理。
所有光谱数据均以NGLab Spec分析软件进行分析得出数据(SERS数据对比数据库, 统计分析), Origin Pro 8.5软件分析及绘制拉曼光谱图。
在透射电镜(×20 000)下示, 正常组大鼠关节软骨的细胞为卵圆形, 细胞膜和细胞显示完整, 细胞表面有较多突起微绒毛, 细胞核完整且核膜清晰, 染色质均匀, 胞质内线粒体、 高尔基复合体和丰富且排列整齐的粗面内质网, 图1(a); 模型组关节软骨细胞形态不规则, 胞质内见数个大体积脂滴, 细胞核裂解, 线粒体、 粗面内质网等细胞器消失、 溶解, 游离核糖体显著减少, 图1(b)。
2.2.1 两组大鼠血清SERS分析
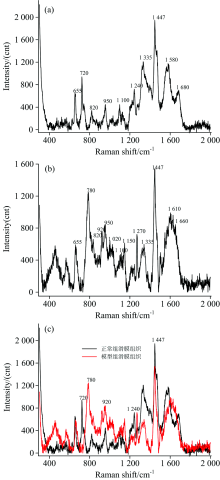
正常组大鼠血清的表面增强拉曼光谱图中, 拉曼频移400~2 000 cm-1区间出现特征峰的峰位为495, 635, 725, 810, 883, 1 010, 1 130, 1 200, 1 375, 1 447, 1 560和1 670 cm-1等12个。
模型组大鼠血清的表面增强拉曼光谱图中, 拉曼频移400~2 000 cm-1区间出现的特征峰主要为635, 783, 810, 883, 1 000, 1 052, 1 130, 1 200, 1 230, 1 310, 1 375, 1 447, 1 530和1 600 cm-1等14个。
 | 图2 正常组(a), 模型组(b)大鼠血清SERS光谱图, 正常与模型组叠加图(c)Fig.2 SERS spectrum of rat serum in the normal (a) and model (b) group, (c) Merged figure of the normal and model groups |
正常组在495, 725和883 cm-1等处出现较为尖锐且模型组表现不明显的特征峰, 表明在KOA模型大鼠血清中以上物质出现特异性变化; 其中495和883 cm-1两处的特征峰差异明显, 此类物质在KOA模型大鼠血清中的含量显著降低, 或可作为KOA血清诊断标志物之一。 模型组在783 cm-1处出现正常组没有的尖锐谱峰, 故认为该处对应物质可作为KOA的血清生物标志之一。 两组同质性的特征峰的强度差异亦显而易见, 主要体现在635, 810, 883, 1 130, 1 200~1 210, 1 375和1 447 cm-1等峰位。
2.2.2 两组大鼠膝关节肌肉组织SERS分析
正常组膝关节肌肉组织SERS谱见图3(a, b, c), 主要特征峰在656, 720, 790, 950, 1 025, 1 090, 1 237, 1 330, 1 365, 1 447, 1 580和1 690 cm-1等12个。
模型组肌肉组织的拉曼频移为560, 656, 720, 950, 1 025, 1 090, 1 125, 1 237, 1 330, 1 365, 1 447, 1 580和1 690 cm-1等13个出现较为明显的特征峰。
正常组在620, 790和1 025 cm-1等三处特征峰的峰强明显高于模型组, 显示此三类物质在模型组中含量降低。 与正常组比较, 模型组在656, 720, 950, 1 125, 1 237, 1 330, 1 447, 1 580和1 690 cm-1等为代表的多处同质性特征峰表现相对含量显著升高, 故推测这些物质是由于关节炎引起的局部肌肉中代谢产物和炎性产物的积累, 可能是造成局部红肿疼痛的原因之一。
2.2.3 两组大鼠膝关节滑膜组织SERS分析
正常大鼠左膝关节滑膜组织的拉曼光谱特征峰主要位于655, 720, 820, 950, 1 100, 1 240, 1 335, 1 447, 1 580和1 680 cm-1等10个位置。
模型组大鼠左膝关节滑膜组织的拉曼光谱特征峰主要位于445, 570, 655, 780, 820, 920, 950, 1 020, 1 100, 1 150, 1 270, 1 335, 1 447, 1 610和1 660 cm-1等15个位置。
与正常组比较, 模型组滑膜组织中在656, 720, 920, 950, 1 240, 1 335和1 447 cm-1等处表现出峰强的明显差异, 提示KOA模型大鼠滑膜组织的物质种类有明显变化。 且在656和950 cm-1处为模型组的相对含量显著升高, 可能是造成局部红肿疼痛的原因之一; 720 cm-1(应为多糖)、 1 335和1 447 cm-1处的相对强度为KOA模型组模型组显著降低, 推测是关节炎导致软骨能量代谢失衡, 可能是造成关节软骨组织损伤的原因之一。 正常组与模型组在780, 1 240和1 447 cm-1等处表现为差异性特征峰。
通过检测分析正常大鼠与KOA模型大鼠的血清、 膝关节肌肉组织和滑膜组织的SERS特征峰, 发现相对于正常组大鼠, 模型组三种样本的物质成分和含量均发生了明显的改变, 血清的峰强出现下降, 而滑膜组织和膝关节肌肉组织峰强上升, 同时三者的同质性特征峰数量显著减少, 差异性物质增多, 表明KOA模型大鼠的膝关节滑膜、 肌肉和血清之间的物质代谢平衡被严重打破。
通过本实验分析认为, 在KOA模型大鼠血清、 膝关节肌肉组织和滑膜组织中发现了与正常大鼠不同的特征峰, 明确了KOA中存在的代谢物质紊乱, 发现了潜在的血清生物学标志物。 与其他检测分析方法相比, SERS光谱学分析能够有效地攻克传统微弱拉曼光谱信号的问题, 极大地提高了拉曼散射强度和检测的灵敏度; 随着设备技术的发展, 拉曼光谱仪已经可以便携使用, 操作简单快捷, 能够为临床快速诊断提供帮助, 也为下一步开展干预KOA效应的实验研究提供了参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|