作者简介: 黄 芳, 女, 1999年生, 西南科技大学生命科学与工程学院本科生 e-mail: huangfang299615@163.com
精油和远红外陶瓷粉(cFIR)经常用于理疗或相关的保健产品, 但其与生物分子间的相互作用及其机制较少被关注。 在模拟生理条件下, 采用光谱法与红外热成像技术, 研究了cFIR对玫瑰精油(REO)与牛血清蛋白(BSA)之间相互作用的影响及其机制。 荧光光谱表明, REO与cFIR均能猝灭BSA的内源性荧光; 无论cFIR是否存在, REO对BSA的猝灭方式均为静态猝灭; Stern-Volmer方程拟合计算结果表明加入cFIR, 使BSA与REO之间的结合位点数由0.55提高到0.96, 结合常数也显著提高, 说明cFIR的存在能提高REO对BSA的亲和力, 且二者与BSA之间存在强有效的作用力; 利用同步荧光光谱、 三维荧光光谱和红外光谱探究了cFIR与REO对BSA二级结构的影响, 结果表明两者会引起蛋白质周围疏水性的增加, 对BSA的构象有一定的影响; 另外两者主要通过与BSA形成缔合物的方式对蛋白质的内源性荧光产生影响并具有协同作用; 利用Förster非辐射能量转移理论计算临界能量转移距离 R0和结合距离 r, cFIR加入前后BSA与REO之间的结合距离 r由1.445 nm变为1.453 nm, R0基本不变, 且 R0< r, 表明无论cFIR是否存在, REO对BSA荧光静态猝灭的同时也伴随着非辐射能量转移; 另外, cFIR与REO在BSA的不同部位存在非竞争性结合位点, cFIR主要是通过改变BSA的构象提高精油对BSA的亲和力。 采用红外热成像技术方法分析了REO和cFIR与大分子的相互作用。 通过对红外热成像图的分析, 表明REO可使生物分子的温度降低, 而cFIR可使生物分子温度升高; 另外, cFIR的加入会提高BSA-REO体系响应的温度, 即热效应会增加( p<0.05)。 以上结果表明具有纳米尺寸效应和远红外射线辐射的纳米红外线陶瓷粉, 在与精油共同作用于生物分子时, 可通过形成缔合物影响体系的微环境, 从而影响荧光特征与能量传递。 研究结果可为精油结合远红外材料在理疗上的进一步应用及机理研究提供参考。
Essential oil and far-infrared ceramic powder(cFIR) are often used in physiotherapy or related health-care products, but the interaction and mechanism between them and biomolecules are less concerned. In this research, the influence and mechanism of cFIR on the interaction between rose essential oil(REO) and bovine serum albumin (BSA) were studied through different spectroscopy methods and infrared thermography under simulated physiological conditions. The results of the fluorescence spectrum show that both the REO and the cFIR can quench the intrinsic fluorescence of BSA. Whether the cFIR exists or not, the quenching mode of the REO to BSA is static quenching. The fitting calculation of Stern-Volmer equation shows that the binding sites n between BSA and REO is increased from 0.55 to 0.96 by adding cFIR, and the binding constant is also significantly increased, which shows that the affinity of REO to BSA can be improved with the existence of cFIR. The effects of cFIR and REO on the secondary structure of BSA were studied through synchronous fluorescence spectrum, three-dimensional fluorescence spectrum and Fourier transform infrared spectrum. The results show that they can cause the increase of hydrophobicity around the protein and have little effect on the conformation of BSA; in addition, cFIR and REO show the synergistic effect on the quenching of BSA intrinsic fluorescence through the formation of association compounds with BSA. Critical distance ( R0) and binding distance ( r) were calculated based on Förster’s non-radiative energy transfer theory. The binding distance ( r) between BSA and REO changes from 1.445 nm to 1.453 nm after the addition of cFIR, R0 is basically unchanged and R0 is less than r. These results suggest that whether the cFIR exists, the static quenching of BSA fluorescence by REO is accompanied by non-radiative energy transfer. The cFIR mainly improves the affinity of REO to BSA by changing the conformation of BSA due to different non-competitive binding sites between the cFIR and REO on BSA molecular surface. Infrared thermal imaging techniques was used to explore the interaction of REO and cFIR with macromolecules. Infrared thermal imaging results show that REO can reduce the temperature of biomolecules, while cFIR can increase the temperature of biomolecules. The addition of the cFIR can increase a response temperature of BSA-REO system, which indicates the thermal effect will increase ( p<0.05). The above results show that the cFIR with nano-size effect and far-infrared radiation can affect the microenvironment of the system by forming association compounds when it interacts with REO, thus affect the fluorescence characteristics and energy transfer of biomolecules. The results of this study can provide a reference for further application of essential oil combined with cFIR in physiotherapy and mechanism research.
远红外是一种电磁辐射, 因人体的红外吸收能量处于远红外波长范围之内, 远红外材料能够对人体细胞产生较强的共振作用。 远红外材料, 作为广泛可用的功能材料, 在医疗保健上受到关注。 研究表明远红外辐射能增加生物活性, 利用此性能可以进行理疗(如热桑拿)或制作各种保健产品(如远红外热灯、 红外保健织物、 热敷袋等), 可增强相关功效[1, 2]。
精油因具有抗炎和抗氧化等多种生物活性而被越来越多地用于医疗保健、 美容等领域, 被誉为“ 液体黄金” 。 利用精油的挥发性, 通过嗅吸和皮肤渗透[3]而产生明显的心理、 生理反应, 从而达到医疗保健、 美容的目的。
远红外材料结合精油的医疗保健方式受到广泛的关注。 在李云平等[4]的研究中, 利用远红外线照射结合精油按摩的方式可提高疗效。 另外, 市面上也有将精油添加到远红外材料制品中制成的各种理疗贴如远红外磁疗贴、 远红外艾灸贴等。 但未见远红外材料对精油与牛血清蛋白(bovine serum albumin, BSA)相互作用影响的报道。 研究远红外材料对具有生物活性的精油小分子与生物大分子的相互作用, 阐述两者相互作用在医疗保健上的作用机制, 具有一定的理论与应用价值。
小分子与大分子相互作用的研究除了光谱法, 有些还会结合各种色谱、 电化学以及分子对接等方法探究其机理, 但用红外热成像技术研究小分子与BSA大分子作用的文章还鲜有报道。 利用此技术, 可以全面、 整体、 动态地采集和分析物体的温度信息, 评价能量辐射的状况[5]。 如文建等[6]利用红外热成像观察光子贴的疗效, 发现红外热成像对光子理疗贴联合法治疗慢性膝痛的疗效评价具有很好的临床应用价值。
目前, 国内外对于精油小分子或纳米材料作用于BSA的研究有相关报道[7, 8], 但两者结合以及使用具有远红外射线辐射效应的纳米材料的研究未见报道。 鉴于此, 选用常见的远红外辐射材料— — 远红外陶瓷粉(far-infrared ceramic powder, cFIR), 利用光谱法及红外热成像技术研究cFIR对玫瑰精油(rose essential oil, REO)与BSA相互作用的影响及其作用机制, 为远红外材料结合精油的理疗研究及应用提供相关的科学基础。
荧光分光光度计(F-7000, 日本日立公司); 钠灯(上海亚明照明有限公司); 红外成像仪(TiS20, 福禄克公司); 傅里叶变换红外吸收光谱仪(Nicolet5700, 美国热电仪器公司); 紫外分光光度计(U-3900H, 天美科学仪器有限公司)。
玫瑰护理精油(广州美颂生物科技有限公司); 普通陶瓷粉(common ceramic powder, CCP)、 远红外陶瓷粉(茂川矿业); BSA(阿拉丁试剂股份有限公司), 纯度> 98%; 其余所用试剂均为分析纯, 购自国药集团化学试剂有限公司; 实验用水为去离子水。
准确称取10.0 mg远红外陶瓷粉, 溶解在10.0 mL无水乙醇中, 使用封口膜密封后超声1 h后, 用0.5 mol· L-1 pH为7.4的Tris-HCl缓冲液配制成0.1 mg· mL-1的cFIR悬浊液; CCP悬浊液的配制方法同cFIR; 准确称取0.5 g玫瑰精油, 用丙二醇定容至10.0 mL, 配制成0.05 g· mL-1的精油悬浊液; 准确称取165.4 mg BSA, 用Tris-HCl定容至50.0 mL, 配制成5.0× 10-5 mol· L-1的BSA储备液, 保存备用。
1.3.1 荧光光谱、 同步光谱的测定
准确移取浓度为5.0× 10-6 mol· L-1的BSA溶液3.0 mL于比色管中, 逐次加入5.0 μ L的REO悬浊液, 即为BSA-REO二元体系, 依次测定荧光光谱。 在另一组实验中, 先逐次加入5.0 μ L的cFIR悬浊液, 依次测定; 之后, 向二元体系中逐次加入5.0 μ L的Oil悬浊液, 即为(BSA-cFIR)-REO三元体系, 依次测定。 在测试CCP对REO与BSA相互作用影响的荧光光谱时, 只需将cFIR换成CCP即可, 其余相同。
在荧光分光光谱的扫描中, 参数设置为: 激发波长λ ex为280 nm, 扫描范围为200~550 nm, 扫描速度为240 nm· min-1, 狭缝宽度为5 nm。
同步荧光光谱的扫描中, Δ λ =15 nm与Δ λ =60 nm对应的起始发射波长分别为255和300 nm, 激发波长范围均为240~340 nm。
1.3.2 三维荧光光谱的测定
在荧光分光光度计中测试常温条件下cFIR和REO与BSA相互作用时的三维光谱; 参数设置为: 激发波长λ ex为200~450 nm, 发射波长200~500 nm, 扫描速度1 200 nm· min-1, 扫描间距为5 nm, 狭缝宽度为5 nm。 在BSA体系中逐次加入5.0 μ L REO和5.0 μ L cFIR, 共5次。
1.3.3 红外光谱的测定
室温下测定不同体系的傅里叶变换红外光谱(FTIR), 分辨率为4 cm-1, 扫描范围为4 000~400 cm-1; 将样品均匀地铺满KBr晶片, 扫描样品光谱; 用Omnic和Peakfit软件进行处理。
1.3.4 红外成像的测定
用面膜模拟人的皮肤来测试红外响应温度变化。 将面膜剪成大小近似的小块, 晾干; 然后将面膜放在不同的体系的离心管中, 一段时间后取出来, 晾干。 在10 cm附近设钠灯照射, 用红外成像仪测定在钠灯照射下不同面膜的响应温度。 将红外成像仪设为自动模式, 每5 s捕捉一张, 一次设置捕捉30张, 在不同时间段重复实验, 得到180组数据, 用单因素方差分析的方法对数据进行分析。
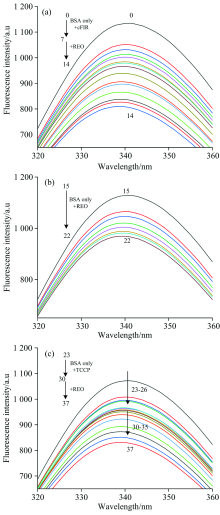
图1给出了陶瓷粉和精油对BSA猝灭曲线。 荧光猝灭是由于猝灭剂与生色基团的相互接触而引起的荧光量子产率下降[9]。 猝灭剂对蛋白质的荧光猝灭分为静态猝灭、 动态猝灭。 动态猝灭主要是由分子扩散引起, 静态猝灭主要是由于分子间相互作用形成复合物引起。 由图1可知, 在激发波长为280 nm的条件下, BSA最大荧光峰出现在340 nm左右。 REO和cFIR与BSA作用的体系中, 随着猝灭剂的不断加入, 荧光强度逐渐下降, 峰形也出现了略微的蓝移; 表明陶瓷粉和精油与BSA间发生了相互作用与能量转移, 使BSA的内源性荧光发生了猝灭。 而CCP-REO与BSA作用的体系, 荧光强度也下降, 说明与BSA也发生了相互作用, 但并无规律。 因此, 在后续的研究中主要对cFIR-REO进行探讨。
假设远红外陶瓷粉和/或精油与BSA作用的机制为动态猝灭, 利用Stern-Volmer方程(1)对不同体系的猝灭情况进行计算, 将结果列于表1中。
| 表1 二元/三元体系的Stern-Volmer常数 Table 1 Stern-Volmer constants in binary/ternary systems |
在式(1)中, F0和F分别代表未加入猝灭剂和加入猝灭剂时蛋白质的荧光强度, KSV为Stern-Volmer荧光猝灭常数; Kq为动态猝灭速率常数; [Q]为所加猝灭剂的浓度; τ 0为不存在猝灭剂的情况下大分子物质生物体内的内源荧光寿命(τ 0≈ 10-8 s)。
据报道, 各类荧光猝灭剂对生物大分子的最大动态猝灭速率常数为2.0× 1010 L· mol-1· s-1[7]; 由表1可知, 两个体系的动态猝灭常数均大于最大值, 故判断cFIR-REO与REO对BSA的猝灭机制均为静态猝灭。 其中REO的猝灭机制与Leila等[8]研究的百里香酚相似; 另外, Sekar等[10]证明挥发油纳米乳共轭物、 Riaz等[11]证明蓖麻油聚氨酯纳米复合材料对蛋白质的猝灭机制为静态猝灭。
对于静态猝灭方式, 不同体系的结合位点数n与结合常数都可由静态猝灭双对数式(2)计算。 将结果列于表2中。
| 表2 不同体系下的结合位点数n、 结合常数Ka Table 2 The binding site number n and the binding constant Ka of different system |
由表2可知, 在cFIR的参与下, REO与BSA相互作用的结合位点数n与结合常数Ka明显提高。 两个体系的结合位点数分别与百里香酚[8]、 挥发油纳米乳[10]类似。 在三元体系中, n的值近似为1, 说明BSA在cFIR和REO上存在一个有效结合位点; 另外, 结合常数达到了103(L· mol-1)以上, 进一步说明二者与BSA之间存在强有效的作用力, cFIR的存在可促进REO与BSA的结合, 其可能是REO与cFIR之间存在协同作用, 使得与BSA作用时结合常数增大。
2.3.1 同步荧光光谱分析
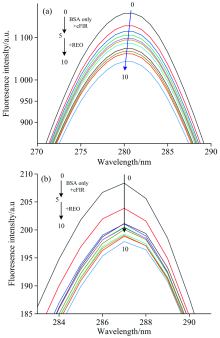
因同步荧光光谱具有简单、 避免扰动等优点常用来研究蛋白质的构象变化。 荧光峰的位置与蛋白质的构象相关, 极性的变化常常引起最大吸收波长的变化, 若发生红移, 则说明氨基酸周围极性增大, 反之减小。 当激发波长和发射波长之间的Δ λ 设置为15和60 nm时, 同步荧光光谱给出了Tyr和Trp残基的特征信息[10]。 (BSA-cFIR)-REO体系的同步荧光光谱如图2所示。
由图2可以看出, 在(BSA-cFIR)-REO体系中, Trp和Tyr的荧光强度都降低, Trp荧光峰规律性的下降, 而Tyr在只加cFIR时逐渐减低, 继续加入REO后则无梯度规律性; 另外, Trp的最大吸收峰出现了轻微的蓝移, 而Tyr的荧光峰几乎没有移动, 且Trp猝灭程度大于Tyr, 说明REO和cFIR与BSA的结合更偏向色氨酸残基, 使Trp周围的极性降低, 疏水性增加, 导致BSA构象发生略微的变化。 同步荧光光谱的说明cFIR的加入会使BSA的Trp暴露在一个相对疏水的环境。 Trp的行为与Mahanthappa等[7]研究的纳米硫化铜、 Riaz等[11]研究的两亲性材料类似。
2.3.2 三维荧光光谱分析
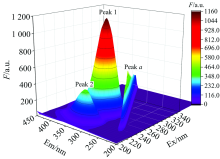
三维荧光光谱常用来揭示小分子对蛋白质构象的影响。 为了进一步探究cFIR和REO与BSA作用的影响, 测定了BSA-REO-cFIR体系的三维荧光光谱图。 BSA的三维荧光图见图3。 将所有体系的三维荧光光谱特征参数列于表3中。
| 表3 不同体系中的三维荧光光谱特征参数 Table 3 Characteristic parameters of three-dimensional fluorescence spectra of different systems |
Peak a主要代表瑞利散射峰, 常用来表示大分子直径的变化。 由表3可知随着REO和cFIR的不断加入Peak a的强度不断增强, 说明两者与BSA相互作用形成了缔合物, 缔合物使体系的摩尔质量增大, 导致瑞利光散射增强而内源性荧光降低[7]。
Peak 1代表Tyr和Trp的荧光特征峰, 其变化主要与氨基酸周围极性的改变有关; Peak 2是BSA多肽骨架结构的荧光光谱特征峰, 该峰是由多肽骨架发生π → π * 跃迁引起的, 其变化与BSA二级结构的改变有关[7]; 由表3可知, Peak 1和Peak 2的荧光强度随着猝灭剂的加入在一定程度上都在不断降低, 且Peak 2伴随轻微蓝移, 说明了BSA与cFIR和REO结合后多肽骨架受到影响, 疏水性增强, 以至BSA二级结构发生略微的变化。 该结论与同步荧光光谱一致。
Campana等[12]利用中子反射的研究观察到BSA在油水界面有更高的吸附作用, 提出在疏水性较强的界面处, 蛋白质的吸附性更高的结论。 这一结论为该结果提供一定的论据, 说明加入cFIR后, 使蛋白质处在相对疏水的环境, 该环境更利于REO与BSA的结合。
2.3.3 傅里叶变换红外光谱分析
傅里叶变换红外光谱是定量研究蛋白质二级结构的有力工具, 通过谱图可以考察BSA的构象变化, 其中酰胺Ⅰ 带(1 700~1 600 cm-1)的研究最有价值。 酰胺Ⅰ 带主要是C=O键的伸缩振动, 由于羰基和氨基形成的氢键与蛋白质二级结构密切有关, 因此酰胺Ⅰ 带的变化常表征蛋白质二级结构的改变[13]。
为定量分析BSA蛋白质二级结构的变化, 利用Gaussian去卷积和二阶导数拟合对酰胺Ⅰ 带进行处理, 如图4所示。 根据拟合的结果, 计算BSA的二级结构比例。 由表4可知, 随着cFIR, REO和cFIR-REO的加入, α -helix的比例均略微降低, 其他结构含量升高, 说明两者的加入会使蛋白质分子变得更加松散, BSA的二级结构发生略微变化。 另外, REO和cFIR共同作用时α -helix含量为26.66%, 该值介于cFIR与REO单独作用的值之间, 说明二者存在协同作用。
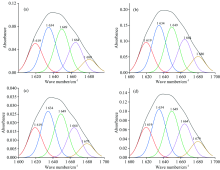 | 图4 不同体系的酰胺Ⅰ 带拟合图Fig.4 Amide Ⅰ band fitting maps for different systems (a): BSA; (b): BSA-cFIR; (c): BSA-REO; (d): BSA-cFIR-REO |
| 表4 不同体系的二级结构拟合结果 Table 4 Fitting results of secondary structures for different systems |
2.4.1 结合距离计算
根据Fö rster非辐射能量转移理论[14], 若供体与受体之间满足以下三个条件, 将会发生非辐射能量转移, 导致荧光猝灭: ①供体能够给出荧光; ②供体的荧光光谱与受体的紫外光谱有充分的重叠; ③供体与受体的结合距离小于7 nm。 根据此理论, 非辐射能量转移效率E、 供体与受体之间的结合距离r、 临界能量转移距离R0及光谱的重叠积分J可由式(3)— 式(5)计算
式中, K2为偶极空间取向因子, 一般取平均值2/3; φ 为量子产率, 对于BSA, 取0.118[14]; n为介质的折射率, 取水和有机物的平均值1.336; J为供体的荧光光谱与受体的紫外光谱的重叠积分; F与F0分别为受体存在与不存在时BSA的荧光强度; ε 为受体在相应波长下的摩尔吸收系数[14]。 图5给出了cFIR存在或不存在时, BSA的荧光光谱与REO的紫外光谱重叠图。
 | 图5 有(a)无(b)cFIR时BSA发射光谱与REO紫外光谱重叠图Fig.5 The overlap of the emission spectrum of BSA and UV spectrum of REO with (a) or without (b) cFIR in the systems |
利用Origin计算出当cFIR存在与不存在时各个物理量的值, 将结果列于表5中。
| 表5 有无cFIR时Fö rster非辐射能量转移特征参数 Table 5 Characteristic parameters of nonradiative energy transfer of Fö rster with or without cFIR |
由表5的结果可知, 两个体系的结合距离都小于7 nm, 说明在cFIR存在或不存在的情况下, REO对BSA荧光静态猝灭的同时也伴随着非辐射能量转移; R0< r说明了REO对BSA与(BSA-cFIR)的荧光猝灭方式主要为静态猝灭[7, 13]。 此外, 由表5得出cFIR加入前后BSA与REO之间的结合距离r由1.445 nm变为1.453 nm, 可以合理假设cFIR与REO在不同的白蛋白部位具有非竞争性结合位点, 从而导致三元非荧光配合物cFIR-BSA-REO的形成; 另外, cFIR的加入使其与BSA之间形成络合物BSA-cFIR, 该络合物改变了BSA的构象, 使REO与BSA结合变得更容易[15]。
2.4.2 不同体系对热辐射的响应分析
红外热成像是利用物体不同的辐射能力和对红外线的反射强弱, 将不可见的红外辐射变成可见的热图像。 红外热成像图其实就是物体温度分布的图像。 图6展现了在钠灯的照射下拍摄不同体系的特征红外热成像图。
 | 图6 钠灯照射下不同体系面膜的红外热成像图(红色区域代表面膜)Fig.6 Thermograph of the mask in different systems irradiated by sodium lamp (red area represents mask) |
从图6可以得出, 在钠灯照射下面膜的响应温度高于周围的温度。 重复6次实验, 将180组数据取平均值作图, 利用SPSS软件, 利用LSD法进行方差分析, 结果如图7所示。
图6、 图7结果显示, 纯cFIR和BSA-cFIR体系在钠灯照射后呈现最高的温度响应(两者无显著差异), 其次是纯BSA、 纯CCP、 纯REO及BSA-CCP体系(四组间无显著差异, 与纯cFIR和BSA-cFIR体系差异显著, p< 0.05); 温度响应最低的是BSA-REO体系(p< 0.05), 而在该体系中加入陶瓷粉后(BSA-cFIR-REO体系和BSA-CCP-REO体系)温度会升高, 但仍然低于其他组(p< 0.05)。 这些现象说明单一体系、 二元体系、 三元体系呈现迥异的温度响应特征; 与单一体系相比, 精油可使生物分子的温度降低, 而cFIR可使生物分子温度升高; 共同作用时, cFIR的加入会使BSA-REO体系响应的温度增加, 即热效应会增加(p< 0.05)。 按照李云平[4]等的说法, 这个热效应可起扩张血管、 加速新陈代谢等作用。 与普通陶瓷粉相比, 远红外陶瓷粉的热效应更显著。 另一方面, 用红外成像技术用于研究小分子/纳米颗粒与BSA之间相互作用受客观因素的影响大, 还需更广泛的研究进一步阐明其作用。
利用荧光光谱法得出REO和cFIR与BSA的作用机制与结合情况, 以此基础再继续用各种分析方法研究REO和cFIR对BSA构象的影响, 最后用红外热成像技术表征二者对BSA能量辐射的影响。 基于以上的分析, 可得出如下几点结论: (1)荧光光谱法表明无论远红外陶瓷粉是否存在, BSA与精油之间都存在相互作用和荧光猝灭, 且主要作用机制主要为静态猝灭; 通过计算结合常数Ka与结合位点数n表明远红外陶瓷粉的加入会使精油与BSA的结合更加牢靠; (2)同步荧光光谱、 三维荧光光谱和FTIR的结果表明远红外陶瓷粉和精油对BSA的二级结构产生略微的变化, 两者使氨基酸周围的极性降低, 疏水性增加, 同时通过形成缔合物的方式对BSA的内源性荧光产生影响; Fö rster非辐射能量转移距离的计算进一步表明无论远红外陶瓷粉是否存在, 精油与BSA之间都发生非辐射能量转移, 同时络合物BSA-cFIR的形成改变了BSA的构象, 使其与精油的结合更加容易; (3)红外热成像结果表明远红外材料的加入能提高BSA-REO体系响应的温度, 具有热效应。
因此, 具有纳米尺寸效应和远红外射线辐射的纳米红外线陶瓷粉, 在与精油共同作用于生物分子时, 可通过形成缔合物影响体系的微环境, 从而影响荧光特征与能量传递。 本研究结果可为精油结合远红外材料在医疗保健上的进一步应用及机理研究提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|