作者简介: 张 楠, 女, 1987年生, 南京工业大学化学与分子工程学院实验师 e-mail: zhangnan1015@njtech.edu.cn
瑞芬太尼是一类新型、 理想、 手术中常用的一种麻醉镇痛药, 具有起效迅速、 半衰期短、 易于控制、 术后苏醒快等优点, 进入人体后以肾脏代谢为主, 经脱脂代谢后, 形成羧酸代谢物, 即瑞芬太尼酸, 因此对瑞芬太尼及其代谢物瑞芬太尼酸的结构研究很有必要。 目前文献只有对原型药物的结构研究, 而其代谢物瑞芬太尼酸的结构研究未见报道。 建立了紫外吸收光谱法、 红外吸收光谱法、 核磁共振波谱法(包含1H NMR,13C NMR,1H-1H COSY,1H-13C HSQC,1H-13C HMBC和DEPT)以及质谱方法对瑞芬太尼酸的结构信息进行了鉴别研究。 其中紫外吸收光谱显示瑞芬太尼酸的芳香结构和共轭体系信息, 在紫外末端附近与254.0 nm附近有最大吸收, 分别与该物质E2和B带相对应, 说明分子中存在苯环特征结构。 采用溴化钾压片法制备瑞芬太尼酸样品, 进行红外光谱测试, 红外吸收光谱显示各个官能团的特征吸收峰, 均与瑞芬太尼酸结构中的主要官能团相一致。 利用NMR波谱法(包含1H NMR,13C NMR,1H-1H COSY,1H-13C HSQC,1H-13C HMBC和DEPT)对瑞芬太尼酸所有的1H NMR和13C NMR信号进行了全面归属。 通过正离子检测模式进行质谱分析, 检测到质荷比( m/z)为362.98, 331.02, 303.10和259.09等碎片离子峰, 此检测结果与瑞芬太尼酸的分子量相一致, 且与瑞芬太尼酸的结构特征相对应。 结合光谱法等多种谱学技术可有效解析瑞芬太尼酸的波谱学数据, 并确证其结构。 结果表明: 多种谱学数据显示与瑞芬太尼酸的结构相一致, 可用于瑞芬太尼酸的结构研究, 并为其质量及纯度研究提供参考。
Remifentanil is a new, ideal, narcotic analgesic commonly used in surgery, which has the advantages of rapid effect, short half-life, easy to control, quick recovery after the operation etc. After entering the human body, remifentanil is mainly metabolized by the kidneys. Then remifentanil acid is formed after de-esterification metabolism. Therefore, it is necessary to study the structure of remifentanil and its metabolite remifentanic acid. At present, only the structure of the prototype drug has been studied, but the structure of its metabolite remifentanic acid has not been reported. Methods For the first time, this study established ultraviolet spectra, infrared spectra, nuclear magnetic resonance (NMR) spectra (i. e.,1H NMR,13C NMR,1H-1H COSY,1H-13C HSQC,1H-13C HMBC and DEPT) and mass spectra for the chemical structure identification of remifentanil acid. The ultraviolet spectrum showed the aromatic structure and the information of the conjugated system of remifentanil acid. The maximum absorption in the vicinity of the ultraviolet end and 254.0 nm respectively corresponded to the E2 and B bands of the substance, which showed the presence of the benzene ring characteristic structure in the molecule. The infrared spectrum test was performed by preparing the remifentanil acid samples by the potassium bromide tablet method. The infrared spectrum was used to analyze the peaks of the functional group vibrations of remifentanil acid. All the1H NMR and13C NMR chemical shift signals of the compound were assigned rationally by NMR spectroscopy (including1H NMR,13C NMR,1H-1H COSY,1H-13C HSQC,1H-13C HMBC and DEPT). Mass spectra were performed by positive electrospray ionization, and the mass-to-charge ratio ( m/z) was 362.98, 331.02, 303.10, 259.09 and so on, which was consistent with the molecular weight of remifentanil acid and corresponding to the structural characteristics of remifentanil acid. The results showed that the above analytical data of a variety of spectral techniques coincided with the structure of remifentanil acid. Spectral analytical data is shown to be consistent with the structure of remifentanil acid, which can be used in the study of the structure of remifentanil acid and provide a reference for the study of its quality and purity.
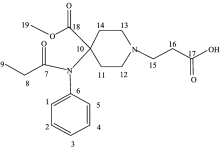
瑞芬太尼酸(remifentanil acid), 为瑞芬太尼的主要羧酸代谢产物, 化学名4-(甲氧羰基)-4-(N-苯基丙酰胺基)-1-哌啶丙酸, 分子结构见图1。 瑞芬太尼是由葛兰素史克集团公司开发的一个麻醉镇痛药, 于1996年8月首次在德国上市, 是六氢吡啶的衍生物, 具有起效迅速、 阵痛效能强、 安全使用无蓄积、 不良反应小等特点, 是一个较为理想的麻醉镇痛药[1, 2, 3, 4, 5, 6, 7]。 目前, 国内外关于瑞芬太尼及瑞芬太尼酸的研究主要集中在其药效和临床研究, 文献[8, 9]报道了瑞芬太尼的质量研究进展, 而在其波谱学方面只有盐酸瑞芬太尼的核磁共振氢谱和碳谱数据[10], 但瑞芬太尼酸的完整波谱数据及结构确证尚未见报道。 本文采用红外吸收光谱(infrared spectroscopy, IR)、 紫外吸收光谱(ultraviolet spectroscopy, UV)、 核磁共振(nuclear magnetic resonance, NMR)(包括1H NMR, 13C NMR, 1H-1H COSY, 1H-13C HSQC, 1H-13C HMBC和DEPT)波谱、 质谱(mass spectrometry, MS)等谱学技术, 对瑞芬太尼酸的波谱学数据和结构进行了详细解析, 并对其结构进行了确证。 这些数据均未见有文献报道。
Shimadzu UV-2410紫外光谱仪(日本岛津制作所)。 Jasco FT/IR-4100红外光谱仪, 溴化钾(KBr)压片(日本佳司科公司)。 Thermo Finnigan TSQ Quantum质谱联用仪(美国赛默飞世尔科技公司)。 Bruker AV-500型核磁共振仪(内标: 四甲基硅烷, TMS)(德国布鲁克公司)。
氘代二甲基亚砜(DMSO-d6, 美国剑桥同位素实验室公司)。 甲醇(色谱纯, 德国默克公司)。 其他试剂为分析纯。 实验用水为去离子水。
瑞芬太尼酸样品为白色结晶粉末, 易溶于稀酸、 甲醇。 利用高效液相色谱仪(high performance liquid chromatography, HPLC)测定瑞芬太尼酸样品纯度为99.88%, 符合结构确证所需纯度。
1H NMR, 13C NMR, 1H-1H COSY, 1H-13C HSQC, 1H-13C HMBC和DEPT谱均在Bruker AV-500型核磁共振仪上测定, 采用直径5 mm的NMR样品管, 配备5 mm QNP反向探头检测, 以TMS为内标(δ H 0.00, δ C 0.0), DMSO-d6为溶剂, 实验温度为25 ℃。 1H NMR的工作频率为500.15 MHz, 谱宽为5 387.95 Hz; 13C NMR的工作频率为125.78 MHz, 谱宽为30 303.05 Hz。 DEPT谱的工作频率和谱宽与13C NMR相同。 二维核磁谱包括2D梯度场1H-1H COSY, 1H-13C HSQC及1H-13C HMBC谱, 采用标准脉冲程序。 1H-1H COSY谱的F2维(1H)及F1维(1H)的谱宽均为5 387.95 Hz, 采样数据点阵t2× t1=1 024× 512; 1H-13C HMBC和1H-13C HSQC谱的F2维(1H)及F1维(13C)谱宽分别为5 387.95和30 303.05 Hz, 采样数据点阵t2× t1=1 024× 512。
瑞芬太尼酸样品在甲醇溶液中的紫外吸收光谱显示, 在紫外末端204.0 nm附近有最大吸收, 为苯环的共轭烯键π → π * 反键轨道的跃迁产生的吸收带, 属于E2吸收带, 同时苯环与酰胺氮原子共轭, E2吸收带与K吸收带重叠; 在254.0 nm附近有弱的吸收峰, 是由苯环的π → π * 跃迁产生的吸收带, 属于B吸收带, 是苯环的特征吸收, 说明分子中有苯环存在, 与瑞芬太尼酸的分子结构相符。
采用溴化钾压片法制备瑞芬太尼酸样品, 进行红外光谱测试。 在瑞芬太尼酸的红外吸收光谱(图2)中, 3 500~2 400 cm-1区域范围有宽的吸收峰, 为分子中羧酸O— H的伸缩振动, 1 727.9 cm-1区域有强吸收峰, 为羧酸羰基C=O的伸缩振动, 1 233.3和1 200.0 cm-1区域附近有两个强吸收峰, 为羧酸及羧酸酯C— O的伸缩振动, 表明分子中含羧酸结构。 1 740.4 cm-1区域有强吸收峰, 为羧酸酯羰基C=O的伸缩振动, 表明分子中含羧酸酯结构。 1 649.8 cm-1区域有强吸收峰, 为酰胺羰基C=O的伸缩振动, 1 300.0 cm-1区域有强吸收峰, 为酰胺C— N的伸缩振动, 表明分子中含酰胺结构。 1 170.6 cm-1区域有强吸收峰, 为杂环C— N的伸缩振动, 表明分子中含脂肪胺结构。 3 019.0和3 000.7 cm-1区域有中等强度吸收峰, 为苯环=C— H的伸缩振动, 1 594.8, 1 491.7和1 472.4 cm-1区域有中等强度且尖的吸收峰, 为苯环骨架C=C的伸缩振动, 1 000~ 900 cm-1区域有多个中等强度吸收峰, 为苯环=C— H的面内弯曲振动, 表明分子中含苯环结构。 701.9 cm-1区域有一个中等强度且尖锐的吸收峰, 为苯环=C— H的面外弯曲振动及苯环的骨架变形振动, 说明分子中存在单取代苯环结构。 2 974.7 cm-1区域附近有多个中等强度吸收峰, 为甲基、 亚甲基C— H的伸缩振动, 1 392.4 cm-1区域有强吸收峰, 为甲基C— H的面内弯曲振动, 表明分子中含甲基— CH3、 亚甲基— CH2— 基团。
上述结果表明, 分子中含有单取代苯环、 甲基基团、 亚甲基基团、 脂肪醚键、 羧酸结构、 羧酸酯结构和酰胺结构, 与瑞芬太尼酸结构中的主要官能团相一致。 瑞芬太尼酸的红外吸收光谱数据分析及归属见表1。
| 表1 瑞芬太尼酸的红外吸收光谱主要吸收峰数据及归属 Table 1 Infrared absorption spectrum data and assignment of remifentanil acid |
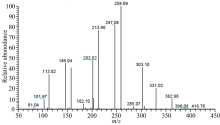
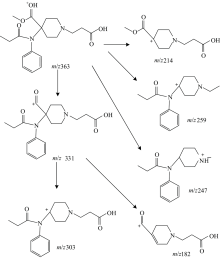
瑞芬太尼酸的质谱见图3, 正离子检测模式检测到质荷比(m/z)为362.98的碎片离子峰, 为[M+H]+的准分子离子峰。 另外检测到质荷比(m/z)为331.02, 303.10, 259.09, 247.06, 213.96, 202.02, 158.00, 146.04, 113.02和101.97等碎片离子峰。 瑞芬太尼酸的分子式为C19H26N2O5, 分子量为362, 因此该检测结果与瑞芬太尼酸的分子量一致, 且与瑞芬太尼酸的结构特征相应。 根据化合物的结构, 对主要碎片离子峰进行解析, 可能的裂解途径见图4。
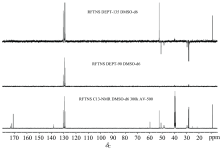
瑞芬太尼酸化合物的1H NMR谱(图5)显示有12组质子信号, 与26个质子相对应。 13C-NMR谱和DEPT谱(图6)显示, 除去溶剂峰(δ C39.00~40.00), 共有15组碳核信号, 与19个碳核相对应, 其结构中含2个伯碳(δ C8.9, δ C52.3), 5个仲碳(δ C28.2, δ C28.5, δ C29.7, δ C48.5, δ C50.8), 3个叔碳(δ C128.9, δ C129.5, δ C130.4), 5个季碳(δ C59.8, δ C171.2, δ C172.3, δ C173.3, δ C138.2)。 综合1H-1H COSY谱(图7)、 1H-13C HSQC谱[图8(a, b, c, d)]和1H-13C HMBC谱[图9(a, b, c, d)], 分析如下:
 | 图7 瑞芬太尼酸的1H-1H COSY图 (a)全谱; (b)和(c)为(a)部分放大图Fig.7 1H-1H COSY spectra of remifentanil acid (a): Full spectrum; (b), (c): Local amplified spectra of (a) |
 | 图8 瑞芬太尼酸的1H-13C HSQC图 (a)全谱; (b)— (d)为(a)部分放大图Fig.8 1H-13C HSQC spectra of remifentanil acid (a): Full spectrum; (b)— (d): Local amplified spectra of (a) |
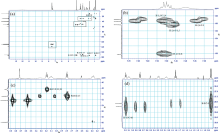 | 图9 瑞芬太尼酸的1H-13C HMBC图 (a): 全谱; (b), (c), (d)为(a)部分放大图Fig.9 1H-13C HMBC spectra of remifentanil acid (a): Full spectrum; (b), (c), (d): Local amplified spectra of (a) |
在COSY谱中, δ H7.40 (1H, m)与δ H7.46~7.48 (2H, m), δ H7.49~7.53 (2H, m)顺次偶合相关, 因此δ H7.40 (1H, m)被归属为H-3。 在HSQC谱中, δ C 130.4与H-3相关, 被归属为C-3。 在HMBC谱中, δ H7.46~7.48 (2H, m)与C-3远程相关, 被归属为H-2和H-4。 在HSQC谱中, δ C 128.9与H-2, H-4相关, 被归属为C-2和C-4。 在HMBC谱中, δ H7.49~7.53 (2H, m)与C-2、 δ C 138.2远程相关, 被归属为H-1和H-5。 在HSQC谱中, δ C 129.5与H-1, H-5相关, 被归属为C-1和C-5。 DEPT谱和13C-NMR谱显示, δ C138.2为季碳, 因此被归属为C-6。
在COSY谱中, δ H3.72~3.76 (3H, s)没有相关信号峰, 被归属为H-19。 在HSQC谱中, δ C 52.3与H-19相关, 被归属为C-19。 在HMBC谱中, H-19与δ C 172.3远程相关; DEPT谱和13C-NMR谱显示, δ C 172.3为季碳, 因此δ C 172.3为C-18。
在COSY谱中[图7(a, b, c)], δ H0.82~0.85 (3H, t)与δ H1.79~1.83 (2H, q)偶合相关, 因此δ H0.82~0.85 (3H, t)被归属为H-9, δ H1.79~1.83 (2H, q)被归属为H-8。 在HSQC谱中, δ C 8.9和δ C 28.2分别与H-9、 H-8相关, 因此分别被归属为C-9和C-8。 在HMBC谱中, H-9与C-8, δ C 173.3远程相关, H-8与C-9, δ C 173.3远程相关; DEPT谱和13C-NMR谱显示, δ C173.3为季碳, 因此δ C 173.3被归属为C-7。
在COSY谱中, δ H2.78~2.81 (2H, t)与δ H3.17~3.19 (2H, t)偶合相关。 在HMBC谱中, δ H2.78~2.81 (2H, t)与δ C50.8, δ C171.2远程相关, δ H3.17~3.19 (2H, t)与δ C28.5, δ C48.5和δ C171.2远程相关。 因此δ H3.17~3.19 (2H, t)更靠近电负性大的氮原子, 被归属为H-15; δ H2.78~2.81 (2H, t)远离氮原子, 被归属为H-16。 在HSQC谱中, δ C 50.8和δ C 28.5分别与H-15, H-16相关, 因此分别被归属为C-15和C-16。 DEPT谱和13C-NMR谱显示, δ C171.2为季碳, 因此δ C 171.2被归属为C-17。 δ H11.99为羧酸质子信号。
在COSY谱[图7(a, b, c)]中, δ H2.07~2.09 (2H, m), δ H2.27~2.30 (2H, m), δ H3.10~3.12 (2H, m), δ H3.20~3.32 (2H, m)顺次偶合相关。 在HMBC谱中, δ H3.10~3.12 (2H, m), δ H3.20~3.32 (2H, m)与δ C50.8远程相关, δ H2.07~2.09 (2H, m), δ H2.27~2.30 (2H, m)没有相关信号峰, 因此δ H3.10~3.12 (2H, m), δ H3.20~3.32 (2H, m)被归属为H-12和H-13。 因为瑞芬太尼酸的六氢哌啶环结构上的同碳质子不等价且相互偶合相关, 是由横键及竖键
质子所受的屏蔽效应的差异所致, 且横键质子的化学位移均大于竖键质子的化学位移, 因此δ H3.10~3.12 (2H, m)被归属为H-12α 和H-13α , δ H3.20~3.32 (2H, m)被归属为H-12β 和H-13β 。 在HSQC谱中[见图8(a, b, c, d)], δ C 48.5与H-12, H-13相关, 被归属为C-12和C-13。 同理, δ H2.07~2.09 (2H, m)被归属为H-11α 和H-14α , δ H2.27~2.30 (2H, m)被归属为H-11β 和H-14β 。 在HSQC谱中, δ C 29.7与H-11, H-14相关, 被归属为C-11和C-14。 DEPT谱和13C-NMR谱显示, δ C 59.8为季碳, 因此δ C 59.8为C-10。
具体的1H NMR 和13C NMR数据及归属见表2, 均与瑞芬太尼酸的结构一致。
| 表2 瑞芬太尼酸 1H-NMR 和 13C-NMR 归属(DMSO-d6, 500 MHz) Table 2 1H-NMR and 13C-NMR data of remifentanil acid (DMSO-d6, 500 MHz) |
通过红外吸收光谱(IR)、 紫外吸收光谱(UV)、 核磁共振(NMR)(包括1H NMR, 13C NMR, 1H-1H COSY, 1H-13C HSQC, 1H-13C HMBC和DEPT)谱、 质谱(MS)谱图测定和解析, 对瑞芬太尼酸的化学结构进行了全面的分析和确证。 其中, 通过紫外吸收光谱显示瑞芬太尼酸的特征官能团, 红外吸收光谱显示其各个基团的特征吸收峰, 质谱显示其分子量, 最后通过核磁共振谱的测定和解析, 对瑞芬太尼酸的全部1H-NMR和13C-NMR信号进行归属, 从而确证了瑞芬太尼酸的分子结构。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|