作者简介: 黄 睿, 1999年生, 闽江学院材料与工程系本科生 e-mail: 517486529@qq.com
红外光谱与化学计量学结合成为植物油鉴定的热门方法, 这种结合目前都基于植物油红外光谱, 提取了植物油主成分可皂化物的红外光谱信息未有效提取植物油微量成分不皂化物的信息, 所构建的植物油鉴定模型的敏感性仍有待提高。 不皂化物特征性强, 为有效获取其红外光谱, 需要预先分离富集, 现有的植物油不皂化物分离富集方法操作过程繁琐、 耗时, 批量样本基本无法采用这种方法。 采用增加皂化液碱度、 超声加热皂化的方法提高植物油皂化效率, 缩短皂化时间。 在提高皂化速度的基础上, 通过①合理配置正己烷、 乙醇及水的比例形成易分层体系; ②将有机溶剂多次提取改为一次提取; ③特别是采用首次研制的专用固相萃取小柱, 一次性快速去除有机相中残余碱性物质和水, 大大缩短不皂化物提取时间。 不皂化物分离富集时间从国标法的约2~3 h缩短至本法的约20 min。 新建的不皂化物分离富集方法有很好的稳定性, 同一样本不同人员分别制样, 得到的不皂化物红外光谱相同, 可以保证一个样品一种光谱。 该方法的建立不仅解决了基于不皂化物红外光谱结合化学计量学构建植物油鉴定模型的关键技术问题, 还为色谱与色质联用技术测定植物油不皂化物的快速样品前处理创造前景。 采用所建立的植物油不皂化物快速分离富集方法, 提取五个不同品牌的芝麻油和五个不同品牌玉米油不皂化物, 并采集它们的红外光谱, 实验数据表明: 红外光谱几乎完全相同的芝麻油与玉米油其不皂化物红外光谱有非常大的差异。 可以预测, 在植物油红外光谱基础上, 结合其不皂化物红外光谱数据, 将可以大大提高某些植物油(如芝麻油)红外光谱鉴定方法的敏感性。
Infrared spectroscopy combined with chemometrics, has become a popular method for the identification of vegetable oil. However, this combination is currently based on the infrared spectra of vegetable oil. Although the infrared spectra information of the saponifiable of vegetable oil is extracted, the information of unsaponifiable is not effectively extracted. The sensitivity of the constructed vegetable oil identification model still needs to be improved. Unsaponifiable is important characteristic components. In order to effectively obtain their infrared spectra, it is necessary to separate and concentrate it in advance. However, the existing separation and enrichment method is cumbersome and time-consuming, and can’t be adopted for the batch samples of vegetable oil. In this paper, under high alkalinity, instead of reflux heating ultrasonic heating, was used to shorten the saponification time. On this basis, through ① the reasonable ratio of n-hexane, ethanol and water to form an easy layering system; ② one extraction replacing multiple extractions; ③ designing and developing a dedicated solid phase extraction small column to rapid remove residual alkaline substance and water in the organic phase at one time, the extraction time of unsaponifiable was shortened greatly. The time of separation and enrichment was shortened from about 2~3 hours with the national standard method to about 20 minutes with the newly established method. The new method has good stability. The same sample was prepared by different people, and their infrared spectra were the same, which could ensure the same infrared spectra for one sample. The establishment of this method not only solves the key technical problems of constructing a model of vegetable oil identification based on infrared spectra of unsaponifiable combined with chemometrics but also creates a prospect for rapid sample preparation of unsaponifiable by chromatography/hyphenated chromatography. Using the rapid separation and enrichment method to unsaponifiable of five different brands of sesame oil and five different brands corn oil were extracted, and their spectra were collected. The experimental result shows that there is a great difference between infrared spectra of unsaponifiable of sesame oil and that of corn oil, although infrared spectra of sesame oil and corn oil are almost the same. It can be predicted that the infrared spectra of vegetable oils can be combined with their unsaponifiable infrared spectra to greatly improve the sensitivity of identification methods for some kinds of vegetable oil such as sesame oil.
植物油由可皂化物和不皂化物两类物质构成。 可皂化物占98.5%~99.5%, 主要是各种脂肪酸甘油酯, 种类多达百种; 不皂化物占0.5%~1.5%, 主要包括各种植物甾醇、 生育酚、 角鲨烯、 色素等[1, 2]。 由于食用植物油成分复杂, 加上各种食用植物油成分非常相似, 因此, 在食用植物油掺假中最难筛查的是它们之间的掺假(以下简称掺假植物油)如高价油中掺入低价油。 掺假植物油不仅影响到广大消费者的身体健康, 也破坏了食用油行业的生产规范, 违反我国食品安全法[3]。 纵观植物油鉴定/掺假植物油筛查方法, 主要有色谱法(包括其联用技术)和光谱法两大类[4]。 前者存在制样耗时、 繁琐、 分析成本高、 检测周期长[5] 等众所周知的弱点。 此外, 色谱法测定脂肪酸甘油酯[6]、 不皂化物等特征物质[7], 需要采用不同制样方法、 不同色谱条件, 分析成本与检测周期更难把握, 因此这类技术难以满足市场监管要求[8]。 光谱技术制样简单、 分析周期短, 其中红外光谱更以分析速度快、 分析成本低且能获取丰富的化学成分结构信息, 成为光谱方法中研究热门[9, 10]。 但光谱方法通常特异性、 敏感性不如色谱法[11]。 近年来迅猛发展的红外光谱与化学计量学结合[12, 13]的方法, 提高了光谱信息提取能力。 尽管如此, 这种结合目前都是基于植物油红外光谱数据, 提取了植物油主成分脂肪酸甘油酯信息但未有效提取植物油另一类特征物质微量成分不皂化物的信息, 所构建的植物油鉴定/掺假植物油筛查模型, 对于掺入与目标植物油主成分差异大的掺杂植物油, 模型能很好地鉴别[8], 如加入棕榈油的掺假花生油, 加入大豆油的掺假橄榄油等; 而对于掺入与目标植物主成分差异小的掺杂植物油[14], 则鉴别效果差, 如加入玉米油的掺假芝麻油, 加入玉米油或大豆油的掺假花生油等。 因此, 目前红外光谱与化学计量学结合所构建的植物油鉴定/掺假植物油筛查模型的敏感性仍有待提高。 不皂化物特征性强[3], 其测定都是基于色谱法[15, 16]。 由于植物油中不皂化物含量低, 为了有效获取它们的红外光谱信息, 首先需要对其进行分离富集。 目前的方法是采用回流加热皂化、 有机溶剂多次提取、 反复水洗除有机相碱性物质、 最后除有机相中水, 整个过程操作非常繁琐, 耗时(约2~3 h)。 这种方法基本无法应用于批量样品, 这也是至今未见基于不皂化物红外光谱结合化学计量学方法进行植物油鉴定/掺假植物油筛查的相关文献报道的重要原因。 本研究从以下策略着手: ①提高植物油皂化反应速度; ②设计合理溶剂比例、 简化不皂化物提取步骤; ③建立有机相快速除皂、 除水技术, 发展快速、 方便的植物油不皂化物分离富集方法, 为有效获取批量植物油不皂化物红外光谱信息, 全面分析植物油各类物质红外光谱, 构建高敏感性高特异性的快速植物油鉴定/掺假植物油筛查方法奠定基础。
IS5傅里叶变换红外光谱仪(赛默飞世尔); ATR-ID7附件; P210超声仪(Elma)。
6 mL solid phase extraction(SPE)小柱塑料管及筛板购自Agilent公司。 3A分子筛(Ф =1 mm)购自郑州天祥无机材料有限公司。 95%乙醇、 正己烷、 氢氧化钾均为分析纯, 购自国药集团化学试剂有限公司。
5种品牌芝麻油和5种品牌玉米油均购于大型超市。
1.2.1 红外光谱采集
波数范围3 100~670 cm-1, 分辨率4 cm-1, 扫描次数32, 植物油、 不皂化物直接涂抹在ATR-ID7金刚石晶体表面, 采集的红外光谱通过OMNIC软件, 经自动基线校正、 纵坐标归一化后保存。 光谱采集后, 晶体用正己烷清洗两次, 然后用丙酮清洗, 并用软布擦干, 再涂抹下一个样品。
1.2.2 溶液配制
2 mol·L-1 氢氧化钾乙醇溶液(皂化液): 称取一定量氢氧化钾, 用少量去离子水溶解, 转移到容量瓶中, 用95%乙醇定容至刻度。
乙醇水溶液: 10%(V/V)乙醇水溶液。
1.2.3 皂化条件研究
为了加快皂化反应速度缩短皂化时间, 本研究改用超声加热代替回流加热。 称取2 g玉米油样于45 mL具塞样品瓶中, 添加30 mL皂化液, 涡旋震荡30 sec。 对以下关键皂化条件进行优化: (1)超声仪在sweep模式下, 通过合理搭配频率(frequency)与能量(power)参数进行两个参数的优化; (2)确定超声仪频率与能量后, 进行最佳皂化温度研究; (3)基于前面两个实验结果, 进行最佳皂化时间研究。 不皂化物提取采用国标法[17], 赶尽不皂化物溶液中溶剂(60 ℃水浴), 采集不皂化物红外光谱。
1.2.4 快速提取不皂化物
为缩短不皂化物提取时间进行了如下研究:
(1)基于1.2.2的研究结果(见2.1), 在最佳皂化条件下皂化玉米油, 皂化结束后加入35 mL去离子水混匀, 研究15 mL正己烷一次及多次提取不皂化物, 依据国标法除去有机相中碱性物质及水, 赶尽溶剂(60 ℃水浴), 采集不皂化物红外光谱, 研究正己烷提取次数对不皂化物红外光谱的影响。
(2)其他操作同本节(1), 分别加入10, 15和20 mL正己烷提取不皂化物一次, 研究不同体积正己烷提取不皂化物对其红外光谱的影响。
(3)专用SPE小柱(6 mL, 带下筛板, 下层填充约1/3柱体积的无水硫酸钠, 上层填充约1/3柱体积的3A分子筛), 称取两份玉米油样, 在最佳皂化条件下皂化, 皂化结束后加入35 mL去离子水混匀, 再加入15 mL正己烷提取不皂化物一次, 吸取5 mL有机相, 过专用SPE小柱同时除去有机相中碱性物质及水, 收集流出物于25 mL蒸发皿中, 赶尽溶剂(60 ℃水浴), 采集不皂化物红外光谱; 另1份其他条件相同但采用国标法除有机相中碱性物质及水。
1.2.5 快速分离富集不皂化物方法稳定性
依据1.2.2和1.2.3实验结果, 称取4份玉米油样, 由不同人员分别按以下步骤完成不皂化物分离富集: 每份油样添加30 mL皂化液, 涡旋震荡0.5 min, 在超声器37 Hz和70% power、 皂化温度55 ℃条件下, 超声10 min, 加入35 mL去离子水混匀, 再加15 mL正己烷提取不皂化物一次, 吸取5 mL有机相, 过专用SPE小柱, 用25 mL蒸发皿收集流出液, 赶尽溶剂, 采集4份不皂化物红外光谱。
提高皂化液碱度有利于皂化反应, 因此将皂化液碱度从国标法的1 mol·L-1氢氧化钾乙醇溶液提高至2 mol·L-1。 ①超声频率frequency及能量power的选择: 在55 ℃、 10 min超声条件下, 探索37 Hz, 80 Hz, 30% power, 70% power和100% power参数的各种搭配, 实验数据表明在sweep模式下, 超声频率(frequency)37 Hz, 能量(power)70%时, 不皂化物红外光谱中表征脂肪酸甘油酯的特征吸收峰1748 cm-1峰强最小, 该条件下皂化效率最高, 因此选择该条件皂化。 ②皂化温度的选择: 分别在45, 50, 55和60 ℃皂化温度下超声15 min, 皂化温度为50 ℃时, 1 748 cm-1处只有一个很小的吸收峰, 55 ℃时1 748 cm-1吸收峰消失, 60 ℃时虽然没有1 748 cm-1吸收峰, 但在1 728 cm-1处出现微小吸收峰, 1 728 cm-1可能是温度太高部分双键氧化, 形成的酮或醛的羰基吸收峰, 因此选择55 ℃作为皂化温度。 ③皂化时间的选择: 超声皂化时间分别为5, 10和15 min, 时间为10和15 min时1 748 cm-1吸收峰消失, 因此皂化时间选10 min。 最终优化的皂化条件是: 在sweep模式下, 频率frequency 37 Hz, 能量power 70%, 皂化温度55 ℃, 皂化时间10 min。 目前回流加热皂化法需要近1~2 h才能将植物油完全皂化, 本研究新建的皂化法只要10 min, 大大缩短了皂化时间。
国标法提取不皂化物时体系易乳化, 等待分层时间长。 体系易乳化与体系组成成分有关, 可以通过改变体系的主要成分正己烷, 乙醇和水的比例加以改善。 本研究通过大量实验得出: 2 g植物油样, 添加30 mL皂化液, 按2.1优化的条件皂化, 皂化结束后添加35 mL去离子水混匀, 再加15 mL正己烷提取不皂化物(具体的比例调节过程不在此处赘述), 这种体系正己烷, 乙醇和水的比例可以克服体系易乳化的缺点, 两相分层快, 提取时间大大缩短。
红外光谱分析不皂化物, 变量是吸收峰位置及其相对强度, 关键要素是不皂化物成分构成及各成分相对含量而不是绝对含量。 因此, 只要机溶剂一次提取与多次提取的红外光谱基本相同, 可将国标法的3次提取改为1次提取。 实验结果可知: 15 mL正己烷一次、 分二次、 分三次提取, 获取的不皂化物红外光谱基本相同。 用10, 15和20 mL正己烷提取, 得到的不皂化物红外光谱也基本相同。 因此不皂化物提取步骤简化为采用15 mL正己烷提取一次。
国标法需要用乙醇水溶液多次清洗有机相去除其中残余碱性物质, 通常至少经过三次清洗, pH值才能达到中性, 最后还需用无水硫酸钠除去有机相中残余水, 这个过程时间长且操作繁琐。 无水硫酸钠吸水效率不够高, 经筛选、 测试各种除水剂, 发现3A分子筛吸水效率高, 而且有机相通过3A分子筛后pH值就达到中性。 因此专用SPE小柱选择3A分子筛和无水硫酸钠作为填充剂, 其中下层的无水硫酸钠主要用于防止3A分子筛细粉流出, 干扰不皂化物红外光谱。 有机相中残余碱性物质主要是皂, 有机相通过专用SPE小柱时水含量迅速降低, 皂析出被柱内吸附剂阻止流出, 这可能是3A分子筛能够除皂的原因。 使用这种新研制的专用SPE小柱, 能快速一次性去除有机相中残留碱性物质和水, 大大缩短提取时间, 简化操作步骤。 图1为采用专用SPE小柱及国标法除有机相碱、 水后, 不皂化物红外光谱, 由图1可知, 两种方法得到的不皂化物, 它们的红外光谱相同, 都不存在皂的红外特征吸收峰1 580 cm-1和水的红外特征吸收峰1 640 cm-1, 表明专用SPE小柱可以一次性除去有机相中残余的碱性物质和水而且小柱不吸附不皂化物。
 | 图1 分别用SPE法及国标法除碱性物质和水后, 玉米油不皂化物红外光谱Fig.1 Infrared spectra of unsaponifiables of corn oil after removing alkaline substance and water by SPE and national standard method respectively |
通过上述改进, 不皂化物的提取时间从国标法的约1 h缩短至10 min。
用新建植物油不皂化分离富集方法, 同一玉米油样品不同人员分别制样, 获得的不皂化物A-1, A-2, B-1和B-2红外光谱如图2。
 | 图2 同一玉米油样品, 两人四次制样采集的玉米油不皂化物红外光谱Fig.2 Infrared spectra of unsaponifiables from same corn oil sample through two persons four times sample preparation |
图2表明四次制样得到的玉米油不皂化物红外光谱谱图相同, 说明新建的植物油不皂化物分离富集方法有很好的稳定性, 可以保证一个样品一种谱图。
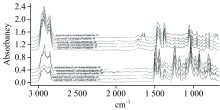
图3是五个牌号玉米油与五个牌号芝麻油红外光谱图, 由图3可知两种植物油的红外光谱几乎完全相同。 采用本文建立的植物油不皂化物快速分离富集法, 获取两种植物油不皂化物, 采集上述五个牌号玉米油与五个牌号芝麻油的不皂化物红外光谱, 它们的谱图如图4。 由图4可知, 红外光谱几乎完全相同的玉米油与芝麻油, 其不皂化物的红外光谱有很大差异。 因此, 在现有的植物油红外光谱数据的基础上添加经分离、 富集获取的不皂化物红外光谱数据, 有望大大提高红外光谱与化学计量学结合建立植物油鉴定/掺伪植物油筛查方法的敏感性。
 | 图3 五个牌号的玉米油(上)与五个牌号的芝麻油(下)红外光谱图Fig.3 Infrared spectra of five brands of corn oil (top) and five brands of sesame oil (bottom) |
采用增加皂化液碱度、 超声加热皂化的方法可提高植物油皂化效率, 缩短皂化时间。 在提高植物油皂化效率的基础上, 通过①合理配置正己烷、 乙醇及水的比例形成易分层体系; ②将有机溶剂多次提取改为一次提取; ③采用首次研制的专用SPE小柱, 一次性快速去除有机相中残余碱性物质和水, 进一步缩短不皂化物提取时间。 不皂化物分离富集时间从国标法的约2~3 h缩短至约20 min, 新建的不皂化物分离富集方法有很好的稳定性, 同一样本不同人员分别制样, 得到的不皂化物红外光谱相同, 可以保证一个样品一种红外光谱。 采用本研究所建立的植物油不皂化物快速分离富集方法, 提取五个不同品牌的芝麻油和五个不同品牌玉米油不皂化物并采集它们的红外光谱, 实验数据表明: 红外光谱几乎完全相同的芝麻油与玉米油其不皂化物红外光谱有非常大的差异。 不皂化物红外光谱特征性强, 与植物油红外光谱有互补性, 可以预测在植物油红外光谱的基础上结合其不皂化物红外光谱数据, 可以大大提高某些植物油(如芝麻油)鉴定方法的敏感性。 本工作将进一步开展各类植物油不皂化物红外光谱研究, 建立基于植物油不皂化物红外光谱与化学计量学结合的快速植物油鉴定/掺假植物油筛查方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|