作者简介: 逯美红, 女, 1979年生, 长治学院电子信息与物理系副教授 e-mail: lmhxueer@126.com
苋菜红(Amaranth)作为一种人工合成食品添加剂, 常被添加于汽水、 山楂和糖果等当中, 但苋菜红是由煤焦油中分离出来的苯胺染料为原料制成, 过量食用会导致基因突变甚至致癌, 严重危害身体健康。 因此, 对其检测至关重要。 表面增强拉曼光谱技术具有样品前处理简单、 分析速度快和准确性高等优点, 已在化学、 生物和医学领域越来越显示出巨大的潜能。 目前, 用拉曼光谱技术对苋菜红检测的理论与实验研究还未见报道。 而对拉曼光谱及表面增强理论机理的研究可以为在食品中检测及鉴定苋菜红提供可靠的科学依据。 所以利用密度泛函理论全面探究苋菜红的表面增强拉曼机理并与实验结果进行对比, 对食品中的苋菜红检测研究有很好的预测及指导意义。 一方面, 利用共聚焦显微拉曼光谱仪对苋菜红粉末进行拉曼光谱检测, 得到其拉曼光谱; 另一方面, 搭建苋菜红分子结构, 并基于密度泛函理论对分子结构进行优化处理, 从前线轨道、 静电势、 极化率及自然键轨道布局分析四个角度进行计算分析, 得出偶氮基团处(—N15=N16—)是苋菜红分子与Ag原子配位的最佳位置。 在此基础上, 使用B3LYP/6-31++G(d, p))基组(C, H, O, N, S, Na)和B3LYP/Sdd基组(Ag)对苋菜红分子与1个Ag原子及3个Ag原子团簇的复合物(Amaranth-Ag1, Amaranth-Ag3)进行结构优化和表面增强拉曼光谱计算。 将苋菜红分子的实验与理论拉曼光谱进行比较, 发现二者吻合较好, 且在1 228, 1 329, 1 467和1 529 cm-1处苋菜红分子的拉曼活性很明显。 另外, 苋菜红与Ag的复合物有明显的拉曼增强效应, 增强效果随着Ag原子个数的增多而愈加明显, 不仅拉曼光谱的峰值个数有增多, 而且其对应光谱峰位强度也有增强。 进一步通过振动模式的归属, 得到鉴定和识别苋菜红的拉曼特征峰。 该研究为利用表面增强拉曼光谱技术检测食品中的苋菜红提供了一定的实验参考和理论依据。
Amaranth is a synthetic food additive. It is often added to soda, hawthorn and candy, etc. However, Amaranth is made from the coal tar isolated by the benzene dye as raw material, and excessive consumption will lead to genetic mutations and even cancer, which is harmful to health. Therefore, the detection of Amaranth is important and necessary. Surface-enhanced Raman spectroscopy has the advantages of simple pre-processing, rapid analysis and high accuracy for samples, which has been increasingly shown great potential in the fields of chemistry, biology and medicine. At present, the theoretical and experimental research on Amaranth with Raman spectroscopy technology has not been reported. The study of Raman spectroscopy and the theoretical mechanism of surface enhancement can provide a reliable scientific basis for the detection and identification of Amaranth in food. Therefore, the study on the surface-enhanced Raman mechanism of Amaranth and compare it with the experimental results using the density functional theory is necessary. It has a good prediction and guiding significance for the detection of Amaranth in food. On the one hand, Amaranth was detected by using micro-confocal Raman spectrometer. On the other hand, the structure of Amaranth was built, and Density Functional Theory was used to optimize the molecular structure and calculate the front-line orbit, electrostatic potential, polarization and natural bond orbital analysis. And the azo group (—N15=N16—) is the best position for Amaranth to coordinate with Ag atom. The optimum structure and surface-enhanced Raman spectra of Amaranth-Ag1, Amaranth-Ag3 complexes molecules were calculated by using B3LYP function with 6-31++G (d, p) (C, H, O, N, S, Na) base set and Sdd (Ag) base set, receptively. The results showed that the experimental results at 1 228, 1 329, 1 467 and 1 529 cm-1 were in good agreement with the theoretical results and the Raman activity of Amaranth molecule was obvious. Raman enhancement effect of Amaranth-Ag complex was significant and the Raman enhancement effect increases with the number of Ag atoms. It can be found that not only the numbers of Raman peaks increased, but also the corresponding intensity increased. Furthermore, the vibrational mode was assigned and the characteristic peaks for detection and inspection of Amaranth can be found. The study provides an experimental reference and theoretical basis for the detection of Amaranth by using surface-enhanced Raman spectroscopy.
苋菜红又称为鸡冠花红、 萘酚红, 属于偶氮类磺酸型水溶性人工合成色素, 可以用于食品、 药品、 化妆品等的着色。 而人工合成食品色素多由煤焦油、 苯、 萘等芳香化合物为原料制成, 若过量添加会导致基因突变甚至致癌, 威胁人类健康[1], 所以对苋菜红的检测显得尤为重要。
目前, 常用的检测方法有高效液相色谱法[2]、 示波极谱法[3]、 光谱扫描法[4], 这些方法大都具有操作繁杂、 实验条件苛刻、 样品制备复杂、 对样品损害性高等不利因素。 因此, 亟需一种操作简单、 准确性很高的技术来检测人工合成色素。 拉曼光谱技术通过指认分子的特征峰识别与鉴定分子结构, 已在化学、 农学和医疗方面得到广泛的应用[5, 6, 7], 但对于低浓度痕量色素检测通常需要进行表面增强, 这就是表面增强拉曼光谱技术。 庄志萍等对除草剂西玛津表面增强拉曼光谱的密度泛函理论进行了研究[8], 邹乔等对菲分子结构与光谱进行了密度泛函理论研究[9], 陈玉锋等对杀菌剂三环唑的表面增强拉曼光谱进行了研究[10], 但对人工合成色素苋菜红分子的表面增强拉曼光谱的实验和理论研究还未见报道。
从实验与理论两个方面对苋菜红分子的常规拉曼光谱与表面增强拉曼光谱进行研究, 通过对苋菜红分子的前线轨道、 静电势与极化率的计算和分析, 探究该分子与Ag原子配位的合适位置。 并在此基础上分别对苋菜红分子与1个Ag配位的复合物(Ag1-Amaranth)及与3个银原子团簇配位的复合物(Ag3-Amaranth)的表面增强拉曼光谱进行研究。
实验中所用样品购自生工生物(上海)股份有限公司, 粉末状。 分子式为C20H11N2Na3O10S3, 分子量为604.3。 实验测试所用仪器为显微共聚焦拉曼光谱仪(德国Bruker)。 实验测试的条件为: 激发波长为532 nm, 激光功率为20 mW, 分辨率为2~3 cm-1, 在室温下对苋菜红粉末进行检测。
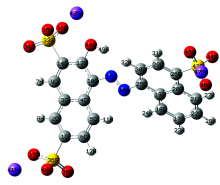
基于密度泛函理论, 优化分子结构并进行振动频率计算, 所得振动频率均大于0, 结果无虚频, 说明优化后的分子结构为稳定构型, 优化后的最小能量为-3 312.06 eV, 其优化后的分子结构如图1所示。
由图1可以看出, 苋菜红分子结构主要由两侧的两个萘环结构和中间的偶氮基团组成。 具有以下特点: ①萘环结构是由两个相连的苯环构成, 易发生取代反应而不易发生加成反应, 所以该结构主要发生亲电取代反应。 ②存在较大的共轭π 键, 也称为大π 键, 即: 具有多个相互平行且相邻的p轨道, 而且是半满能带, 所以电子可以在所有轨道上运动, 不会固定围绕在原有的原子位置, 故而容易激发; ③偶氮基团(—N=N—)为不饱和发色基团, 同时含有π 电子与n电子, 可以形成π 轨道和非键分子轨道。 由计算结果可以看出, 左侧萘环β 位上的—OH与—SO3Na形成的O48—H49…O39夹角为156.7° , 酚羟基O48与H49的键长为0.993 Å , 可以得出苋菜红分子结构内有分子内氢键, 从而影响分子结构的稳定构象与化学性质。 在偶氮基团(—N15=N16—)附近的原子是C10原子和C25原子, 且C25—N16与C10—N15的键长分别是1.410和1.392 Å 均比正常的C—N键长(1.480 Å )短, N15=N16的键长1.266 Å 比正常的键长(1.250 Å )稍长, 从而可以得出n电子与π 电子发生部分离域, 使得偶氮基团附近的单键变短, 双键变长, 形成共轭离域。 说明偶氮基团(—N15=N16—)对键长的影响不能忽略。
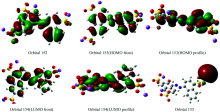
前线轨道即最高占据分子轨道(highest occupied molecular orbital, HOMO)和最低未占分子轨道(lowest unoccupied molecular orbital, LUMO)是量子化学的一个重要参数。 HOMO轨道是能量最高的电子填充轨道, 所受束缚最小, 最易失去电子; LUMO轨道是能量最低的未填充电子的空轨道, 易接受电子。 因此前线轨道决定着分子的电子得失和转移能力, 决定着分子间反应的取向等重要化学性质, 其能量及能级差对研究分子的化学性质有重要意义[13]。 计算结果表明, 第153号分子轨道为HOMO轨道, E153=-5.972 95 eV, 第154号分子轨道为LUMO轨道, E154=-3.057 23 eV, 能隙Δ E=E154-E153=-2.915 72 eV, 能隙很小。 表明电子容易从HOMO跃迁到LUMO。 为了全面进行分析电荷密度分布情况, 选择对152轨道, 153轨道, 154轨道, 155轨道分别计算电子云及分布见图2。 由图2可以看出, 苋菜红分子的HOMO, LUMO及邻近轨道上的电子云多数呈局域分布。 HOMO与LUMO轨道电子云主要分布在偶氮基团与两侧的萘环结构上, 在磺酸钠基团(—SO3Na)处都没有电子云分布, 电荷密度低, 说明—SO3Na基团对苋菜红分子的拉曼光谱特性影响较小, 反应活性主要集中于苋菜红分子偶氮基团结构处。
分子静电势是判断分子反应活性和识别分子的有效途径。 其不同颜色部位代表分子静电势定性大小, 由此可以判断分子结构与基底或其他金属原子的配位或吸附情况。 利用Gaussian09软件计算得到苋菜红分子的静电势如图3所示。 红色区域表示为负电荷或亲电区域(电子的密集区域), 容易受到亲电试剂的进攻; 蓝色区域表示为正电荷或亲核区域, 容易受到亲核试剂的进攻。 从图中可以看出, 若金属Ag原子与苋菜红分子配位, Ag原子应该选择蓝色区域处—SO3Na基团附近配位, 但由于该基团变形性小, 理论上形成稳定的包络面不宜配位, 所以, 苋菜红分子配位最佳位置是比—SO3Na基团附近电负性稍弱的区域。 苋菜红分子的萘环结构与偶氮基团为一共轭体系, 电子在整个体系上进行平均化分布, 从而在偶氮基团处观察到静电势为浅蓝色, 相对权衡之下, 选择在电子密度较大, 电负性强且电子流动性较大的偶氮基团处进行配位。
极化率及自然键轨道布局分析可以表征分子中的电子受约束及电荷转移情况, 也是基于电荷转移模型表面增强效应中化学增强的的有力证明。 基于以上前线轨道、 静电势的计算与分析, 选择苋菜红分子中距离偶氮基团2.33 Å 附近处分别配位1个Ag原子及3个Ag原子团簇形成复合物。 分别计算其极化率及自然键轨道局部分析, 结果分别如表1和表2所示。 从表1可以清楚的看出, 分子极化率三个分量α xx, α yy, α zz逐渐增加, 说明电子在金属Ag原子和苋菜红分子之间发生了转移, 从而改变了分子极化率, 发生了拉曼增强效应。 从表2中也可以看到, 随着苋菜红分子配位Ag原子个数的增多, 配位处N原子的电荷数由-0.060增加到-0.459, 与其直接配位的Ag原子电荷数由0.013 4增加到1.842, 说明该N原子的电负性增加, 更易与Ag发生电荷转移而导致化学增强。
| 表1 苋菜红、 苋菜红-Ag1和苋菜红-Ag3复合物极化率 Table 1 Polarizability of Amaranth, Amaranth-Ag1 and Amaranth-Ag3 compounds |
| 表2 苋菜红、 苋菜红-Ag1和苋菜红-Ag3复合物N和Ag的NBO电荷分析 Table 2 NBO charge analysis of Amaranth, Amaranth-Ag1 and Amaranth-Ag3 compounds |
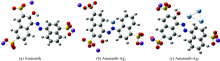
在密度泛函理论下, 对C, H, O, N, S, Na原子用基组6-31/G++(d, p)以及对Ag原子用基组Sdd进行拉曼光谱计算, 优化后的分子结构如图4所示。
计算结果中无虚频, 表明优化后Amaranth, Amaranth-Ag1, Amaranth-Ag3分子构型是稳定的。 对于苋菜红分子加入Ag原子后, 明显看出偶氮基团(—N=N—)的键长以及两侧萘环结构的二面角(C25—N16—N15—C10)发生变化。 一方面, 图4(a)中N=N的键长为1.266 Å , (b)中N=N键长为1.310 Å , (c)中N=N键长为1.328 Å , 即随着Ag原子的增多, 偶氮基团的键长逐渐变长, 且N—Ag的键长为2.330 Å , 表明苋菜红分子满足形成配位键的条件; 另一方面, Amaranth, Amaranth-Ag1, Amaranth-Ag3的C25—N16—N15—C10夹角分别为-175.4° , -173.4° 和-160.6° , 随着基底的增多, 夹角会变小, 即形成的原子团簇紧密, 两侧萘环结构更靠近偶氮基团, 容易配位, 能发生表面增强拉曼光谱效应。 与苋菜红分子的前线轨道、 静电势的研究结论基本一致。 对Amaranth, Amaranth-Ag, Amaranth-Ag3复合物的理论拉曼光谱与实验结果对比如图5所示。
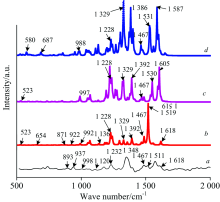 | 图5 表面增强拉曼光谱对比图Fig.5 Comparison of surface ehanced Ranman spectra (a): Experiment result; (b): Amaranth; (c): Amaranth-Ag1; (d): Amaranth-Ag3 |
图5a和b分别代表苋菜红分子的实验拉曼光谱图与理论拉曼光谱图。 由图5a可以看出, 在1 232, 1 348, 1 467和1 511 cm-1处有明显的拉曼特征峰, 与理论拉曼的特征峰1 228, 1 329, 1 467和1 529 cm-1相对应, 实验与理论结果整体吻合较好, 可以作为鉴定和识别这种物质的拉曼特征指认峰。 图5b, c和d分别为Amaranth, Amaranth-Ag1, Amaranth-Ag3的拉曼光谱图。 可以看出, 随着加入的配位Ag原子数目的增多, 拉曼特征峰有两种变化情况, 一方面拉曼特征峰个数有增多; 另一方面拉曼特征峰对应的强度有加强。 且随着偶氮基团处配位Ag原子的个数增多, 对应拉曼光谱的峰位强度逐渐增强。 振动模式归属见表3。
| 表3 苋菜红的实验拉曼特征峰与理论计算值及其归属 Table 3 Experimental Raman characteristic peak and theoretical calculation value of Amaranth and its assignment |
用显微共聚焦拉曼光谱仪对苋菜红(Amaranth)分子进行实验检测, 得到苋菜红分子的实验拉曼光谱图。 基于密度泛函理论, 对苋菜红分子搭建分子结构进行优化, 得到其稳定结构。 用Gaussian 09量子化学程序包计算苋菜红分子的前线轨道、 静电势及极化率, 推断出苋菜红分子在偶氮基团处容易发生取代。 在此基础上, 对Ag1-Amaranth, Ag3-Amaranth所有的复合物在B3LYP方法下使用6-31++G(d, p)(C, H, O, N, S, Na)基组以及Sdd(Ag)基组进行结构优化和振动光谱的计算。 结果说明, Ag原子对苋菜红分子起到了增强作用。 最后, 将实验与计算所得拉曼光谱图进行对比并归属, 发现两者吻合效果较好, 预测该理论的可靠性。 该结果对苋菜红分子和Ag增强基底的吸附方式, 解释表面增强机理具有重要意义, 进而为日后用表面增强拉曼光谱法检测合成色素苋菜红提供系统严谨的理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|