作者简介: 康文翠, 1993年生, 江苏大学食品与生物工程学院硕士研究生 e-mail: 1873517719@qq.com
提出了以纳米色敏传感器捕获挥发气体为中间介质的可见/近红外光谱检测霉菌感染小麦的新方法。 以霉菌感染的小麦为研究对象, 在恒温恒湿条件下储藏不同的时间; 通过纳米化处理过的色敏传感作为中间介质捕获小麦霉变后产生的特征挥发气体, 采用可见/近红外光谱检测分析挥发气体与纳米色敏传感结合前后的可见和近红外区域光谱变化特征, 结合多变量分析模型预测小麦的霉菌菌落数。 以灰绿曲霉和白曲霉为目标菌种, 分别接种至无菌小麦以培养出不同带菌量的小麦样本, 分别储藏3~9 d。 根据前期的预实验, 采用对特征霉变挥发气体敏感的色敏材料(8-(4-硝基苯基)-4,4-二氟硼二吡咯甲烷(NO2BDP)和8-(4-硝基苯基)-4,4-二氟-6-溴硼二吡咯甲烷(NO2BrBDP))组成的纳米传感器捕获特征挥发气体。 采用无皂乳化法合成纳米级微球聚苯乙烯-丙烯酸处理色敏材料, 提高色敏传感器捕获特征挥发气体的能力, 以纳米化前后的NO2BDP和NO2BrBDP四种色敏材料构建传感器阵列。 采集不同带菌量的小麦样本的可见/近红外光谱, 运用多变量分析方法对光谱信息进行变量筛选, 用平板菌落计数法测定菌落总数分别建立灰绿曲霉和白曲霉菌落总数的定量预测模型。 实验结果表明, 以纳米化NO2BDP和NO2BrBDP组成的传感器阵列为中介采集的带菌小麦的特征光谱波段建立的联合区间-无信息变量消除法偏最小二乘模型(Si-UVE-PLS)效果最佳, 此时预测集的交叉验证平方根(RMSECV)为0.444 4 lgcfu, 实测值与预测值的相关系数 Rp为0.981 1。 采用2个纳米化和2个非纳米材料组成的色敏传感阵列结合联合区间-遗传算法偏最小二乘模型(Si-GA-PLS)检测白曲霉菌落总数取得最佳检测结果, RMSECV为0.434 9 lgcfu, Rp为0.977 2。 表明通过可见/近红外光谱与纳米色敏传感器技术结合的方法, 能够良好的完成对挥发性气体的定量检测研究, 实现霉变小麦的品质监控。
This paper innovatively proposes a new method for detecting mold-infected wheat by visible/near-infrared spectroscopy, and it was employed with a nanoscale colorimetric sensor as an intermediate medium to detect volatile organic compounds (VOCs). The mold-infected wheatwas stored under constant temperature and humidity conditions for different time duration to prepare experimental samples. The wheat after mold infection had different characteristic volatile gases, and visible/near-infrared spectroscopy was used to collect the spectrum information before and after the combination of volatile gas and nanosized colorimetric sensor respectively. The multi-variable analysis model was combined to predict the number of mold colonies of wheat. The Aspergillus glaucus and Aspergillus candidus were inoculated into sterile wheat to cultivate, and wheat samples were prepared by storing for 0~9 days. According to the pre-experimental study, colorimetric material 8-(4-nitrophenyl)-4,4-difluorobora-dipyrromemethane (NO2BDP) and 8-(4-nitrophenyl)-4,4-difluoro-6-bromoborodipyrrolethane (NO2BrBDP) sensitive to volatile gases of wheat was used. A nanosized sensor array was fabricated to detect these characteristic volatile gases. The experiment used the soap-free emulsification method to synthesize a nanoscaled microsphere polystyrene-acrylic acid, and it was used to couple NO2BDP and NO2BrBDP dyes for producing nanoscale colorimetric sensors with high specific sensitivity. The spectral information of each wheat sample with different mold amount was collected by visible/near-infrared technology, as well as pre-processed by multivariate analysis. The number of colonies were determined by plate colony counting method, and quantitative prediction models were respectively established for the total number of Aspergillus glaucus and Aspergillus candidus colonies.The experimental results showed that the Si-UVE-PLS model for predicting the total number of Aspergillus glaucus colonies is the best in the characteristic spectral collected by two nanosized sensor.And the square root of the cross-validation of the prediction set was 0.444 4 lgcfu; the correlation coefficient between the measured value and the predicted value was 0.981 1. The optimal model for detecting the total number of Aspergillus candidus) colonies was the Si-GA-PLS model with the spectral data collected by the sensor consisting of two nonnanosized and two nanosized sensors. The RMSECV of the prediction set was 0.554 5 lgcfu, and the Rp in the predicted set was 0.977 2. The research results showed that the combination of visible/near-infrared spectroscopy and nanoscaled sensor technology could well complete the quantitative detection of volatile gases and realize the quality monitoring of mildew wheat.
小麦在储运过程中其抗霉性差, 极易在储藏不当的情况下感染霉菌发生霉变[1, 2], 不仅造成巨额经济损失, 甚至还产生真菌毒素, 严重威胁人畜健康。 粮食上的霉菌种类多样, 曲霉属和青霉属是最常见的菌群[3], 也是造成粮食损失最为关键的两种菌类群。 常规储藏粮食条件的初期, 田间型霉菌如链隔抱霉、 镰刀菌、 螺孢霉、 枝抱霉等的数量会以较快的速率下降, 在霉菌总数中所占的比例大大减少。 当局部有少量的水分升高时, 会首先达到灰绿曲霉、 白曲霉、 黑曲霉等这些干生型霉菌生长的条件, 这些霉菌会率先生长[4]。 在贮藏过程中发生不同霉变程度的小麦, 某些霉菌会产生不同类型和含量比例的挥发性气体, 例如灰绿曲霉和白曲霉的代谢会产生以醇酮醛等为主的有机化合物, 使得小麦带有霉腐味和酸败味[5]。 感染霉菌后的小麦会逐渐挥发出各种特异性的有机气体, 通过对挥发性气体的检测分析来判别霉变状况是小麦霉变感染检测的一个重要途径。 Anna Mü ller[6]通过气相色谱-质谱联用仪(gas chromatography-mass spectrometer, GC-MS)检测分析不同谷物霉菌菌种的挥发性物质, 并利用PCA法建立模型, 结果发现不同菌种的挥发性物质之间存在着一定的差异。 Olsson[7]等将气相色谱质谱联用技术结合电子鼻技术, 定量检测大麦样品在自然霉变过程中麦角固醇含量和相应的霉菌菌落总数, 基此建立的偏最小二乘模型(PLS)具有良好的预测麦角固醇含量能力。 Campos使用GC-MS测得发霉的小麦会产生多种挥发性有机气体, 如醇类, 醛类, 呋喃类, 酮类, 单萜类以及含氮和含硫化合物等[8]。
近红外光谱是一种有效快速检测分析有机成分的检测技术, 近年来在农产品的成分检测上[9, 10], 取得较好的检测结果。 本研究开发一种以纳米化色敏传感器捕获挥发气体为中间介质的可见/近红外光谱技术检测霉菌感染的小麦新方法。 以霉菌感染的小麦为研究对象, 以纳米化处理过的色敏传感器作为中间介质捕获感染特定霉菌后的特征挥发气体, 采用可见/近红外光谱检测分析挥发气体与纳米色敏传感结合前后的可见和近红外区域光谱变化特征, 结合多变量分析模型预测小麦的霉菌菌落数。
样品选取新鲜优质山东小麦种子“ 鲁农116” 品种。 感染了两种霉菌绿曲霉和白曲霉的不同霉变程度小麦的制备主要是通过调控接种一定量霉菌的小麦在生化培养箱中的贮藏时间来实现的, 具体操作包括: 活化与培养霉菌, 对小麦灭菌并调节水分和给小麦接种霉菌。
采用自主搭建的近红外光谱检测系统, 如图1所示, 该系统的硬件主要包括色敏传感器、 近红外光纤探头、 卤素灯的光源、 SONY公司的线阵CCDILX554B的光谱仪, 便携式近红外光谱仪以及收集处理数据的计算机。
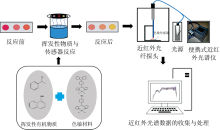 | 图1 近红外-纳米色敏传感器检测系统Fig.1 Visible/near-infrared combined with nanoscaled colorimetric sensor array detection system |
光源选用的是卤素灯可覆盖整个可见光直至近红外光谱区, 照射性能稳定且显色较好; 光谱仪采用的是索尼公司(SONY)的CCDILX554B线阵, 能够检测的光谱范围为300~1 000 nm, 可获取近红外的光谱波段。 近红外-色敏传感器系统的检测原理, 是通过获取与感染了霉菌的小麦的挥发性有机气体反应后的传感器的近红外光谱, 即通过近红外光谱检测色敏传感器的显色差异来探知小麦的霉变情况。
利用近红外-纳米色敏传感器检测系统获取纳米色敏传感器与霉变小麦反应后的光谱数据。 以灰绿曲霉为例, 用电子天平分别称量25 g新鲜小麦、 贮藏3, 5, 7和9 d的霉变小麦样本, 将上述制备好的传感器正面朝上地固定在保鲜膜上并将保鲜膜密封于称量瓶口并用皮筋固定好, 待传感器与霉变小麦挥发性气体反应达到平衡取出传感器; 最后用近红外光谱装置获取反应之后纳米色敏传感器的光谱数据。 由于色敏传感器是固体板状, 采集的是光谱的反射率, 这样可以避免样本大小、 形状、 密实度和均匀度等不同造成的偶然误差。 在平均次数为5次, 平滑点数为5, 积分时间为20 ms下分别获取与霉变小麦挥发性气体反应后的各个传感器单元的光谱信息, 获得的光谱数据中共有1 799个变量。
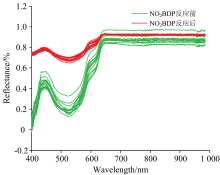
按照上述步骤采集与小麦霉变特征挥发性物质反应前后的色敏传感器的可见-近红外光谱, 如图2所示, 色敏传感器与小麦特征霉变气体反应之后采集可见-近红外光谱与反应之前的相比, 有明显的变化, 反射率有所增加, 且在400~500 nm波段内, 波峰的位置有所左移。
首先分别建立了NO2BrBDP、 NO2BDP、 纳米化NO2BrBDP和纳米化NO2BDP四个传感器单元的光谱与霉菌菌落总数的联合区间偏最小二乘法(Si-PLS)模型, 从中找出最具代表性的区间。 为了提高传感器的整体检测性能, 整合各个传感器单元中的最佳光谱数据构成新的光谱段。 采用GA和UVE两种不同的变量筛选算法进一步筛选各个联合传感器的光谱数据, 建立GA-Si-PLS检测模型和UVE-Si-PLS检测模型。 从而确定检测带菌小麦中灰绿曲霉和白曲霉的菌落总数的最佳模型。
霉菌菌落总数的测定方法参照国家食品安全标准GB 4789.15— 2016中的“ 食品微生物学试验霉菌与酵母菌数(GB 4789.15— 2016)” 。
将完成灰绿曲霉霉菌和白曲霉霉菌接种的小麦分别在30 ℃, 90%湿度的无菌培养箱培养, 培养第3, 5, 7和9 d分别取样, 对统计的菌落总数数据进行对数处理。
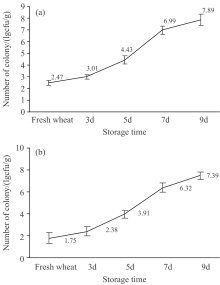
图3(a)为接种灰绿曲霉的小麦菌落总数的变化规律, 图3(b)为白曲霉的菌落总数的变化规律。 从图中可以看出, 当两种带菌小麦各自在培养箱培养到第3 d, 两种霉菌菌落总数开始持续显著提升, 在培养5 d左右后, 总数增长的速度均达到最快。 继续培养到第7~9 d时, 灰绿曲霉的菌落总数增长趋于平缓, 白曲霉的也呈现一定的平缓趋势, 可能还会有一定程度的涨幅。
纳米化色敏材料能够有效地增大与介质衬底结合交界处的比表面, 有利于色敏粒径均匀分布, 从而有助于提高色敏介质衬底与气体分子的结合力, 为高灵敏度的传感器的制作提供基础。 为了进一步探究纳米化色敏材料和非纳米材料在制成传感器后的区别, 分别测定了两者的紫外-可见光谱。 图4是纳米化色敏材料(nano-NO2BDP)和非纳米分散色敏材料(NO2BDP)的紫外-可见光谱图。 可以看出, 两种光谱在紫外可见区域均具有特征吸收, 具有一个相同的λ max值507 nm, 但各自显示出不同的吸光度值, 其中NanoNO2BDP在507 nm处的吸光度为1.54, NO2BDP的吸光度为0.73。 此外, NanoNO2BDP的R带和K带吸收峰都发生劈裂及变宽现象, 这种现象具有增色效果。
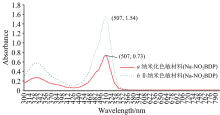 | 图4 色敏材料在CCl2溶液中的紫外和可见吸收光谱Fig.4 Ultraviolet and visible absorption spectra of the dyes in CCl2 solution |
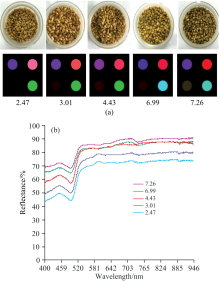
将上述制备好的纳米化色敏传感器用于对不同霉变程度小麦(新鲜小麦、 贮藏3, 5, 7, 9 d的霉变小麦)挥发性物质信息的捕捉, 如图5(a)是感染了不同霉菌灰绿曲霉的小麦及对其挥发物质捕捉的图片, 从图中可看出, 随着贮藏时间的延长, 感染了灰绿曲霉的小麦霉变程度在逐渐加深, 小麦表面的霉菌在不断第滋生。 霉变一个星期之后, 由平板菌落计数法测定小麦中灰绿曲霉总数达到6.99 lgcfu· g-1, 此时小麦表面上生长得霉菌清晰可见。 利用纳米化色敏传感器检测小麦霉变过程中的挥发性气体的变化, 通过Matlab软件计算传感器反应前后的颜色变化差值图, 得到不同贮藏时间的该色敏传感器阵列与其反应后均有肉眼可见的颜色变化, 说明该传感器能够有效地鉴别出不同霉变程度的小麦。 之后用可见-近红外光谱系统采集纳米化色敏传感器反应之后的信息, 纳米化色敏传感器(NanoNO2BrBDP)与感染了灰绿曲霉的小麦在不同贮藏时间的光谱变化信息如图5(b)所示。 由图中的光谱图可以发现, 含有不同霉菌菌落总数的光谱有着相似的整体趋势, 其反射率在波长400~500 nm内都有一个波峰, 之后均会有一个急增, 当波长达到600 nm时, 采集的反射率呈现稳定的趋势。 且随着霉菌的增多, 在同一波段范围内, 由传感器获得的近红外光谱的反射率在逐渐增大, 这表明不同霉变程度的小麦可以通过纳米化色敏传感器捕捉到挥发性气体变化特征, 此特征可以通过可见-近红外光谱技术检测到相关规律。
2.3.1 灰绿曲霉感染后菌落总数预测模型的建立
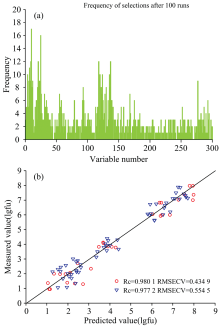
利用同一次区间划分中精度较高的几个子区间建立起一种预测样本指标的Si-PLS模型, 为了进一步提高检测灰绿曲霉菌落总数的精度, 考虑联合同类传感器单元以联合其通过Si-PLS筛选出的相应的光谱的特征区间, 先后建立Si-GA-PLS模型和UVE-GA-PLS模型, 结果见附件表1。 比较所有的预测模型, 发现以纳米化NO2BrBDP+纳米化NO2BDP的2X1式传感器基础所建立的Si-UVE-PLS模型为最佳预测霉变小麦中灰绿曲霉菌落总数的模型。 该模型预测值与实测值的相关性散点图见图6。 在最佳模型下主成分数为10时, 训练集的RMSECV最小, 为0.423 6 lgcfu, 预测集的RMSEP为0.444 4 lgcfu; 训练集中的灰绿曲霉菌落总数的实测值与预测值的相关系数Rc为0.978 3, 预测集中的相关系数Rp为0.981 1。
2.3.2 白曲霉感染后菌落总数预测模型的建立
同样地, 为建立预测性能较好的检测白曲霉菌落总数的模型通过对比模型预测结果见附件表2, 选用NO2BrBDP+NO2BDP+纳米化NO2BrBDP+纳米化NO2BDP的2X2式传感器, 根据其采集的光谱信息建立的Si-GA-PLS模型为最佳选择。 该模型的结果如图7, 训练集的RMSECV为0.434 9 lgcfu, 霉菌菌落总数的预测值与实测值相关系数Rc为0.980 1; 预测集中, RMSEP为0.655 45 lgcfu, Rp为0.977 2。
以灰绿曲霉和白曲霉为感染小麦的目标菌种, 分别接种至无菌小麦中以培养出不同带菌量(灰绿曲霉菌和白曲霉菌)的小麦样本, 按照国标法对含两种霉菌的各个样本进行菌落总数的测定。 以NO2BrBDP、 NO2BDP、 纳米化NO2BrBDP和纳米化NO2BDP构建传感器, 结合可见/近红外技术采集不同带菌量的各个小麦样本的光谱信息, 并对光谱信息进行变量筛选, 从而分别建立灰绿曲霉和白曲霉菌落总数的定量预测模型。 利用纳米化色敏传感器技术以及可见/近红外光谱分析技术分别完成了对小麦中灰绿曲霉和白曲霉的菌落总数的定量分析。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|