作者简介: 王晓霞, 女, 1984年生, 内蒙古科技大学化学与化工学院讲师 e-mail: wxx572369@163.com
美满霉素(Minocycline, MC)是一种半合成四环素类广谱抗生素, 具有较强的抗菌作用, MC经口服后迅速被吸收, 与血清白蛋白结合率为76%~83%。 研究牛血清蛋白(bovine serum albumin, BSA)与 MC之间的结合机理, 有利于在分子层面探讨MC与BSA的相互作用机制, 进一步了解MC与BSA的结构和功能关系, 并为MC的药理毒性、 药效的深入研究提供必要数据支持。 在模拟生理条件和不同的温度条件下, 采用荧光光谱、 圆二色谱、 紫外光谱和分子对接模拟技术研究MC和BSA之间的相互作用及机理。 研究结果表明, MC对BSA的荧光有猝灭作用, 且猝灭常数 KSV随温度升高而降低, 说明MC与BSA的猝灭机理为静态猝灭。 利用Stern-Volmer方程和静态猝灭双对数公式对荧光结果进行计算, 结果表明MC与BSA之间的结合位点数 n都接近于1。 根据Van’t Hoff热力学方程式在298, 303和308 K下求得热力学参数结果为焓变Δ H=-34.14 kJ·mol-1, 熵变Δ S=32.55 J·(mol·K)-1, 吉布斯自由能Δ G=-43.84 kJ·mol-1(298 K), -43.88 kJ·mol-1(303 K), -44.17 kJ·mol-1 (308 K), 证明二者之间的主要作用力为范德华力和氢键, 其作用过程为自发、 放热过程。 通过MC与BSA的紫外可见吸收光谱分析, 发现BSA的吸收峰位置有明显的红移, 表明BSA的构象发生了变化。 根据Förster’s非辐射能量转移理论得到的MC和BSA的结合距离为 r=1.873 nm, 表明在MC和BSA之间发生了非辐射能量转移。 同步荧光光谱的实验结果表明, 当MC和BSA相互作用时, BSA的构象发生了变化, 结合位点位于色氨酸(Trp)残基上。 此外, 三维荧光光谱和圆二色谱分析都进一步表明MC与BSA相互作用时会使BSA的构象变化且BSA中的色氨酸(Trp)残基周围微环境极性减小, 疏水性增强。 通过MC与BSA作用前后圆二色谱二级结构的定量分析可知: BSA中α-螺旋结构占比为31.75%, 逐步加入MC后, α-螺旋结构占比依次变为47.10%( cBSA: cTRO=1:1), 54.39%( cBSA: cTRO=1:5), 说明α-螺旋结构含量占比, BSA的结构以α-螺旋结构为主。 分子对接模拟表明MC结合在BSA的site I(亚域IIA)位置, MC分子与BSA中的氨基酸残基以范德华力结合作用的有: PHE508, LYS535, HIS534, PHE501, GLN579, VAL546, MET547, LEU528, PHE508, 以氢键结合作用的有: LYS524和LEU531, 产生超共轭效应的残基有: ALA527, VAL575, LEU531, PHE508, 这些氨基酸与MC分子紧密结合, MC使BSA的二级结构发生改变。 本实验获得的数据有助于了解MC和BSA的相互作用机制, 同时也有助于了解MC在人体的储运过程中对BSA构象的影响。
Minocycline (MC) is a semisynthetic tetracycline broad-spectrum antibiotic with stronger antibacterial activity, which is absorbed rapidly after oral administration, and the binding rate to serum protein ranges from 76% to 83%. The study of the binding mechanism between Bovine serum albumin (BSA) and MC is helpful to explore the interaction mechanism between MC and BSA at the molecular level, to further understand the structure and functional relationship of BSA and MC, and to provide necessary data support for the further study of pharmacological toxicity and efficacy of MC. The interaction between MC and BSA has been investigated by fluorescence spectroscopy, circular dichroism, ultraviolet spectroscopy and molecular docking simulation at different temperature and simulated physiological conditions. The results show that MC quenches the fluorescence of BSA, and the quenching constant decreases with the increase of temperature. This indicates that the quenching mechanism of MC and BSA is static quenching. The fluorescence results were calculated using the Stern-Volmer equation and the static quenching double logarithmic formula, and the results showed that the number of binding sites n between MC and BSA is close to 1. According to Van’t Hoff thermodynamic equation at 298, 303 and 308 K, the thermodynamic parameters were obtained as follows: enthalpy change Δ H=-34.14 kJ·mol-1, entropy change Δ S=32.55 J·(mol·K)-1, Gibbs free energy Δ G=-43.84 kJ·mol-1 (298 K), -43.88 kJ·mol-1 (303 K), -44.17 kJ·mol-1 (308 K), which proved that the main force between MC and BSA is the van der Waals and hydrogen bonding, and the process of its action is the spontaneous and exothermic process. Through the UV-visible absorption spectrum analysis of BSA and MC, the position of the absorption peak of BSA has a significant red shift, indicating that the conformation of BSA has changed. According to Förster’s theory of non-radiative energy transfer, the binding distance r between MC and BSA is 1.873 nm, which indicates that non-radiative energy transfer occurs between MC and BSA. In addition, the experimental results of synchronous fluorescence spectroscopy showed that the conformation of BSA changed when MC interacted with BSA, and the binding site was on tryptophan (Trp) residues. The results also showed that the conformation of BSA changed by three-dimensional fluorescence spectroscopy and circular dichroism, and (Trp) the polarity of the surrounding environment decreased and hydrophobicity increased. Quantitative analysis of secondary structure of circular dichroism before and after the interaction of MC and BSA showed that the content of alpha-helix structure in BSA was 31.75%. After adding MC gradually, the content of α-helix structure changed to 47.10% ( cBSA: cTRO=1:1) and 54.39% ( cBSA: cTRO=1:5), indicating that the content of α-helix structure increased, and the structure of BSA was mainly α-helix structure. Molecular docking simulation showed that MC interacts into the site I (subdomain IIA) of BSA, it forms van der Waals interaction between MC and the amino acid residues PHE508, LYS535, HIS534, PHE501, GLN579, VAL546, MET547, LEU528, PHE508 of BSA, hydrogen bonds formed between MC and the amino acid residues LYS524 and LEU531, and super conjugation also formed between MC and the amino acid residues ALA527, VAL575, LEU531, PHE508. These amino acids bind closely with MC molecules, and MC changes the secondary structure of BSA. The data obtained in this experiment are helpful to understand the interaction mechanism between MC and BSA, as well as the effect of MC on BSA conformation during storage and transportation.
美满霉素对革兰氏阳性菌、 链球菌等均高度敏感。 牛血清白蛋白是血液的主要成分, 能结合和运输外源性与内源性物质, 维持血液正常的渗透压, 具有pH缓冲作用、 载体作用[1, 2]。 牛血清白蛋白(bovine serum albumin, BSA)与人血清白蛋白(human serum albumin, HSA)的氨基酸序列具有高度同源性, 成本较低, 因此用BSA替代HSA研究药物在人体内的转运过程。
目前, 光谱法被广泛应用于药物活性成分与血清白蛋白结合作用研究中。 Samima Karina等[3]利用光谱法研究甲巰丙脯酸与牛血清白蛋白的相互作用; Leila Khalili等[4]用荧光光谱法研究了牛血清白蛋白与植物中提取的阿魏酮之间相互作用的机理。 本工作在模拟生理条件下, 研究BSA和MC之间相互作用的机理, 利用荧光光谱法和紫外-可见吸收光谱法确定了BSA和MC的主要作用力和结合距离, 使用同步荧光光谱法、 三维荧光光谱法和圆二色谱法观察了MC对BSA构象的影响, 通过分子对接模拟的方法预测了MC和BSA的作用。
荧光分光光度计(LS-55, 美国PerkinElmer公司); 紫外分光光度计(SPECORD50, 德国耶拿分析仪器股份公司); 圆二色光谱仪(Jasco-715, 北京国嘉恒业科学仪器有限公司)。
三(羟甲基)氨基甲烷[Tris (hydroxymethyl) aminomethane, Tris, 天津市华东试剂厂]; 配置成pH 7.40 的Tris-HCL缓冲液; 美满霉素(Minocycline, MC, 中国食品药品检定研究院) : 1.0× 10-3 mol· L-1标准储备液; 牛血清白蛋白(bovine serum albumin, BSA, 美国sigma公司)5.0× 10-6 mol· L-1标准液: 用含0.5 mol· L-1的NaCl的Tris-HCL缓冲液定容配制。
实验所用试剂均为分析纯, 实验用水为二次蒸馏水。
1.2.1 在不同的温度下MC与BSA的荧光光谱、 同步荧光光谱测定、 三维荧光光谱测定
溶液中MC的浓度为(0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5)× 10-5 mol· L-1, 分别在(298± 0.1), (303± 0.1)和(308± 0.1) K的恒温振荡器中振荡20 min, 分别对不同温度下的溶液进行荧光发射光谱、 同步荧光光谱扫描。 荧光参数设置如下: 激发波长280 nm, 扫描速度为1 500 nm· min-1, 狭缝宽度9 nm, 记录波长范围在290~550 nm时的荧光发射光谱。 在Δ λ =15 nm和Δ λ =60 nm条件下, 扫描同步荧光光谱。 在激发波长为200~500 nm, 发射波长200~500 nm范围内进行三维荧光扫描, 扫描速度1 500 nm· min-1。
1.2.2 MC与BSA在不同温度下的紫外光谱测定
溶液中MC的浓度为(0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5)× 10-5 mol· L-1。 用二次蒸馏水作对照参比, 分别在(298± 0.1), (303± 0.1)和(308± 0.1) K的恒温振荡器中振荡20 min后进行紫外测量, 吸收波长选择在190~400 nm。
1.2.3 MC与BSA圆二色谱测定
溶液中BSA样品浓度为1.0× 10-5 mol· L-1, MC浓度为1.0× 10-5和5.0× 10-5 mol· L-1。 扫描范围为190~250 nm, 扫描时间为0.5 s, 石英样品池的光程为0.1 cm, 扫描速度为3.3 nm· s-1, 灵敏度为2 mdeg· cm-1, 分辨率为0.1 nm, 测量时MC与BSA的浓度比为1:0, 1:1, 5:1, 并且以Tris-HCL缓冲液作为参比, 所有数据经过4次扫描取平均值。
1.2.4 分子对接模拟
BSA晶体结构取自蛋白质数据库(http: //www.rcsb.org/pdb/ home/home.do), 由Chem3D Pro 14.0软件得到MC的分子结构式, 利用软件Pymol verSion1.8.2.0.进行分子对接模拟。
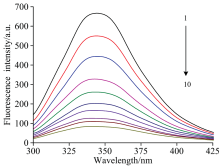
通常蛋白质分子可以吸收紫外光并发射荧光, 据此可定量检测蛋白质, 同时, 测量所产生的荧光强度可用于蛋白质相关作用的研究。 图1为298 K温度下不同浓度的MC与一定浓度的BSA作用荧光发射光谱图, BSA在激发波长280 nm处, 在发射波长346 nm处产生最大荧光发射峰。 从图1中可以看到, 随着MC浓度的逐渐增加, BSA的荧光强度呈规律性下降, 但发射峰的位置基本没有发生变化, 说明MC对BSA的荧光具有猝灭作用。
采用Stern-Volmer[5]方程式确定MC对BSA的猝灭作用机制, 方程描述为
式(1)中F0为未加入猝灭剂(MC)时的荧光强度; F为加入猝灭剂(MC)后的荧光强度; KSV为Stern-Volmer动态猝灭常数; Q为猝灭剂(MC)的浓度; Kq是双分子猝灭速率常数; 各类荧光猝灭剂对生物大分子的最大动态荧光粹速率常数约为2.0× 1010 L· (mol· s)-1; τ 0是猝灭剂不存在下生物大分子的平均寿命为10-8 s[6]。
本实验研究MC在298, 303和308 K这3种温度下对BSA的荧光猝灭情况, 以F0/F对[Q]作图, 得到Stern-Volmer曲线, 计算结果见表1。 从表1可看出, 随着温度升高, MC-BSA体系的荧光猝灭常数KSV下降, 表明MC对BSA过程符合静态猝灭特征, Kq值远远大于2.0× 1010 L· (mol· s)-1, 进一步证明MC对BSA的荧光猝灭方式是静态猝灭。
| 表1 Stern-Volmer线性方程和相关系数以及结合常数KA和结合位点数n Table 1 Stern-Volmer linear equations and correlation coefficients plus binding constants KA and binding sites n |
由于MC对BSA的荧光猝灭方式为静态猝灭, 利用静态猝灭双对数公式[7]计算结合常数和结合位点数
式(2)中: KA为MC与BSA的结合常数, n为MC与BSA的结合位点数。 根据得到的直线斜率和截距可以得到不同温度下MC与BSA的结合位点数n和结合常数KA, 见表1。 由表1可见, 结合常数KA值都在107数量级, 说明MC对BSA结合形成较稳定的复合物, 结合位点接近1, 说明MC与BSA为1:1结合类型。
根据Van’ t Hoff热力学方程式[8]在298, 303和308 K下求得热力学参数结果为焓变Δ H=-34.14 kJ· mol-1, 熵变Δ S=-32.55 J· (mol· K)-1, 吉布斯自由能Δ G=-43.84 kJ· mol-1 (298 K), -43.88 kJ· mol-1(303 K), -44.17 kJ· mol-1(308 K)。
根据Ross[9]等理论可知, Δ H< 0, Δ S< 0, 可知MC与BSA之间在结合过程中, 氢键和范德华力为主要作用力; 且Δ G< 0, 说明该反应自发进行。
如图2所示, MC的紫外吸收光谱和BSA的荧光发射光谱之间存在一定程度的重叠, 根据Fö rster’ s非辐射能量转移理论公式[10]
计算得到MC与BSA的结合距离r, 式(3)— 式(5)中J为供体的发射光谱与受体的吸收光谱两者的重叠积分, F(λ )为BSA在波长为λ 处的荧光强度, ε (λ )为MC在波长为λ 处的摩尔吸光系数, Δ λ 为激发波长与发射波长的差值; E为能量转移效率, F0为BSA溶液不加猝灭剂的荧光强度, F为加入猝灭剂后BSA的荧光强度, R0为临界能量转移距离, 即能量转移效率为50%的距离, r为给体受体间的距离; K2为偶极空间的取向因子, 取给体与供体各向随机分布平均值2/3, N为介质折射指数, 一般水和有机物折射指数的平均值1.336, Φ 为供体的荧光量子产率, 一般蛋白质中色氨酸的量子产率0.118。
图2表明, 波长在300~450 nm范围内计算浓度比为1:1时BSA的荧光光谱和MC的紫外吸收光谱的重叠积分J, J=1.942× 10-19 cm3· L· mol-1, 求得临界距离R0=0.112 3 nm, 能量转移效率E=4.1%, 结合距离r=1.873 nm。 根据Fö rster’ s非辐射能量转移理论, 结合距离r< 7 nm, 说明BSA与MC之间能发生非辐射能量转移。
2.5.1 MC与BSA作用的紫外光谱分析
紫外光谱法操作方便、 高灵敏度、 得到结果快, 分析药物-蛋白体系的相互作用类型时, 可依据二者的特征吸收峰的吸光度变化及位移, 进一步推测药物-蛋白的猝灭类型及蛋白周围微环境变化信息。 在298 K温度下, 测量在BSA中加入MC反应前后的紫外吸收光谱如图3所示。
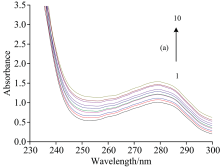 | 图3 298 K温度下MC与BSA的紫外光谱图Fig.3 Ultraviolet Spectra of MC and BSA at 298 K cBSA=2.0× 10-5 mol· L-1; cMC(1— 10): (0, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5)× 10-5 mol· L-1 |
图3为298 K温度下MC与BSA紫外光谱, 随着MC浓度的增加, BSA的最大吸收峰对应的吸光度明显增大, 最大吸收峰从278 nm处红移至280 nm处, 红移的原因是嵌入药物和蛋白质的碱基对π 电子结合, 使能量降低, 导致π → π * 跃迁能量降低[11], 说明包围在BSA内部的色氨酸和酪氨酸残基的疏水性增加, MC使BSA的二级结构发生了改变, 由于静态猝灭的吸收光谱会因为基态分子的改变而发生改变, 进一步证明两者作用为静态猝灭。
2.5.2 MC与BSA作用的同步荧光光谱分析
同步荧光光谱法相比荧光光谱法进一步提升灵敏度和增加选择性, 具有简化光谱、 减弱散射光、 窄化光谱等优点。 由图4可以看出, 当BSA浓度固定为5.0× 10-7 mol· L-1, 逐渐增加MC的浓度使两氨基酸的同步荧光光谱的荧光发射峰均出现猝灭, 图4(a)Δ λ =15 nm时, 峰形基本保持不变, 图4(b)Δ λ =60 nm荧光峰由280 nm蓝移到278 nm, 说明MC可促进BSA中色氨酸(Trp)残基所处的微环境极性减小, 疏水性增加, 亲水性降低, 引起BSA构象发生改变。 对比图5(a)与(b), 色氨酸(Trp)残基对BSA荧光猝灭的贡献要高于酪氨酸(Tyr)残基, 因此MC主要结合在BSA中的色氨酸(Trp)残基上。
2.5.3 MC与BSA三维荧光光谱分析
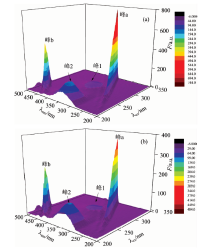
三维荧光的光谱数据相比二维荧光光谱, 具有更多的坐标点, 显示的信息更精准, 选择性更高。 BSA加入MC前后的三维荧光光谱图见图5, 三维荧光参数见表2, 由图5的三维荧光光谱中可以看到两种峰, 一种是“ 山脊” 状的有序瑞利散射峰, 如峰a, 峰b(λ ex=λ em), 加入MC后, BSA的荧光强度明显降低, 说明MC与BSA发生相互作用。 另一种是类似“ 驼峰” 的典型荧光峰, 如峰1, 峰2(2λ ex=λ em)。 其中峰1的光谱特性主要表现为Trp和Tyr残基, 峰2主要涉及到荧光光谱行为多肽骨架结构, 其强度为与蛋白质二级结构相关[12]。 从表2中可以看出峰1的最大发射波长蓝移4 nm, 这说明MC的加入引起BSA的Trp和Tyr残基周围微环境的变化, 使极性减小, 疏水性增加; 峰2的荧光强度降低, 且最大发射波长蓝移3 nm, 说明MC与BSA发生相互作用并诱导BSA的微环境和构象均发生变化。
| 表2 三维激发发射荧光光谱特征参数 Table 2 Three-dimensional fluorescence spectra characteristic parameters |
2.5.4 MC与BSA圆二色谱分析
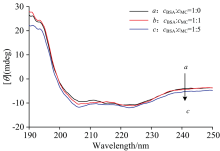
圆二色谱法(CD)是一种通过在特定波长区间处扫描蛋白体系、 药物-蛋白体系, 获得CD谱图以分析蛋白质的二级结构变化情况的方法。 由图6看出, BSA分子的圆二色谱图为双负峰形, 分别位于208和222 nm处, 这是BSA的α -螺旋结构的特征峰, 且随着MC的加入, BSA的摩尔椭圆率有所升高。 圆二色谱的测量结果用平均摩尔椭圆率(mean residue ellipticity, MRE)表示。 α -螺旋结构的含量根据以下方程计算MRE, 见式(6)和式(7)[13]
式(6)和式(7)中, θ 为CD测量的摩尔椭圆率; c为BSA的摩尔浓度, N为BSA中氨基酸残基的个数, 即583, L为所用样品池的的光程为0.1 cm; 4 000为β -折叠和无规卷曲构象在201 nm的MRE; 33 000为α -螺旋结构在208 nm处的MRE。 通过计算可知, 逐步加入MC后, BSA中α -螺旋结构含量由31.75%依次变为47.10%(cBSA:cMC=1:1), 54.39%(cBSA:cMC=1:5), α -螺旋结构含量增加, 表明了MC使得BSA分子的肽链收缩、 疏水性增加、 亲水性降低, 且以α -螺旋结构为主, 说明MC改变了BSA的二级结构。
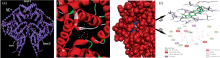
分子对接模拟技术是一种通过计算机模拟软件将小分子结构与靶蛋白进行模拟对接, 以结构的匹配程度来输出药物-蛋白体系相互作用的最优结合形式及反应参数的方法。 利用网页程序Z-Dock进行结合位点的选择和绑定点残留的选择, 然后进行分子对接模拟见图7。 图7(a)和(b)通过展示分子表面可以看出, MC结合位点在BSA的亚域区域Ⅱ A(位点site I, 即华法林位点)的疏水腔内。 分析MC与BSA结合的微环境2D和3D示意图7(c), MC分子与BSA中的氨基酸残基以范德华力结合作用的有: PHE508, LYS535, HIS534, PHE501, GLN579, VAL546, MET547, LEU528, PHE508, 以氢键结合作用的有: LYS524, LEU531, 产生超共轭效应的残基有: ALA527, VAL575, LEU531, PHE508, 可以看出各种作用力使MC与BSA紧密结合, 范德华力和氢键为两者的主要作用力, 与热力学判断结果一致。
研究表明MC与BSA的猝灭机理为静态猝灭, 并且生成稳定的配合物。 根据热力学参数的计算结果可知, Δ H< 0, Δ S< 0, MC与BSA之间的主要作用力类型为氢键和范德华力, Δ G< 0, 说明该反应是自发进行的。 MC与BSA的结合距离r=1.873 nm, 表明二者存在非辐射能量转移。 通过同步荧光光谱、 三维荧光光谱、 圆二色谱结果证明MC能够改变BSA的二级结构和微环境。 分子对接模拟表明MC结合位点在BSA的区域Ⅱ A(位点site I, 即华法林位点)的疏水腔内, 引起了周围残基微环境疏水性的变化, 研究结果为MC的临床治疗、 药效学以及药代动力学上提供了重要的理论依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|