作者简介: 赵玉岩, 1981年生, 吉林大学地球探测科学与技术学院教授 e-mail: zhaoyuyan@jlu.edu.cn
我国耕地中盐碱土分布广泛, 这对现代农业发展和农村建设造成严重制约。 盐碱土壤表层中可溶性盐类(Ca2+, K+, Na+和Mg2+)的质量分数一般可以达到0.1%~0.2%以上。 这种土壤中浓度过高的离子通过渗透、 胁迫或者离子毒害, 妨碍植物对其他离子和营养元素的吸收, 危害作物的生长。 因此, 盐碱地改良是现代农业研究的一个重要方向。 准确、 快速测量盐碱土中高含量水溶性盐阳离子K+, Ca2+, Na+和Mg2+是盐碱土改良的重要基础和关键技术问题之一。 传统的分析流程是将盐碱土置于水中振荡若干小时后, 取上清液用原子吸收光谱法进行直接测定。 由于原子吸收光谱仪的检出限远远低于待测样品含量, 测试过程中需要进行多次稀释, 增大了测试的系统误差, 降低了实验结果的可信度。 因此, 提出用X射线荧光光谱仪分别测定盐碱土样品中Ca, K, Na和Mg元素的总含量以及一定振荡时间后残渣样品中的K, Ca, Na和Mg元素含量, 计算差值求得可溶性Ca2+, K+, Na+和Mg2+含量的方法。 将测试结果与原子吸收光谱法测定的结果进行对比, 并通过pH值、 电导率以及盐碱土中主要阴离子Cl-, S
Saline-alkali soil is widely distributed in cultivated land in China, which seriously restricts the development of modern agriculture and rural construction. The mass fraction of soluble salts (Ca2+, K+, Na+ and Mg2+) in the surface layer of saline soil can reach more than 0.1%~0.2%. The excessive concentration of ions in this soil can hinder the absorption of other ions and nutrients by plants and harm the growth of crops through osmosis, stress or ion poisoning. Therefore, saline-alkali land improvement is an important direction of modern agricultural research. Accurate and rapid measurement of water-soluble cationic Ca2+, K+, Na+ and Mg2+ in saline-alkali soil is one of the important foundations and key technical problems for soil improvement. The traditional analytical procedure is oscillating the saline-alkali soil in water for several hours and then taking the supernatant solution for direct determination by atomic absorption spectrometry. As the detection limit of the atomic absorption spectrophotometer is far lower than that of the sample to be tested, multiple dilutions are required in the test process, which increases the systematic error of the test and reduces the credibility of the experimental results. Therefore, in this paper the X-ray fluorescence spectrometer was used to determine the Ca, K, Na and Mg content of original saline-alkali soil sample and residual sample after a certain oscillation time, and then the difference was calculated to obtain the soluble Ca2+, K+, Na+ and Mg2+ content. The test results were compared with those determined by atomic absorption spectrometry. The pH, electrical conductivity and the content change characteristics of the main anions Cl-, S
盐碱土是我国耕地的一种重要类型, 其土壤贫瘠, 制约了农业农村的发展, 是国家“ 脱贫攻坚战” 的重要物理障碍[1, 2]。 盐碱土中水溶性盐阳离子类型、 分布和分配、 迁移转化规律研究是盐碱土改良的重要基础性工作[3]。 能否准确快速测定高含量的水溶性盐阳离子Ca2+, K+, Na+和Mg2+是其中的关键技术问题之一[4]。
已知全球盐碱土中可溶性盐含量一般为0.1%~0.2%[5, 6]。 目前, 对盐碱土壤中的水溶态Ca, K, Na和Mg元素的含量多采用光谱和质谱法进行直接测定, 如, 王合云等[7]用原子吸收光谱法对滨海地区盐碱土中K+, Ca2+, Na+和Mg2+进行测定; 杨海峰等[8]通过电感耦合等离子体质谱法对盐碱胁迫下燕麦中Ca2+, K+和Na+进行测定。 但是由于光谱和质谱法多用于痕量和微量元素的分析, 而盐碱土中K+, Ca2+, Na+和Mg2+的含量很高, 测定的过程中需要不断地稀释溶液来匹配仪器的检出限, 必然增大了实验误差, 使测量值偏离真实值。
本文提出采用X射线荧光光谱法对盐碱土壤中的Ca, K, Na和Mg元素总量以及提取水溶态后的盐碱土壤残渣中的Ca, K, Na和Mg元素含量分别进行测定, 计算差值求可溶性Ca2+, K+, Na+和Mg2+含量的方法。 与光谱和质谱法相比, 该方法具有简单易行、 快捷准确、 安全环保等优点。 为验证方法的有效性与准确性, 将测试结果与原子吸收光谱法测定的盐碱土中水溶态Ca, K, Na和Mg元素含量进行比对, 并结合pH值、 电导率以及盐碱土中主要阴离子的含量加以佐证[9]。
饱和氯化钾溶液; 酚酞乙醇溶液(10 g· L-1); 甲基橙溶液(0.5 g· L-1); 盐酸标准溶液(0.05 mol· L-1)。 试剂均为分析纯, 超纯水的电阻率为18.2 MΩ · cm@25 ℃。 盐碱土样品采自山东东营典型盐碱土地区。
A3-AFG原子吸收光谱仪(北京普析通用)(AAS); EDX6000B X射线荧光光谱仪(江苏天瑞)(XRF); CIC-100离子色谱仪(配有SH010型电导检测器, HW2000色谱工作站, SHAC-1型色谱柱, SHBH-06型保护柱, SHY-2型自动再生抑制系统)(青岛盛瀚); DDS-307A型电导率仪(配有DJS-1C型铂黑电导电极, T-818-B-6温度电极)(上海雷磁); PHBJ-260型便携式pH计(配有E-301-C型塑壳可充式pH复合电极)(上海雷磁)。 XRF和AAS的仪器工作参数见表1。 其中XRF的检出限为ppm级, 对国家一级标准物质GBW07408进行多次测量后, 得到其对数偏差的范围为0.07%~1.24%, 相对标准偏差的范围为0.36%~4.22%, 均满足中华人民共和国地质矿产行业标准DZ/T0011— 2015中二者均应≤ 7%的要求, 表明XRF法的准确度和精密度都较高, 能满足地质分析测试要求。
| 表1 仪器工作参数 Table 1 Instrument operating parameters |
将盐碱土样品自然风干后, 过20目筛去除杂草和碎石, 粉碎至200目, 待用。 准确称量200目样品2.0 g压饼后, 用XRF在真空条件下测定Ca, K, Na和Mg含量。
准确称量10.0 g过200目筛后的样品, 置入150 mL离心杯内, 加超纯水50 mL。 在振荡机上分别振荡1, 2, 3, 4, 5和6 h, 为了防止溶液内离子饱和, 每振荡1 h后离心20 min(4 500 r· min-1), 取上层清液于烧杯中, 水浴加热, 蒸发定容至50 mL, 用AAS测定溶液中K, Na, Ca和Mg含量[10]。 将滤渣于烘箱中105 ℃烘干, 取2.0 g滤渣压饼, 用XRF测定Ca, K, Na, Mg和Si含量。
盐碱土中主要的阴离子为Cl-,
为了验证振荡前后样品中主要离子的含量变化特征, 实验过程中使用pH计和电导率仪测定所得上层清液以及样品的pH值和电导率[11]。
为了降低测试的偶然误差, XRF测试同一样品八个不同位置的Ca, K, Na, Mg和Si元素含量, 考虑到样品颗粒分布不均可能造成的数据误差, 对于含量特高或特低的离群点, 采用3S检验法对数据进行优化处理[12]。 在溶出实验中分别振荡1~6 h, 每一个时间段都设计平行试验, 数据列于表2。 考虑到振荡后不仅Ca, K, Na和Mg溶出, 还有其他离子随着振荡被溶出, 振荡会导致Ca, K, Na和Mg的百分含量降低, 但其他可溶离子(如Al3+、 Zn2+, Cl-,
| 表2 样品中Ca, K, Na, Mg和Si元素的含量(%) Table 2 The content of Ca, K, Na, Mg and Si in the sample (%) |
| 表3 盐碱土壤中Ca, K, Na和Mg元素的含量变化 Table 3 The content changes of Ca, K, Na and Mg in saline-alkali soil |
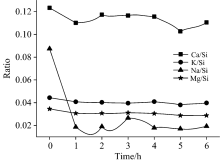 | 图1 盐碱土壤中Ca, K, Na, Mg元素的含量变化特征Fig.1 Content variation characteristics of Ca, K, Na, Mg in saline-alkali soils |
利用AAS法测得的上层清液中Ca, K, Na和Mg含量列于表4, 含量变化特征如图2, 可以看出, 样品中活动态K, Na和Mg元素的含量虽然随着振荡时间的增加含量有微小波动, 可以推测样品中活动态K, Na和Mg元素在振荡1h后全部溶出。 但是样品中活动态Ca元素的含量随着振荡时间的增加而逐渐降低, 直至4h后才逐渐趋于平稳, 这可能是由于Ca2+与溶于水中的
| 表4 盐碱土壤中活动态Ca, K, Na和Mg元素的含量(μ g· mL-1) Table 4 The contents of active Ca, K, Na and Mg in saline-alkali soil(μ g· mL-1) |
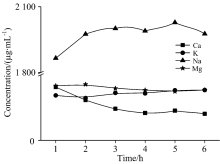 | 图2 盐碱土壤中活动态Ca, K, Na和Mg元素的含量变化特征Fig.2 Content variation characteristics of active Ca, K, Na and Mg in saline-alkali soils |
由上述两种方法所得的Ca, K, Na和Mg元素含量变化进行对比, 结果基本一致, 因此XRF可用于可溶性K, Ca, Na和Mg的溶出实验。
盐碱土壤溶液中, 与可溶性阳离子关系最密切是可溶性阴离子, 它们在溶液中平衡共存, 因而阳离子含量的变化也必然引起阴离子含量的变化, 故利用离子色谱法以及双指示剂中和法测定所得的上层清液中Cl-,
| 表5 盐碱土壤中Cl-, S |
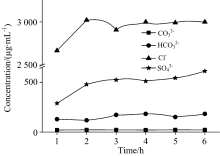 | 图3 活动态Cl-, S |
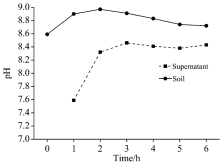
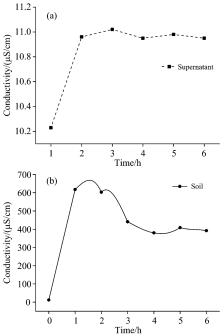
盐碱土壤溶液中各种可溶性盐类是以阴阳离子态存在的, 这些可溶性阴阳离子的含量, 影响着土壤的pH值和导电能力, 故利用pH计和电导率仪测定上层清液和土壤样品的pH值和电导率, 结果见表6, 可以得到上层清液以及土壤样品的pH值以及电导率变化特征, 如图4和图5所示。 由图4可知, 上层清液及土壤样品虽然pH值随振荡时间的变化略有起伏, 但波动不大, 因此pH值对判断振荡前后的离子含量变化效果不显著; 但是由图5可以看出振荡1~6 h后上层清液的电导率稳定在10.0~11.0 μ S· cm-1之间, 并且土壤样品的电导率在振荡1 h后迅速增加至600 μ S· cm-1以上, 在振荡2~6 h后电导率基本波动不大。 溶液的电导率越大, 说明其导电能力越强, 存在的可溶性离子越多, 溶解的盐类越多。 因此, 依据图5中电导率的变化可以间接反映盐碱土壤溶液中的溶解固体量和可溶性阳离子的含量变化, 从而证明了XRF法测定结果的可靠性。
| 表6 盐碱土壤以及上层清液的pH和电导率 Table 6 pH and conductivity of saline-alkali soil and supernatant |
通过XRF法获取盐碱土中高含量水溶性盐阳离子Ca2+, K+, Na+和Mg2+含量, 并用AAS同时测定上层清液中K, Na, Ca和Mg含量。 比较上清液中Na, K, Ca, Mg含量与振荡前后XRF法测定差值之间的关系, 并且寻找出Ca2+, K+, Na+和Mg2+溶出的最短时间。
将XRF法以及AAS法测得的数据进行对比可知, 1 h为振荡的最佳时间, 两种方法所得离子含量变化趋势基本一致, 并且由实验所得阴离子含量、 pH值以及电导率值变化特征证明了XRF法的可信性和准确性。 因此, XRF法测定盐碱土中高含量水溶性盐阳离子Ca2+, K+, Na+, Mg2+含量可行。 此方法步骤简单, 可以有效减少实验误差, 并且可以进行多次测量去除异点, 提高了实验测量值的准确度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|