作者简介: 丘家杵, 1993年生, 广东药科大学公共卫生学院硕士研究生 e-mail: qjc793509738@163.com
为了探究健康人固体血红蛋白(hemoglobin, Hb)的紫外可见吸收光谱和傅里叶变化红外光谱的谱学特征, 将21~80岁健康人分成四个年龄阶段组, 采用葡聚糖层析法高度纯化新鲜血液红细胞内的Hb, 利用冷冻干燥法获得结构稳定的Hb固体, 测定四组样本的Hb紫外可见吸收光谱和FTIR光谱; 利用OMNIC 8.0软件的QC比较分析功能、 全光谱特征分析和二级结构分析首次归纳得出健康人Hb的紫外光谱及FTIR光谱。 分析显示样本间, 四组间Hb紫外可见吸收光谱和FTIR光谱高度相同, FTIR光谱间的匹配度高达95%; 所有样本Hb的紫外光谱均有5个特征吸收峰, 吸收峰所在位置的吸光度、 波长相同; FTIR光谱均有13个特征吸收峰, 吸收峰所在位置的吸光度、 波数是相同的; Hb紫外吸收光谱显示健康人Hb拥有相同的三级结构, FTIR光谱的特征吸收带Amide Ⅰ带二阶导数谱匹配度高达99%, 其二级结构均由11个子峰构成, 组成则以α-螺旋为主。 研究得出健康人Hb的紫外可见吸收光谱和FTIR光谱, 并通过初步分析得到Hb的光谱学特征和结构特点, 有助于研究相关疾病。
This study focused on the UV-Visible absorption spectra and the Fourier-infrared spectroscopy of hemoglobin (Hb) in healthy humans and analyzed its spectral characteristics to obtain the UV-Visible absorption spectrum and FTIR of solid Hb with a stable structure in healthy humans. The 21~80-year-old subjects were divided into 4 groupstocollect blood samples. Hemoglobin was purified by G-75 glucan after centrifugation, Structure-stable Hb solids were obtained by the freeze-drying method, and Hb of four groups were determined Ultraviolet-visible absorption spectroscopy and FTIR spectroscopy. QC comparative analysis, full-spectral characterization and secondary structure analysiswere used to obtain the UV and FTIR spectra of healthy human Hb. The analysis showed that the Hb UV-visible absorption spectra and FTIR spectra were the same between the four groups. The matching between the QC and the FTIR spectra was as high as 95%. The UV spectra of all the samples had five characteristic absorption peaks, and the absorption peaks absorbance and wavelength of the position were same. The FTIR spectrum had 13 characteristic absorption peaks, and the absorbance and wave number of the position of the absorption peak between different samples were same; preliminary analysis of Hb ultraviolet absorption spectrum showed that healthy human Hb had the same tertiary structure. The characteristic absorption band of FTIR spectrum Amide Ⅰ band had second derivative spectrum matching degree of up to 99%, and its secondary structure was composed of 11 sub-peaks, and the composition was mainly α-helix. The UV-Vis absorption spectroscopy and FTIR spectroscopy of the structurally stable solid human Hb were obtained. The spectroscopy and structural characteristics of Hb were obtained through preliminary analysis, which was helpful to study related diseases.
人血红蛋白是由2个α 和2个β 亚基组成的四聚体, 最重要的功能是运输氧到人体组织器官供细胞代谢, 维持其正常功能。 此外还能调节红细胞代谢, 参与电子传递等过程[1]。 迄今为止, 相关研究发现了超过1000种与血红蛋白合成或结构异常相关的疾病[2], 缺乏有效临床手段治愈此类疾病, 提示现有的知识仍无法满足相关疾病的诊疗需求[3], 这就需要进一步研究Hb的特性、 结构与功能。
以往物质分析技术大多会在测试过程中损坏被测样本, 光谱学方法有不破坏测试样本的优势。 紫外可见吸收光谱(ultraviolet visible absorption spectra)和傅里叶红外变换光谱(Fourier transform infrared spectroscopy, FTIR)可以不破坏物质结构的前提下对物质结构、 组成和含量等进行分析。 紫外可见吸收光谱可以用于分析蛋白质结构和研究蛋白质间相互作用等[4]。 FTIR则还有扫描快、 高分辨率和高灵敏度等特点。 近年来, FTIR广泛的应用于各行业包括食品、 农业、 药物和炼油与化工等的研究中; 在医学上的应用也越来越受关注, 应用范围也越来越广, 如利用FTIR研究证明乳腺疾病的病理学等级与微钙化存在关联, 提出可基于FTIR建立更有效的疾病诊断方法[5]; 利用FTIR可实时监测药物作用时乳腺癌细胞的病理生理学改变, 基此实时评价药物疗效, 从微观层面了解病理生理学改变和药物作用对治疗有重大意义。 FTIR技术的高精确度、 灵敏度和良好的可重复性, 可以准确的对蛋白质结构等进行分析[6]。
有关Hb光谱研究的常见的报道是探究外界条件或疾病对Hb光谱的影响, 如环境条件发生改变或受到电离辐射或长期处于某些慢性疾病状态时, 人的Hb光谱就会发生相应的改变, 提示Hb结构功能的改变[7, 8, 9]。 而高纯度且覆盖年龄段较广的健康人红细胞中Hb光谱的研究几乎没有报道, 因此本研究将通过紫外可见吸收光谱和FTIR光谱技术探究健康人Hb的光谱学特征, 初步建立健康人Hb的参照光谱, 为以后利用光谱学研究疾病或环境与Hb结构的关系提供参考对照图谱。
Tensor37傅里叶变换红外光谱仪(Bruker, 德国), U-3010紫外光谱仪(日立, 日本), JY600C电泳仪(君意, 北京), 台式冷冻高速离心机(Hettich Mikro, 德国), 8000-14000透析袋(索莱宝, 北京)。
1.2.1 样本
随机选取经医院体检为健康的21~80岁成人共232名, 均为汉族; 机体随着年龄增长而逐渐老化, 血液成分亦会发生相应改变[10, 11], 故将年龄划分为4组, 分别是a组21~35岁63人(男31人, 女32人), b组36~50岁60人(男31人, 女29人), c组51~65岁58人(男30人, 女28人), d组66~80岁51人(男25人, 女26人)。
1.2.2 样本采集与Hb样品制备
研究对象至少禁食8 h, 抽取肘部外周静脉血于EDTA-K2抗凝管。 于12 h内将2 mL全血样品用生理盐水洗涤后3 000 r· min-1离心10 min, 除上层血浆及中间绒毛层细胞, 重复3次。 加蒸馏水于4 ℃冰箱破裂12 h, 4 ℃ 12 000 r· min-1离心45 min, 取上层Hb溶液用G-75葡聚糖凝胶层析法纯化Hb, 浓缩后聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定Hb纯度达95%以上。 部分纯化Hb溶液样品用于紫外光谱测试, 另一部分冷冻干燥后用于FTIR光谱测试。
以2 mL去离子水稀释100 μ l待测Hb溶液样品, 紫外光谱扫描波长范围设定为190~800 nm, 精度± 0.1 nm, 测试前进行空白扫描与背景扣除, 每个样本重复测量3次, 取其均值图谱。
Hb粉末与KBr粉末比例混合制成锭片, 红外光谱仪采用空气冷却DTGS检测器, 扫描的范围为4 000~400 cm-1, 重复扫描64次, 分辨率设置为4 cm-1, 室温25 ℃, 湿度控制在25%以下。 扫描前以纯KBr窗片作空白背景, 进行水汽与CO2自动校正, 重复3次, 取均值图谱。
紫外可见吸收光谱采用origin9.0软件进行分析; 健康人Hb红外光谱数据使用OPUS 7.0软件采用11点最小二乘法平滑函数法进行处理, 为消除压片浓度差影响将光谱纵坐标归一化。 利用OMNIC 8.0软件的QC比较功能分析光谱间的相似度, 对红外光谱特征吸收带Amide Ⅰ 带(1 700~1 600 cm-1)进行二阶导数和傅里叶去卷积处理, 根据二阶导数谱和去卷积谱所得信息结合Peak Fit 4.0软件对Amide Ⅰ 带进行Gaussian曲线拟合处理, 获得Hb Amide Ⅰ 带二级结构组成。 使用SAS 9.4软件进行统计学分析, p< 0.05为有统计学意义。
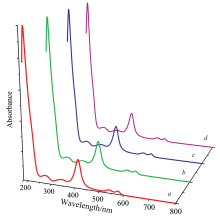
测得的4组Hb紫外光谱如图1中a, b, c, d所示, 4组Hb紫外光谱的谱形相同, 吸收峰位重置相同。 4组Hb平均紫外光谱在190~800 nm的范围主要有5个吸收峰, 峰位均位于274, 346, 414, 540和576 nm处, 如图2所示。 其中274 nm处的吸收峰由Hb的酪氨酸、 色氨酸及苯丙氨酸残基的共轭发色团吸收紫外光而产生, 体外研究表明Hb在处于异常状态时会导致增色或减色效应, 可能导致三级结构发生变化, 导致原本包裹的芳香族氨基酸残基暴露于溶液中[4, 12]; 414 nm处的吸收峰是血红素卟啉环的特征吸收峰, 540和576 nm处的吸收峰分别属于氧合血红蛋白(HbO2)的α 和β 吸收峰, 反映的是Hb的携氧能力[4, 12]。 各年龄组Hb紫外光谱5个吸收峰处的平均吸光度值见表1, 各年龄组相对应特征峰位的吸光度值的差异无统计学意义(p> 0.05), 结合图1说明随着年龄增长Hb紫外光谱不会发生改变。
| 表1 4组血红蛋白紫外可见吸收光谱吸收峰均值± 标准差 Table 1 Mean values and standard deviations of UV-Visble absorption spectra of Hb |
4组Hb FTIR平均光谱如图3所示, 经过基线校正、 纵坐标归一化等消除实验误差, 获得Hb FTIR全信息光谱。 a, b, c, d分别代表的4组Hb平均光谱显示各组间相应吸收峰均有相同位置, 峰形相同。 通过QC比较统计学功能可以分析光谱间的差异, 当光谱间相似度为100时, 说明光谱是完全一样的, 但即使是同一物质, 不同制样批次所测得的光谱也会由于实验误差和仪器的精确度导致的细微差异[7]。 根据Hb全信息红外光谱相似度比较可以反映不同健康人的Hb样本的FTIR光谱是否相同。 同年龄组组内Hb样品间的FTIR光谱相似度结果和组间平均光谱相似度结果见表2, 年龄组内和组间的Hb光谱相似度都达到了95%以上, 光谱间的细微差异可能是由于制样及压片等误差造成的, 初步说明同一年龄组的健康成人Hb FTIR光谱可能是相同的。
| 表2 血红蛋白FTIR光谱相似度 Table 2 The spectral similarity of Hb |
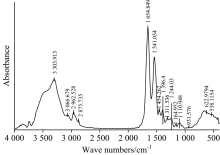
通过上述检测分析, 获得的健康人Hb FTIR光谱如图4所示, 在研究病例时, 可作为健康对照光谱进行比较分析。 健康人Hb FTIR光谱主要由Amide Ⅰ 区、 Amide Ⅱ 区、 Amide Ⅲ 区、 Amide Ⅳ 区、 Amide Ⅴ 区、 Amide Ⅵ 区、 Amide Ⅶ 区、 Amide A区、 Amide B区九个Amide模型吸收带组成。 在4 000~400 cm-1的中红外光谱范围内均主要有13个特征吸收谱带, 吸收谱带的位置及其归属见表3。
| 表3 血红蛋白FTIR光谱吸收带归属 Table 3 General band assignment of FTIR spectra of 4 groups Hb |
2.3.1 Hb FTIR光谱Amide Ⅰ 带分析及其子峰指认
4组Hb的平均FTIR光谱Amide Ⅰ 带的二阶导数光谱如图5所示, Hb的Amide Ⅰ 带作为特征吸收带, 其对Hb的二级结构变化十分敏感, 可灵敏反映Hb的二级结构改变和样品光谱间差异。 Amide Ⅰ 带在FTIR光谱中常为相互重叠形成的宽峰, 常对红外光谱数据进行二阶导数处理以分辨Amide Ⅰ 带中被重叠掩盖的子峰, 获得更全面的蛋白质结构信息。 4个年龄组组内各样品光谱间和组间光谱Amide Ⅰ 带二阶导数相似度结果见表4, 组内光谱间和组间光谱QC比较分析得相似度均高于99%, 其中的微小差异是由于误差而产生的, 说明4组Hb FTIR光谱的二阶导数谱是相同的。
| 表4 血红蛋白酰胺Ⅰ 带二阶导数谱吸收带均值± 标准差和相似度 Table 4 The mean values and standard deviations of wavenumbers of the Amide Ⅰ bands and spectral similarities of thesecondary-derivative of Hb |
健康人Hb二阶导数谱及其傅里叶去卷积谱如图6所示, 其中二阶导数谱为负峰, 傅里叶去卷积谱为正峰, 傅里叶去卷积谱的峰位与二阶导数谱谱峰一致, Hb二阶导数谱和傅里叶去卷积谱均有11个子峰, 子峰谱带归属结果见表5[7, 13]。
 | 图6 血红蛋白酰胺I带二阶导数谱和去卷积谱 (a): 二阶导数谱; (b): 去卷积谱Fig.6 Secondary-derivative and deconvolution spectra of Amide Ⅰ bands of Hb (a): Secondary derivative; (b): Deconvolution |
| 表5 血红蛋白二阶导数谱吸收带归属 Table 5 General band assignment of secondary-derivative spectra of Amide Ⅰ bands of Hb |
2.3.2 Hb FTIR光谱Amide Ⅰ 带二级结构含量分析
FTIR还可以用于定量分析物质的结构含量, 可以进一步的了解物质的结构。 利用peakfit 4.0软件通过曲线拟合的方式直观的展示Amide I带的子峰谱, 峰位, 峰面积等, 同时可定量分析健康人Hb Amide Ⅰ 带的二级结构组成。 Hb平均红外光谱Amide Ⅰ 区的曲线拟合的图谱见图7, 从上至下依次是典型原始谱、 拟合计算谱、 拟合各子谱, 结合Amide I带的二阶导数和去卷积光谱分析得到的子峰归属结果, 对Hb二级结构进行曲线拟合定量计算, 得到的Hb Amide Ⅰ 带各二级结构含量计算结果见表6, 健康人Hb的二级结构含量高低顺序依次为α -螺旋、 β -折叠、 β -转角、 无规卷曲, 说明健康人Hb的Amide Ⅰ 带二级结构是以α -螺旋为主的稳定结构。
| 表6 血红蛋白二级结构组分含量 Table 6 Percentage of secondary structure of Hb |
检测得到健康人Hb的紫外可见吸收光谱和FTIR光谱; 通过光谱学特征分析, 获得了健康人Hb的光谱学特征及结构信息; 发现健康人的Hb紫外可见吸收光谱、 FTIR光谱不受年龄因素影响。 分析测得的Hb紫外可见吸收光谱、 FTIR光谱的光谱学特征, FTIR光谱的特征吸收带Amide Ⅰ 带的二级结构分析发现健康人Hb Amide Ⅰ 带由11个子峰重叠而形成, 其二级结构是以α -螺旋为主的稳定结构。 为医学病理研究提供了健康人Hb的相关信息。
致谢: 感谢广东省医药3D打印机及个性化医疗工程技术研究中心提供的技术支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|