作者简介: 程 劼, 1983年生, 中国农业科学院农业质量标准与检测技术研究所副研究员 e-mail: chengjie@caas.cn
丙烯酰胺是一种具有神经毒性、 生殖毒性, 遗传毒性及免疫毒性的化合物, 被列为2A级致癌物。 富含碳水化合物的食物经高温烹饪后, 丙烯酰胺暴露风险极大, 建立对丙烯酰胺的速测方法具有重要的意义和实用价值。 表面增强拉曼光谱技术(SERS)近年来发展迅速, 利用高SERS活性纳米结构基底可实现对目标物拉曼“指纹”信号的高灵敏增强。 复杂基质中目标物的SERS快速分析需要高活性的基底和高效的净化技术。 建立了一种基于复合纳米结构的煎炸食品中丙烯酰胺的SERS快速分析方法。 利用纳米银阵列负载纳米金粒子(AgNR@AuNPs)作为增强基底, 一是该基底基于AgNR纳米棒之间以及AuNPs纳米粒子之间双重“热点”增强作用, 对丙烯酰胺具有较高的SERS增强活性; 二是该基底中AgNR为固相基底, 每次使用前, 利用稀硝酸除去表面氧化物, 大大提高了SERS分析稳定性。 还研究了AuNPs粒径和样品添加顺序对分析灵敏度的影响。 煎炸食品中基质干扰严重, 结合QuECHERS快速净化技术, 在优化除脂、 萃取溶剂及净化材料的用量比例、 种类的基础上, 选择正己烷为除脂溶剂, 水∶乙腈( V/V=1∶1)为提取溶剂, MgSO4+NaCl为净化材料, 5 min内完成检测。 分析灵敏度1 μg·kg-1, 在5~100 μg·kg-1内以Δ ν=1 482 cm-1为定量峰, 实现定量分析, 线性相关系数 r=0.985, 5个添加浓度下回收率为77.1%93.6%, 相对标准偏差小于4.0%。 所建立的方法有望用于食品安全现场检测中。
Acrylamide (AAm) is classified as a potential carcinogen and neurotoxin because of its neurotoxicity, reproductive toxicity, genotoxicity and immunotoxicity. The cooking of some carbohydrates-rich food at high temperature increases the high risk for exposure to AAm. It is of great significance and practical value to establish a rapid analytical method for acrylamide. Surface-enhanced Raman scattering (SERS) technique has been developed rapidly in recent years. Based on the highly active SERS substrate, the identification of the fingerprint of compound can be realized. To achieve the rapid SERS analysis of the target substance in the complex substrate, a highly active enhanced substrate and an efficient sample pretreatment technique were required. A rapid, reliable, and quantitative method to determine acrylamide content in fried food based on Ag nanorod/Au nanoparticle composites (AgNR@AuNPs) SERS has been proposed. Based on the enhanced effect of double “hot spots” between AgNR nanorods and AuNPs nanoparticles, the substrate has a high SERS enhanced activity for acrylamide. Besides, AgNR was a solid phase substrate. Before each operation, the oxide on the surface was removed by dilute nitric acid, which greatly improved the stability of SERS analysis. The size of AuNPs and the testing sequence which influence the sensitivity of SERS detection have also been investigated. The fried food was complicated with lots of interferences. The dispersive solid-phase extraction was used for decreasing the serious interference of complex matrix. The defatting and extraction solvent, the kind and ratio of cleanup material have been optimized. The results have shown that the optimized defatting solvent, the extraction solvent and the cleanup materials were hexane, the mixture of water and acetonitrile (1∶1, V/V), and MgSO4+NaClrespectively. The total detection time approximately costed was within 5 min with the limits of detection as low as 1 μg·kg-1 based on the quick pretreatment and SERS enhancement. The peak at Δ ν=1 482 cm-1 was selected as the characteristic peak of acrylamide for quantitation in the concentration range of 5~100 μg·kg-1 ( r=0.985). The recovery rates for acrylamide were 77.1%~93.6% with coefficients of variation less than 4.0% at five different fortified concentrations. The developed method can potentially be used for acrylamide detection in the field.
丙烯酰胺(acrylamide, AAm), 1994年被国际癌症研究机构(IARC)列为2A级致癌物质。 研究表明, AAm具有神经毒性, 生殖毒性, 遗传毒性, 免疫毒性。 其中神经毒性已经在人体内得到证实[1]。 AAm是工业上广泛使用的一种化工原料, 在富含淀粉类食品(如马铃薯、 烘烤面包, 焙烤咖啡等)的高温加工中(通常> 120℃)伴随着美拉德反应产生。 存在于食品中的AAm对人体存在极大的暴露风险。 2012年, 欧洲食品安全局(EFSA)制定食品中AAm的限量水平[2]。 2017年, 欧盟明确了食品原料中如面包, 烘烤咖啡, 婴幼儿食品中AAm的限量值为300850 μ g· kg-1 [3]。 对AAm的控制和监控势在必行。 目前, 分析AAm的方法主要包括大型仪器设备分析和快速分析两大类。 前者一般包括如气相色谱-质谱联用[4]、 液相色谱串联质谱[5]等方法。 这些方法通常需要昂贵的仪器设备, 且样品前处理过程较为复杂。 近年来, 也有一些基于比色法[6]、 量子点磷光探针[7]、 荧光猝灭传感[8]等快速分析方法的报道。 表面增强拉曼光谱(surface-enhanced Raman scattering, SERS)是近年来发展迅速的一种快速检测技术, 它是入射光激发纳米尺度金属材料产生的一种拉曼散射增强效应, 基于电磁场物理增强(EM)和化学电荷转移化学增强(CT)的增强机制, 可实现对单分子的高灵敏“ 指纹” 识别, 信号增强1041014倍, 检测灵敏度可达ng甚至pg水平。 借助SERS高灵敏分析的技术优势, 利用SERS实现对AAm的检测分析也见文献报道。 如Wang等设计合成了PDA@AgNPs复合型纳米基底, 实现了饮用水中AAm在0. 04 μ g· L-1水平上的高灵敏分析[9]。 该方法灵敏度高, 但基底保存周期较短(2个月), 一定程度上影响了方法的实用性。 Gezer研究组也开发了玉米蛋白负载纳米金复合增强体系, 对AAm的检测灵敏度为10 μ g· mL-1 [10]。 本课题组也开发出一种基于氧化石墨烯负载纳米金的增强基底, 实现对煎炸食品中AAm的快速分析, 检测时间9.5 min· 样-1, 灵敏度达2 μ g· kg-1 [11], 基底保存周期180 d。 利用SERS实现对实际样品基质中目标物的高灵敏分析有两个重要因素。 一是基底构筑是实现高敏分析的关键, 基底的稳定性决定了分析方法的实用性; 二是样品基质复杂, 干扰成分多, 需要辅助快速的样品前处理技术, 最大程度降低样品基质的干扰。 基于分子印迹、 抗体特异性识别等的技术可与SERS方法联用[12], 实现SERS分析前样品净化。 这其中, 保证高回收率是关键。 研究采用QuECHERS(Quick, Easy, Cheap, Effective, Rugged and Safe)技术, 结合AgNR@AuNPs复合基底, 5 min内实现对煎炸食品中AAm的高灵敏分析。
拉曼光谱仪(自行研制): 785 nm激光器, 10× 物镜; 电子束蒸镀系统(DE 500, DE Technology); 场发射电镜(SU 8010, Hitachi, Tokyo, Japan)。 丙烯酰胺(≥ 99%, Sigma-Aldrich); 吸附剂(含4.0 g MgSO4和0.5 g NaCl, Agilent Technologies); QuEChERS分散萃取料包(150 mg MgSO4, 50 mg PSA, P/N: 5982— 5022); 银与钛(99.9%, Kurt J. Lesker); 氯金酸(纯度≥ 99.0%, 上海国药集团); 10份煎炸样品采集于贵阳、 厦门等3地市场。
AuNPs的制备采用经典的柠檬酸钠还原氯金酸的方法。 首先将氯金酸(1 Wt%, 50 mL)加热至沸腾, 随后逐滴加入柠檬酸三钠(1 Wt%, 35 mL), 待混合物变成红褐色后继续加热20 min, 撤去热源搅拌至室温。 AgNR的制备应用掠入射沉积法(oblique angle deposition)在电子束蒸镀系统上制备。 玻璃衬底用乙醇超声清洗5 min, N2流干燥, 5× 10-7 Torr, 溅射角0° 。 依次钛(20 nm, 0.2 nm· s-1)、 银(100 nm, 0.3 nm· s-1)靶材镀膜, 随后调整溅射角86° , 镀膜2 000 nm。 最后通过射频等离子体(28 W)氩气清洗基底30 s。 场发射电镜进行基底结构表征。 以AAm标液(c=10 μ g· L-1) 为探针, 测试AuNPs (70 nm), AgNPs (70 nm), AgNR, AgNR@AuNPs的SERS活性。
1.0 g样品中加入4 mL正己烷, 在陶瓷均质器中混匀1 min。 依次加入8 mL混合溶剂(水/乙腈, V/V=1∶ 1)和吸附剂, 混合1 min, 12 000 r· min-1离心10 s, 移取下层1 mL, 加入QuEChERS分散固相萃取料包, 振荡20 s, 12 000 r· min-1离心10 s, 收集上层液待测。 分别移取10 μ L AuNPs与10 μ L待测液混合, 分取10 μ L于AgNR表面, 进行拉曼光谱扫描。 单次扫描时间4 s, 扫描5个点取平均, 光谱采用“ Savitzky-Golay” 二阶导数变换法处理。
AgNR@AuNPs中AgNR长L=(990± 50) nm; 直径D=(100± 8) nm; Ag阵列间距S=(105± 10) nm, AgNR水平倾角β =74° ± 2° 。 AuNPs粒径70 nm。 AuNPs分别负载于AgNR表面及AgNR纳米棒之间, 产生高密度增强“ 热点” (图1)。
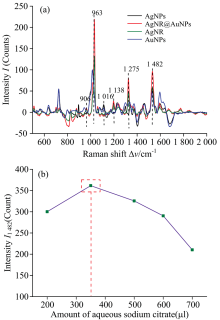
图2(a)比较了四种基底对AAm的增强活性, AAm在Δ v=906, 963, 1 016, 1 138, 1 275和1 482 cm-1处有明显拉曼吸收。 其中1 016和1 138 cm-1为基底峰, 906 cm-1归属C— C伸缩振动; 963 cm-1归属H— C— C— H摇摆振动; 1 275和1 482 cm-1分别归属C=C— C=O骨架振动耦合— CH弯曲振动和— CH2弯曲振动, 与文献报道的一致[13]。 在AgNR@AuNPs增强作用下, AAm特征拉曼吸收最强。 AgNR@AuNPs的SERS活性取决于 “ 热点” 分布, 其中AuNPs粒径也是另一个关键因素。 通过调节柠檬酸钠与氯金酸(1 Wt%)用量制备出不同粒径的AuNPs, 而后负载于AgNR上。 为了优化最佳的粒径, 以Δ ν =1 482 cm-1处AAm拉曼特征吸收峰强度(I1 482)为纵坐标, 选择最大I1 482优化最佳粒径AuNPs。 如图2(b), 固定氯金酸(1 Wt%)用量500 μ L, 当柠檬酸钠用量350 μ L时, I1 482达到最大值。 此时, AuNPs的粒径约为70 nm。
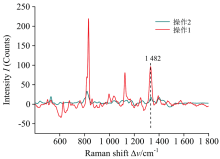
样品混合顺序也影响分析灵敏度。 图3对比了两种混合顺序, 即(1)将样品首先与AuNPs混合, 然后再转移至AgNR上; (2)将AuNPs转移至AgNR上, 再加入样品对SERS分析的影响。 方法(1)比(2)具有更高的I1 482。 样品中AAm首先与AuNPs相互作用, 形成“ 静电复合物” , 更多的AAm受AuNPs热点影响, 转移至AgNR表面后, 部分未发生作用的AAm在AgNR热点作用下, 也同时产生SERS信号。 而将AuNPs预先转移至AgNR表面, 样品后加入, AAm在液固界面分布较为分散, 处于热点区域AAm浓度较低, 表现出较弱的I1 482。
AgNR@AuNPs表面容易被氧化, 需充氮密封保存。 每次使用前利用稀硝酸(10-7 mol· L-1)浸没清洗基底, 除去表面氧化物, 随后用无水甲醇冲洗两次, 自然风干后使用。 为考察基底稳定性, 在第0, 1, 3, 7, 14, 30, 60, 120和180 d进行基底活性测试。 从图4中可以看到基底在0180 d内, I1 482基本趋于稳定, RSD=7.73%。
2.4.1 除脂溶剂优化
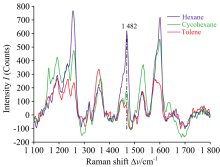
煎炸类食品富含油脂类化合物, 去除油脂干扰有利于提高SERS分析的灵敏度。 以油条(GC-MS方法确证[14])为考察基质, 对比正己烷、 环己烷和甲苯的除脂效果。 如图5所示, 正己烷除脂最佳。
2.4.2 提取溶剂优化
AAm极性较强, 常选用水作为提取溶剂。 以油条、 薯条和油炸方便面为基质, 赋值浓度10 μ g· kg-1。 表1可以看到, 利用水∶ 乙腈(V/V=1∶ 1)作为提取溶剂, 回收率高于水和乙腈。 进一步优化了水与乙腈的用量比, 固定提取溶剂体积8 mL, 体积比在1∶ 7~7∶ 1之间变化, 回收率见表1。 当水∶ 乙腈(V/V=1∶ 1)时, 回收率较佳。
| 表1 提取溶剂优选 Table 1 The optimization of extraction solvents (n=6) |
2.4.3 QuECHERS材料优选
比较了两种净化材料(MgSO4 4.0 g+NaCl 0.5 g和MgSO4 4.0 g+CH3COONa 2.0 g)的净化效果。 选择MgSO4+NaCl作为净化材料回收率较高, 这可能是由于NaCl具有防止乳化的功能, 此结果与文献报道一致[15]。
| 表2 QuECHERS材料对回收率的影响 Table 2 Comparisons between two different QuECHERS compositions |
选择油炸方便面作为基质(GC-MS分析AAm阴性), 赋值样品浓度分别为c=5, 10, 30, 50, 100 μ g· kg-1。 图6所示I1 482与c呈较好线性关系(R2=0.985)。 灵敏度(1 μ g· kg-1)采用空白样品I1 478三倍标准偏差计算所得, 结果通过添加回收验证, 灵敏度高于EU规定的限量标准(300~800 μ g· kg-1), 能满足实际应用的需求。 也对薯条、 油条等基质进行了线性和灵敏度测试, 由于每种类型基质组成的差异性, SERS反映的背景吸收也不同, 但I1 478处与c相关性良好, 结果相似。
 | 图6 基质添加谱图与线性曲线Fig.6 SERS spectra of AAm standard solution spiked into samples and the linearity curve (n=6) |
方法回收率, 精密度和稳定性通过基质添加考察(表3)。 对于薯条和方便面基质, 回收率与课题组先前研究的利用石墨烯负载纳米金进行AAm分析所得数据几乎一致[13], 这也证明了方法的可靠性。 在5个浓度水平下回收率77.1%93.6%, RSD均小于4.0%, 回收率和精密度与原有报道相比均有所改善。 日间与日内精密度RSD从原来6.8%下降至5.5%。 这可能是由于与液相基底相比, AgNR固相基底的有序性提高了分析稳定性。
| 表3 回收率 Table 3 Recovery of AAm from three spiked fried food (n=6) |
| 表4 日间与日内精密度 Table 4 Intra- and inter-day accuracies of the detection(n=6) |
采用建立的SERS方法对10份煎炸样品进行分析, 并与GC-MS进行对比。 从表5中可发现, SERS没有出现“ 假阴性” 或者“ 假阳性” , 但结果普遍比GC-MS结果高, 这可能与所用拉曼光谱仪分辨率有关系, 较低分辨导致Δ ν =1 482 cm-1处重叠峰无法分离和识别。
| 表5 实际样品分析结果 Table 5 The detection results of fried food samples (μ g· kg-1) |
建立了一种基于复合纳米结构的煎炸食品中丙烯酰胺的SERS快速分析方法。 利用AgNR@AuNPs作为增强基底, 基底保存时间不少于180天, 并结合QuECHERS净化方法, 5 min内完成检测, 分析灵敏度1 μ g· kg-1, 在5~100 μ g· kg-1浓度范围内实现定量分析(R2=0.985), 平均回收率77.1%93.6%, RSD小于4.0%。 所建立的方法有望用于食品安全现场快速检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|