作者简介: 周 亮, 1989年生, 中国科学院西安光学精密机械研究所助理研究员 e-mail: zhouliang@opt.ac.cn
根据皮肤组织解剖结构特性建立了六层层状模型, 并给出了皮肤组织各层的特性参数; 考虑了氧合血红蛋白和还原血红蛋白的吸收特性, 依据皮肤组织各层的水、 血、 脂肪、 血氧饱和度含量以及血管大小给出了皮肤组织各层的光谱吸收系数; 对不同波长散射系数做了适当简化, 给出了皮肤组织各层的光谱散射系数。 利用蒙特卡罗方法仿真血管组织在收缩与舒张两种状态下, 400~1 000 nm波长光在皮肤组织多层模型中的传输过程, 并通过统计大量光子的分布特性, 获得了皮肤组织光谱反射系数, 并利用模拟所得的两种状态下的反射系数计算得到了光谱容积脉搏波幅度。 仿真结果表明, 当入射光强一定时, 绿光的容积脉搏波幅度优于红光和蓝光。 通过计算不同波长光沿皮肤组织深度方向光能流率衰减为1/e时对应的皮肤组织深度, 获得了皮肤组织光谱穿透深度。 结果显示, 血管舒张状态下蓝光和绿光的穿透深度较小, 蓝光大部分只能达到表皮层, 绿光能到达微循环层, 红光可直达真皮层。 考虑到光在皮肤组织中传播包含了一个从收缩到舒张的动态过程, 基于此, 根据穿透深度定义了脉搏波信号产生深度, 利用血管舒张与收缩两种不同状态下的穿透深度计算得到了光谱产生深度。 结果表明, 不同波长光产生深度大于其穿透深度, 蓝光产生深度较浅, 且其受到的血液吸收调制较小, 因而其获得的脉搏信号易受噪声干扰; 红光的容积脉搏波产生深度较大, 但是相比于绿光其受血液吸收调制较小, 且绿光产生深度足够达到真皮血管层, 因而红光容积脉搏波的幅度小于绿光。 上述仿真结果明确了皮肤组织部分光谱特性, 为皮肤组织多光谱容积脉搏波的精确获取及其他相关研究提供了一定的理论基础。
According to the anatomical structure of the skin tissue, we established a six-layer model, and the characteristic parameters of each layer of skin tissue were given. We considered the absorption characteristics of oxidized hemoglobin and reduced hemoglobin, and gave the spectral absorption coefficients of each layer of skin tissue according to the contents of water, blood, fat and oxygen saturation in each layer of skin tissue, as well as the size of blood vessels. The scattering coefficients at different wavelengths were simplified properly, and then the scattering coefficient spectra of each layer of skin tissue were obtained. In this paper, we used Monte Carlo method to simulate the transmission process of 400~1 000 nm wavelength light in the multi-layer model of skin tissue under the conditions of contraction and relaxation. The spectral reflectance of the skin tissue was obtained by counting the distribution characteristics of a large number of photons. The amplitude spectrum of volume pulse wave was obtained by calculating the reflection coefficient of the two states obtained from the simulation. The simulation results showed that the volume pulse wave amplitude of green light is better than that of red light and blue light when the incident light intensity is constant. The penetration depth spectrum of skin tissue was obtained by calculating the corresponding skin tissue depth when the light flux of different wavelengths decreased to 1/e along the direction of skin tissue depth. The results showed that the penetration depth of blue light and green light is small, the blue light can only reach the surface layer, the green light can reach the micro-circulation layer, and the penetration depth of red light is the largest, which can reach the dermis directly. Considering when the light travels through the skin, it involves a dynamic process from contraction to relaxation, so we define the depth of pulse signal generation based on penetration depth, and the spectral generation depth is calculated by using the penetration depth of vasodilation and contraction in two different states. The results showed that the depth of light generation at different wavelengths is greater than the penetration depth, the depth of blue light is shallowand the blood absorption modulation is small, so the pulse signal obtained is more easily interfered by noise. The volume pulse wave of red light is deeper than that of green light, but compared with green light, its absorption and modulation by blood is smaller, and the depth of green light generation is enough to reach the dermis vascular layer, so the amplitude of red light volume pulse wave is smaller than that of green light. Our simulation results confirm some spectral characteristics of skin tissue, which provides a theoretical basis for the accurate acquisition of multispectral volume pulse waves and other related studies.
光电容积脉搏描记法(photoplethysmography, PPG)[1]是一种皮肤组织中血容积变化的无创检测方法, 它可给出人体心率、 呼吸率和血氧饱和度等众多生理参数。 其原理是, 当光照射皮肤组织时, 因人体心脏搏动会导致皮肤血管中血容积发生周期性变化, 致使皮肤组织对光的吸收也呈现周期性变化, 进而在接收端接收到了随时间周期性变化的光强信号, 即脉搏波信号。
明确皮肤组织的光谱特性对多光谱PPG信号的精确获取[2, 3]具有重要的指导意义, Anderson等采用K-M模型从理论上分析各层皮肤组织的特性参数; Bashkatov[4]等采用积分球技术来间接测定各层皮肤组织的吸收及散射系数, 但无法准确测量穿透深度、 反射系数等其他光谱特性参数。 此外, 采用积分球方式需要获取离体皮肤组织, 无法明确正常状态下人体皮肤组织光谱特性。
随着计算机运算速度的提高, 越来越多的研究采用仿真的方式来模拟大量光子在生物组织中的无序传输[5, 6], 通过统计其分布特性从而明确其光谱特性。 本文首先构建了更加接近于真实皮肤组织的六层层状模型, 并将其分为舒张和收缩两种状态, 结合氧合血红蛋白和还原血红蛋白的吸收特性, 给出了各层皮肤组织的光谱吸收系数以及光谱散射系数。 然后, 采用蒙特卡罗方法[7]仿真得到了皮肤组织两种状态下的光谱反射系数, 计算得到了光谱容积脉搏波幅度。 并通过计算不同波长光沿皮肤组织深度方向光能流率衰减为1/e时对应的皮肤组织深度, 获得了皮肤组织光谱穿透深度, 同时利用收缩和舒张两个状态下的穿透深度, 计算获得了容积脉搏波的光谱产生深度, 明确了皮肤组织部分光谱特性, 为多光谱容积脉搏波的精确获取提供了一定的理论帮助。
将皮肤组织结构沿厚度方向分为六层, 如图1所示。 第一层为不含血的表皮(EP), 主要由死亡或脱水的细胞构成, 其厚度因所处身体位置不同而具有一定的差异, 但对于指尖皮肤来说, 一般可将其厚度设为0.8 mm。 依据含血量将真皮层分为以下四层[8]: 约150~200 μ m厚度的微循环层(PA), 约80 μ m厚度的上丛层(SP), 约1.4~3.0 mm厚度的网状真皮层(RD)以及约80~700 μ m厚度的深丛层(DP)。 真皮层以下是皮下组织层(SC), 由脂肪、 结缔组织和动脉组成。
在舒张状态下, 上述皮肤组织1~6层参数设置如表1所示, 其中包括每一层的折射率、 厚度、 含水量、 含血量以及血管直径。 皮肤组织的光学和解剖特性参数设置与先前的研究工作基本保持一致[9], 但是对血含量做了修正, 其依据是近期反射漫射谱研究[10]表明Cb的含量一般在1%~3%。 折射率由表皮的1.33逐渐增加到皮下组织的1.44。 舒张状态下, 真皮层的动-静脉血比值(ra∶ rv)取50%∶ 50%。 此外, 动脉血氧饱和度SpO2设置为97%, 静脉血氧饱和度SvO2设置为30%, 皮下组织的脂肪含量设置为40%。 真皮层中每一层的血管直径vd由表1给出。
| 表1 皮肤组织参数设置 Table 1 Parameters of the layers skin tissue |
皮肤组织表皮层和真皮层的吸收系数有所不同, 表皮层的吸收系数μ a, epi由背景组织和水的综合作用决定。
对于表皮组织来说, 背景组织的吸收系数可由式(2)决定
波长λ 的单位为nm, 因子γ 取0.5。
舒张状态下的真皮层和皮下组织吸收系数由无血组织和血液的吸收系数及其各自的占比共同决定。 其中无血组织的吸收系数[11]如式(3)
真皮层和皮下组织的背景吸收由式(4)决定
对于真皮层和皮下组织, 因子γ 分别取0.5和0.25。 系数cw0取0.65。
此外, 考虑到部分入射光会受到血管壁反射的影响, 实际与光相互作用的血液含量会低于组织中的血含量[12], 因此对血液含量做修正, 修正函数如式(5)
舒张状态下, 修正后的血含量由动脉和静脉血含量决定, 其表达式如式(6)
结合氧合血红蛋白和还原血红蛋白的吸收谱[13], 舒张状态下皮肤组织的吸收系数如式(7)
将皮肤组织各层的参数代入上式, 计算可得经过修正后的皮肤组织各层的光谱吸收系数曲线如图2。
相比于舒张状态, 收缩状态下动脉血含量增加, 假设增加比例为p, 此处取3%。 则收缩状态下修正后的血液含量为
则收缩状态下的吸收系数为
一般认为皮肤组织的散射是瑞利散射和米氏散射的综合作用[14], 将与波长有关的约化散射系数简化为式(10)
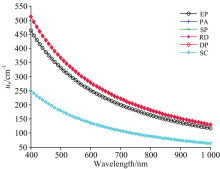
常数b通常取1.5, 对于不同层, 常数c0的取值有所不同, 其单位为cm-1。 对于表皮层, c0的值取为3.7× 105, 对于微循环层、 上丛、 网状真皮层, c0的值取为4.1× 105, 而对于皮下组织, c0的值取为2.0× 105。 皮肤组织各层的光谱散射系数如图3所示。
结合图2可以看出, 上层血管丛、 网状真皮层、 深层血管丛吸收及散射系数在可见光范围内普遍高于其他层。 由于上层血管丛厚度较小, 对光的作用范围有限, 因而其影响可以忽略, 可以认为光在皮肤组织中主要吸收及散射部位为真皮层及深层血管层。 网状真皮层由大量纤维组织构成, 其决定了真皮层的主要光谱特性。 血液主要由血浆和血细胞组成, 其中血浆主要成分为水, 在可见光范围内吸收较小。 血细胞绝大多数为红细胞, 其主要成分为血红蛋白, 在可见光范围内吸收较大, 决定了血液层的主要光谱特性。
为了模拟不同波长下容积脉搏波的幅度变化, 对400~1 000 nm范围内间隔10 nm采样的所有波长进行舒张和收缩两状态下的蒙特卡罗模拟, 并利用模拟所得的两状态下总的反射系数来计算反射式容积脉搏波幅度, 并将反射容积脉
搏波的幅度定义为
其中Rdd和Rds分别为舒张和收缩状态下波长λ 对应的总的反射系数。
根据容积脉搏波的幅度定义, 结合皮肤组织结构模型和第二节中描述的皮肤组织光学特性参数, 蒙特卡罗模拟所得的舒张状态下光谱反射系数曲线如图4(a), 容积脉搏波幅度随波长变化曲线如图4(b)所示。
 | 图4 (a)皮肤组织光谱反射系数; (b)光谱容积脉搏波幅度Fig.4 (a) Skin tissue reflectance spectrum; (b) Volume pulse wave amplitude spectrum |
从光谱反射系数曲线图可以看出, 蓝光和绿光反射系数较小, 红光反射系数较大, 主要是因为绿光和蓝光吸收及散射较大, 因而其反射率低于红光。 从容积脉搏波幅度曲线可以看出, 绿光容积脉搏波幅度大于红光和蓝光, 红光的容积脉搏波幅度小于绿光的原因是血液对其吸收小于绿光, 蓝光幅度小于绿光是因为蓝光在皮肤组织中穿透深度较小, 虽然血液对蓝光的吸收较大, 但是其整体受血液吸收影响较小, 不同颜色光的皮肤组织穿透深度将在下节给出。
穿透深度表明了特定波长光所能到达的皮肤组织深度。 蒙特卡罗模拟可以获得沿皮肤组织深度方向的光能流率, 因而可将穿透深度定义为光能流率衰减为1/e时对应的皮肤组织深度。 波长λ 对应的穿透深度表达式如式(12)
其中Ts为皮肤组织的总厚度, PD为穿透深度, z为皮肤组织的深度。
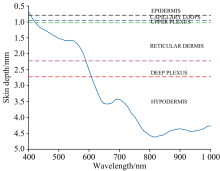
由前述舒张状态下400~1 000 nm范围内间隔10 nm采样的所有波长的蒙特卡罗模拟所得的能流率, 结合穿透深度定义可得皮肤组织的光谱穿透深度曲线如图5所示。 从图中可看出, 红光的穿透深度最大, 可直达真皮层, 蓝光的穿透深度比较小, 大部分只能达到表皮层, 而绿光最多也只能到达微循环层。
绿光穿透深度仅能到达微循环层, 这与其容积脉搏波在此波段具有较大的幅度是否矛盾? 由容积脉搏波起因可知, 其幅度值由舒张和收缩两个状态下所测得信号的差值决定, 而不是由其单一状态决定。 因此, 根据穿透深度概念定义容积脉搏波的产生深度, 其表达式如式(13)
其中Δ F为对应于波长λ 时舒张和收缩两状态下沿皮肤组织深度方向的光能流率的差值, DO表示容积脉搏波的产生深度。
根据容积脉搏产生深度的定义, 结合舒张和收缩状态下蒙特卡罗模拟获得的光能流率可得出容积脉搏波的光谱产生深度如图6所示。 从图中可以看出, 容积脉搏波的光谱产生深度比其光谱穿透深度要大。 这意味着在可见光-红外波段, 容积脉搏波确实是由真皮层的脉动特性产生的。 而这也说明了蓝光的容积脉搏波产生深度小于绿光和红光, 其受到动脉血脉动特性的调制较小, 因而其易受噪声干扰, 这也是目前生理检测设备较少采用蓝光的原因之一, 比如心率、 血氧饱和度检测[15]等。 红光的容积脉搏波产生深度较大, 但是相比于绿光其受血液吸收调制较小, 因而红光容积脉搏波的幅度小于绿光。 总的来说, 由容积脉搏波的光谱产生深度可知, 绿光到红外波段范围内更适合进行容积脉搏波的有效测量。
根据皮肤组织的解剖结构, 建立了皮肤组织的六层层状模型, 结合各层的水、 血、 脂肪和血氧饱和度含量以及血管大小给出了皮肤组织各层的光谱吸收系数和光谱散射系数。 利用蒙特卡罗模拟仿真得到了皮肤组织光谱反射系数以及光谱容积脉搏波幅度、 光谱穿透深度及光谱产生深度。 结果表明, 相比于蓝光和红光, 绿光的反射容积脉搏波幅度值较大, 有利于脉动信号提取。 此外, 绿光至红外波段产生深度都在真皮层及以下, 因而能够对血容积进行有效地测量, 仿真结果明确了皮肤组织部分光谱特性, 为多光谱容积脉搏波精确获取提供了一定的理论帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|