作者简介: 陈红瑞, 1995年生, 中南大学资源加工与生物工程学院硕士研究生 e-mail: hrchen0201@csu.edu.cn
基于同步辐射装置的As/S的K边及Fe的L边X射线吸收近边结构光谱(XANES)和X射线衍射(SR-XRD), 结合扫描电镜(SEM)、 傅里叶红外光谱(FTIR)、 电感耦合等离子体发射光谱(ICP-AES)及各项浸出参数的测定, 系统研究了(中度嗜热菌、 嗜热硫化杆菌)浸出砷黄铁矿过程中铁、 砷、 硫的形态转化。 结果表明, 在生物作用下, 砷黄铁矿的溶解速率明显高于化学浸出体系, 伴随矿物溶解释放到溶液中的砷和铁在生物浸出体系中主要为As(Ⅴ)和Fe3+, 而在无菌化学浸出体系则主要为As(Ⅲ)和Fe2+; 细菌胞外多聚物(EPS)在细菌与硫化矿物的相互作用过程中起着至关重要的作用, FTIR的结果表明, 生物浸出体系中吸附在矿物表面的吸附菌的EPS中蛋白质和多糖的含量均高于游离菌EPS; SEM的结果表明, 砷黄铁矿表面在生物浸出过程中逐渐被腐蚀, 且有浸出产物覆盖, 而化学浸出10 d后, 矿物表面依旧比较光滑; SR-XRD的结果表明, 元素硫(S0)、 黄钾铁矾和砷酸铁在生物浸出第4 d生成, 并随时间延长逐渐累积, 最终成为浸出渣中的主要成分。Fe的L边XANES结果表明, 在细菌作用下矿物表面逐渐被Fe(Ⅲ)浸出产物覆盖; As的K边XANES结果表明, 浸出渣中砷的价态包括As(-Ⅰ), As(Ⅲ)和As(Ⅴ), 拟合结果表明, 经过10 d的生物浸出, 砷黄铁矿、 雌黄(As2S3)和砷酸铁在矿渣中所占的比例分别为18.6%, 23.5%和57.9%, 化学浸出10 d后, 矿渣中除未溶解的砷黄铁矿外, 仅有少量砷酸铁(6.2%)形成; S的K边XANES拟合结果表明, 经过10 d的生物浸出, 砷黄铁矿、 S0、 硫代硫酸盐、 施氏矿物和黄钾铁矾在矿渣中所占的比例分别为15.3%, 23.7%, 3.5%, 11.3%和46.2%, 而在化学浸出10 d后的矿渣中, 仅拟合到少量S0(7.8%)。 基于上述结果可以得出, 铁、 砷、 硫在砷黄铁矿生物作用下的形态转化过程分别为: Fe(Ⅱ)-Fe(Ⅲ), As(-Ⅰ)-As(Ⅲ)-As(Ⅴ), S-→S0→S2
In the present study, the bioleaching of arsenopyrite by the moderately thermoacidophilic strain Sulfobacillus thermosulfidooxidans YN-22 was investigated based on iron, arsenic, and sulfur speciation analysis by synchrotron radiation As/S K-, and Fe L- edge X-ray absorption near edge structure (XANES) spectroscopy, X-ray diffraction (SR-XRD), accompanied by scanning electron microscopy (SEM), Fourier transform infrared spectroscopy (FTIR), andinductively coupled plasma-atomic emission spectroscopy (ICP-AES) with the determination of the leaching parameters. The results showed that the presence of bacteria significantly promoted the dissolution of arsenopyrite, and dissolved As and Fe in the bioleaching solutions mainly existed as As(Ⅴ) and Fe3+, while were mainly As(Ⅲ) and Fe2+in the chemical leaching. Extracellular polymeric substances (EPS) plays a critical role in the interactions between bacteria and minerals during bioleaching, and the FTIR analysis of the EPS showed that the contents of protein and polysaccharides of the adhered cells were higher than those of the free cells. Results of SEM showed that the surface of the arsenopyrite was gradually corroded, and some secondary products were formed during bioleaching, while for the sterile control experiment, the mineral surface was only slightly corroded, and only a few products were found after 10 days of chemical leaching. The results of SR-XRD showed that elemental sulfur (S0), jarosite and ferric arsenate were detected after day 4, and gradually developed into the main components of the residues in the bioleaching experiment. Fe L-edge XANES analysis showed that during the bioleaching of arsenopyrite by Sulfobacillus thermosulfidooxidans, the Fe(Ⅱ) species was gradually converted to Fe(Ⅲ) species with time. As K-edge XANES analysis showed that valences of arsenic in the bioleached residues included As(-Ⅰ), As(Ⅲ) and As(Ⅴ), the fitted results of the As K-edge XANES spectra showed that the residue composition of arsenic species for the same leached time(10 days) consisted of 18.6% arsenopyrite, 23.5% orpiment and 57.9% ferric arsenate in the bioleaching assay, and of 93.8% arsenopyrite and 6.2% ferric arsenate in the chemical leaching. The fitted results of the S K-edge XANES spectra showed that after 10 days bioleaching, the residue composition of sulfur species consisted of 15.3% arsenopyrite, 23.7% S0, 3.5% thiosulfate, 11.3% schwertmannite and 46.2% jarosite, while only a small amount of S0 (7.8%) was found as the sulfur intermediate at day 10 in the sterile control experiment. Based on these results, it could be concluded that the chemical speciation transformation of iron, arsenic and sulfur were performed in the pathways: Fe(Ⅱ)-Fe(Ⅲ), As(-I)-As(Ⅲ)-As(Ⅴ), and S-→S0→S2
近年来, 硫化矿物的生物预处理方法因其具有浸出率高、 环境友好、 操作简单、 成本低等特点, 受到研究者和开发者们的广泛关注[1, 2]。 砷黄铁矿是含砷金矿中最常见的硫化矿物之一, 金通常以显微状、 次显微状以及晶格金形式与砷黄铁矿形成包裹体, 进而形成含砷难处理金矿[3]。 含砷金矿的微生物预氧化处理可以有效脱除金矿石中的砷黄铁矿, 是保证后期高氰化浸出效果的重要前提。
砷黄铁矿的生物浸出过程中涉及多相界面相互作用, 包含多个复杂的化学反应。 体系中的极端嗜酸铁硫氧化微生物可将砷黄铁矿在O2和Fe3+作用下溶解产生的Fe2+和元素硫(S0)氧化成Fe3+和S
砷是冶金工业的一大顽症, 也是矿石中最有害的类金属元素。 研究表明, 矿物中砷呈现的价态和物相形式要比理论计算的复杂得多[6]。 硫在浸出过程中的形态也复杂多样, 除了S0和S
本工作采用XANES和SR-XRD技术, 结合扫描电镜-能量弥散光谱(SEM-EDS)、 傅里叶红外光谱(FTIR)、 电感耦合等离子体发射光谱(ICP-AES)及浸出过程中各项浸出参数的测定, 系统研究了Sulfobacillus thermosulfidooxidans浸出砷黄铁矿过程中铁、 砷、 硫的化学形态转化, 为其氧化机理的阐明和氧化工艺的优化提供一定的理论指导。
1.1.1 砷黄铁矿的表征
本实验所用砷黄铁矿由中南大学资源加工与生物工程学院提供。 X射线荧光(XRF)分析结果表明, 原始砷黄铁矿表面的主要元素组成为(Wt%): As, 43.50; Fe, 34.02; S, 19.08; O, 2.27; Si, 0.36; Al, 0.18; Cu, 0.25; Pb, 0.09; Zn, 0.10; Ca, 0.12; Ag, 0.03。 矿样经破碎后研磨, 过筛, 确保其最终粒度在38~75 μ m。
1.1.2 菌种及培养基
实验菌种Sulfobacillus thermosulfidooxidans YN-22由生物冶金教育部重点实验室提供。 培养细菌所用基础培养基的组成如下(g· L-1): (NH4)2SO4, 3.0; MgSO4, 0.5; K2HPO4, 0.5; KCl, 0.1; Ca(NO3)2, 0.01; 以及酵母浸出液, 0.2。
浸出实验在250 mL的三角瓶中进行, 培养基100 mL, 矿浆浓度为1 g· L-1。 培养基的初始pH用1 mol· L-1硫酸调节至2.0。 Sulfobacillus thermosulfidooxidans的初始接种量为8× 107 cells· mL-1。 培养体系置于恒温振荡培养箱(ZHWY-1102C)中, 控制温度为45 ℃, 转速180 r· min-1。
浸出过程中游离菌的浓度采用血球计数板在显微镜下直接计数, pH采用PHSJ-4A型酸度计测定, 氧化还原电位(ORP)用铂电极和甘汞电极联用测定, 三价铁浓度([Fe3+])和总铁浓度([Total Fe])采用5-磺基水杨酸法测定[11], 总砷浓度([Total As])用电感耦合等离子体发射光谱仪(ICP-AES)(IRIS Intrepid Ⅱ XSP, Thermo Fisher, USA)测定, 三价砷浓度([As(Ⅲ )])采用原子荧光光谱仪(AFS)测定(PS Analytical Ltd, Kent, U.K.)[12]。
浸出液中的游离菌直接用差速离心法收集。 矿物表面吸附菌的收集采用文献[13]中的方法。 EPS的剥离与收集参照文献[14]的方法进行。 细菌胞外多聚物(EPS)的基团分布采用傅里叶变换红外光谱仪(FTIR)(Nexus 670, Nicolet, USA)表征。
矿物样品表面形貌变化用扫描电子显微镜(SEM)(FEI Quanta 200, FEI, USA)观察, 物相组成用SR-XRD表征。 SR-XRD测量在中国科学院应用物理研究所上海同步辐射光源BL14B1线站进行, 信号采集模式为扫描, 光束能量为18 KeV, 光斑大小为0.3 mm× 0.3 mm, θ 角度范围为5° ~28° , 间隔为0.01° , 单位点的采集时间为0.5 s。
S的K边和Fe的L边XANES光谱分别在中国科学院高能物理研究所北京同步辐射中心中能线站(4B7A)和软X线站(4B7B)采集。 As的K边XANES光谱在中国科学院上海应用物理研究所上海同步辐射光源硬X射线线站(15U1A)采集。 Fe的L边XANES光谱的采集采用全电子产额模式, 能量范围为690~780 eV, 步长为0.1 eV。 S和As的K边XANES光谱的采集模式均为荧光模式, 其中S的K边XANES光谱的能量采集范围为2 460~2 490 eV, 步长为0.1 eV; As的K边XANES光谱的能量采集范围为11 800~12 000 eV, 步长为0.5 eV。 未知样品光谱的归一化及线性组分拟合(linear combination, LC)在IFEFFIT程序中的Athena软件中进行[15, 16]。
图1(a)表明, Sulfobacillus thermosulfidooxidans浸出砷黄铁矿过程中, 游离菌密度在第4 d达到最大值, 然后逐渐降低; 吸附菌在第6 d达到最大值, 随后呈现缓慢下降趋势。 pH值随着生物浸出时间的增加逐渐增大, 在4 d后快速下降; ORP值的变化趋势与Fe3+浓度([Fe3+])相似, 在第5 d达到最大值(518~514 mV)后趋于缓慢下降[图1(b)]。 Sulfobacillus thermosulfidooxidans对Fe2+的快速氧化, 使得浸出液中铁以Fe3+为主。 图1(c)表明, 砷在生物浸出体系中以As(Ⅴ )为主, 经过10 d的生物浸出, 浸出液中砷的浓度为2.43 g· L-1, 对应砷黄铁矿53.9%的浸出率。 而对于无菌对照, 溶液中的铁和砷分别以Fe2+和As(Ⅲ )为主, 10 d后, 浸出液中砷离子浓度为0.98 g· L-1, 对应砷黄铁矿16.7%浸出率[图1(c, d)]。
值得注意的是细菌对Fe2+氧化过程为耗酸反应, 该反应是导致浸出前期pH升高的主要原因。 高浓度的Fe3+不仅可以作为氧化剂促进矿物溶解, 还可以使[Fe3+]/[Fe2+]的值增大, 浸出体系中ORP值随之升高, 该结果将有利于As(Ⅲ )转变为As(Ⅴ )[式(4)][17, 18]。
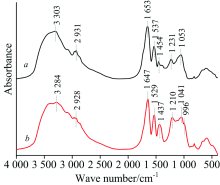
图1(a)表明Sulfobacillus thermosulfidooxidans浸出砷黄铁矿过程中, 处于生长稳定期的游离菌与吸附菌胞外多聚物(extracellular polymeric substance, EPS)的FTIR分析结果如图2曲线(a, b)和表1所示。 FTIR图谱中波数在3 000~3 400 cm-1范围内归属于多糖中的— OH伸缩振动的吸收峰, 吸附菌EPS的吸收峰明显强于游离菌EPS。 波数在1 537和900~1 200 cm-1范围内分别归属于多糖C=C对称振动和C— O— C或C— OH伸缩振动的吸收峰的强度明显增大。 同时, 吸附菌EPS的FTIR图谱中位于1 653, 1 537和1 231 cm-1附近分别归属于蛋白质二级结构中C=O和N— H与C— N耦合振动及蛋白质分子中C— OH, CH3或CH2(伸缩振动2 960~2 870 cm-1), CH2或CH2(弯曲振动1 450 cm-1附近)弯曲振动的吸收峰的强度也明显增大。 此外, 吸附菌EPS中各基团对应吸收峰的位置也明显向长波长处发生了偏移(表1)。 这些结果表明, 合成较多的蛋白质和多糖类, 对于细菌吸附于矿物表面及其对能源物质获取的过程是有利的。
SEM的结果表明, 矿物表面在生物作用下随时间延长逐渐被腐蚀见图3(a— f)。 在第4 d明显看出砷黄铁矿表面及周围有新的颗粒状浸出产物生成; 10 d后, 矿物几乎完全被浸出产物包裹[图3(e)]。 经过10 d的化学浸出, 砷黄铁矿表面依旧比较光滑, 仅有少量颗粒状浸出产物生成[图3(f)]。
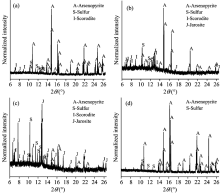
SR-XRD的结果表明, 浸出渣中的物相类型及其相应含量随时间延长也发生了变化, 见图4(a— d)。 S0、 黄钾铁矾和砷酸铁的物相在第4 d被检测到, 它们的含量均逐渐减加。
经过10 d的生物氧化, 浸出渣中黄钾铁矾和元素硫变成最主要的成分[图4(c)]。 在无菌对照实验组中, 经过10 d的化学浸出, 浸出渣中除砷黄铁矿外, 只有少量的元素硫被检测到[图4(d)]。
分别利用Fe的L边和As, S的K边的XANES光谱, 对砷黄铁矿生物浸出过程中矿相Fe, As和S的形态转化进行了表征。
2.5.1 Fe的L边XANES分析
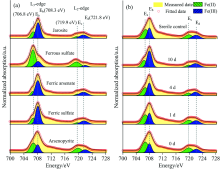
如图5(a)所示, 不同含铁标准物质的Fe的L边XANES光谱的L3边处包含Ea(706.8 eV)和Eb(708.3 eV)两个小峰, L2边处包含Ec(719.9 eV)和Ed(721.8 eV)两个小峰。 其中Ea和Ec是Fe(Ⅱ )的特征吸收峰, 而Eb和Ed是Fe(Ⅲ )的特征吸收峰[21]。 对比标准样品Fe的L边XANES特征, 可以看出随着生物浸出时间的延长, 矿物表面Fe(Ⅱ )的比例逐渐减小, 而Fe(Ⅲ )的比例逐渐增大)[图5(b)]。
2.5.2 As的K边XANES分析
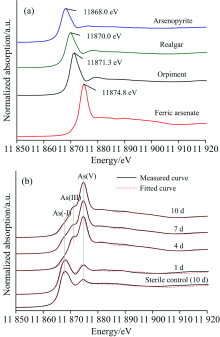
图6(a)为不同含砷标准物质的As的K边XANES光谱。 图6(b)为生物浸出不同阶段矿相的As的K边XANES光谱及其LC拟合图谱图。 随着浸出时间的延长, 在11 868.0 eV处属于As(-Ⅰ )的吸收峰的强度逐渐减弱, 而在11 871.3和11 874.8eV处分别归属于As(Ⅲ )和As(Ⅴ )的吸收峰强度逐渐增强, 说明砷在固相中的形态主要包括As(-Ⅰ ), As(Ⅲ )和As(Ⅴ )。 拟合结果(表2)表明, 砷黄铁矿所占比例由第1 d的86.3%逐渐降低到第10 d的18.6%, 雌黄和砷酸铁所占的比例逐渐增加, 分别由第1 d的6.6%和7.1%增加至第10 d 的23.5%和57.9%。 对于无菌对照实验组, 经过10 d的化学作用, 只有少量的砷酸铁(6.2%)生成。 雌黄与砷酸铁的形成过程可用式(5)和式(6)表示[9, 22]。
| 表2 Sulfobacillus thermosulfidooxidans浸出砷黄铁矿过程中矿相As的K边XANES光谱拟合结果 Table 2 The fitted results of As K-edge XANES spectra of residues bioleached by Sulfobacillus thermosulfidooxidans at different times and in the sterile control experiment at day 10 (b) |
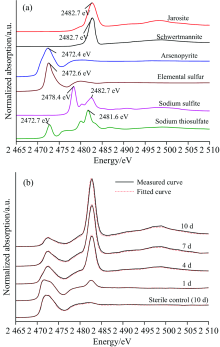
2.5.3 S的K边XANES分析
图7(a)为不同含硫标准物质的S的K边XANES光谱。 图7(b)表明, 砷黄铁矿生物浸出过程中, 矿相的S的K边XANES光谱在2 472.4 eV处属于(负一价S1-)的吸收峰强度逐渐减弱, 而在2 482.7 eV处属于S
| 表3 Sulfobacillus thermosulfidooxidans浸出砷黄铁矿过程中矿相S的K边XANES光谱LC拟合结果 Table 3 The fitted results of S K-edge XANES spectra of residues bioleached by Sulfobacillus thermosulfidooxidans at different times and in the sterile control experiment at day 10 (b) |
(1)相对于无菌化学浸出体系, 砷黄铁矿的溶解速率在Sulfobacillus thermosulfidooxidans的作用下明显提高, 铁/砷/硫化学形态转化快速复杂。 为满足矿物表面的能量需求, 吸附菌EPS倾向于合成更多的蛋白质、 多糖和糖醛酸。
(2)生物浸出体系中, 砷在溶液中以As(Ⅴ )为主, 在固相中砷的形态包括As(Ⅲ ) (雌黄)和As(Ⅴ )(砷酸铁)。 菌对Fe2+的快速氧化, 保证了体系中较高的ORP(氧化还原电位)值, 促使As(Ⅲ )向As(Ⅴ )转化。
(3)黄钾铁矾和砷酸铁的形成均为产酸反应, 是生物浸出后期pH降低的主要原因; 能源缺乏和砷的毒害作用使得菌的表观铁硫氧化降低, S0大量累积, 最终与黄钾铁矾、 砷酸铁和雌黄形成致密覆盖物, 阻抑砷黄铁矿溶解。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|





 (氨基酸基团)
(氨基酸基团)