作者简介: 赵 晨, 女, 1994年生, 集美大学食品与生物工程学院硕士研究生 e-mail: 690197388@qq.com
孔雀石绿(MG)是一种有毒的三苯甲烷类物质, 由于其价格低廉, 抑菌效果好, 曾在水产养殖中被作为抑菌剂广泛使用。 但是长期大量的使用孔雀石绿将会对人体产生致癌、 致畸、 致突变的危害。 传统检测水中孔雀石绿的方法需要复杂的前处理, 花费大量时间, 且需要昂贵的仪器设备, 技术难度高, 因此发展一种快速简便的MG检测方法十分必要。 核酸适配体是一种能与靶标分子特异性结合的DNA或RNA片段, 它具有高特异性、 高亲和力、 易于化学合成和修饰、 稳定性高等特点, 是比抗体更为有潜力的靶标识别元素, 目前被广泛应用于传感检测中。 胶体金(AuNPs)具有高消光系数和表面等离子体共振现象, 可用于可视化检测体系中。 研究了一种基于胶体金和RNA适配体的可视化快速检测孔雀石绿的方法。 当有盐(NaCl)存在时, AuNPs会受到盐的作用而发生团聚, 其吸收光谱峰由520 nm处移到690 nm处, 溶液颜色由红色变成蓝色。 由于RNA适配体可以通过静电作用吸附在AuNPs表面, 对AuNPs起到保护作用, 可使AuNPs在盐溶液中不发生聚集而呈红色; 而当体系中有MG存在时, 由于MG与RNA适配体的特异性结合, 使得RNA适配体从AuNPs表面脱离, 游离的AuNPs遇盐发生聚集呈蓝色。 随着MG浓度的升高, 520 nm处吸光度值逐渐降低, 690 nm处吸光度值逐渐升高, 且溶液颜色逐渐由红色变为蓝色。 因此, 目标物MG的含量可通过肉眼观察溶液颜色或通过可见吸收光谱来确定, 整个检测过程不超过1小时。 以有或无MG时AuNPs于520及690 nm处吸光度比值的差值Δ( A690 /A520)作为检测信号, 发现在NaCl浓度为0.2 mol·L-1、 RNA浓度为10 μmol·L-1及AuNPs的浓度为7 nmol·L-1时, MG浓度的线性范围为0.6~12.5 μmol·L-1[线性方程为Δ( A690 /A520)=0.06 c-0.01, R2为0.993], 检出限为0.04 μmol·L-1(3 α/κ, n=9)。 该方法对MG检测具有良好的选择性, 将此方法应用于养殖水样中孔雀石绿的检测, 加标回收率为92%~108%, 说明该方法能够准确、 灵敏、 快速检测水产养殖中的孔雀石绿。
Malachite green (MG), one of the toxic triphenylmethane chemicals, has been used worldwide in aquaculture because of its low cost and high efficacy in bacteriostasis. However, the residue of MG may cause carcinogenic, teratogenic and mutagenic effects. Traditional methods for MG detection are relatively complex, which require complicated operations of pretreatment, take a lot of time -, and need expensive instruments. Thus a rapid and simple detection method needs to be developed. Aptamers are the functional single stranded DNA or RNA molecules which have high-affinity and specificity in binding capabilities towards a vast range of targets. Therefore, aptamers have been widely applied as recognition elements for biosensor in recent years. Gold nanoparticles (AuNPs) with high extinction coefficient and surface plasmon resonance have been used in colorimetric detection systems. In this work, a facile colorimetric aptasensor for highly sensitive detection of MG based on aptamer and AuNPs was developed. In the absence of salt, AuNPs agglomerated in salt with the absorption peak of UV-vis spectrum shifted from 520 nm to 690 nm, and the solution color changed from red to blue. However, the complexation of RNA aptamer with AuNPs prevented the nanoparticles from aggregation in a high-salt solution because of the electrostatic interaction between RNA aptamer and AuNPs. In the presence of MG, RNA aptamer could specifically bind with MG, causing AuNPs aggregation with blue in color in salt. With the increases of MG concentrations, the values of A520 decreased and the values of A690 increased, and the color of the solution gradually changed from red to blue. Taking advantage of this sensing technique, MG could be detected by naked eyes or UV-Vis spectroscopy within one hour. The differences of A690 /A520 with and without MG in the detection systems were used as the detection signals. The results showed that the linear range of MG was 0.6 to 12.5 μmol·L-1 at the optimum conditions of 0.2 mol·L-1 NaCl, 10 μmol·L-1 RNA and 7 nmol·L-1 AuNPs. A linear equation of Δ( A690 /A520)=0.06 C-0.01 was obtained with a correlation coefficient ( R2) of 0.993. The detection limit was 0.04 μmol·L-1 (3 α/κ, n=9). The method had good selectivity for MG detection. Furthermore, the developed method was successfully applied to the detection of MG in aquaculture water with excellent accuracies. The results indicated that the developed method has significant potentials for trace MG detection in real samples.
孔雀石绿(MG, C23H25CN2)是一种有毒的三苯甲烷类染料, 它可以杀死真菌、 细菌和寄生虫[1]。 由于其价格低廉以及高效的抑菌作用, 孔雀石绿曾被广泛应用于水产养殖中。 然而, 长期大量的使用孔雀石绿将会对人产生致癌、 致畸、 致突变的危害。 因此, 欧盟、 加拿大、 美国和中国等国家或地区已经禁止MG在动物性食品中使用。 由于具有显著的抑菌作用, MG仍然在水产养殖中被非法使用, 需要发展一种快速、 灵敏、 高效的MG检测方法。 目前MG的检测方法有以下两类, 一类是基于大型仪器设备的检测方法, 例如高效液相色谱法(HPLC)[2]、 液相色谱串联质谱法(HPLC-MS)[3]和气相色谱串联质谱法(GC-MS), 这些方法均需要相对复杂的预处理, 耗时长且依赖于昂贵的大型仪器, 检测极为不便。 另一类是利用光谱检测法, 例如酶联免疫法(ELISA)[4], 但是这种方法需要制备抗体, 且检测条件苛刻; 荧光检测法[5], 但荧光不稳定, 耗时较长。 因此, 研究一种能够简便快速的检测方法很有必要。
核酸适配体是通过指数富集配体系统进化(SELEX)技术筛选出来的一种能与靶标分子特异性结合的DNA或RNA片段, 具有高特异性、 高亲和力、 易于化学合成和修饰、 稳定性高等特点, 是比抗体更为有潜力的靶标识别元素, 因此常被广泛应用于元素识别的生物传感检测体系中[6, 7]。 近年来, 通过荧光[8, 9]、 化学发光[10]、 电化学[11]、 表面等离子体共振[12]和比色[13]等方法构建了许多基于适配体的生物传感器。 其中比色法因其检测时间短、 成本较低、 不需要复杂的操作技术等而得到了广泛的应用。 胶体金(AuNPs)由于其高消光系数和表面等离子体共振现象(SPR)而被用于比色体系中。 例如, 应用无标记适配体和免修饰AuNPs的比色法检测蛋白质[14]、 金属离子[15]和小分子[6]等。 Jia等[16]使用了具有38-寡聚体序列的MG-RNA适配体, 研究发现, MG-RNA适配体可以剪裁成27个碱基序列(5’ -GGAUCCCGACUGGCGAGAGCCAGGUAACGAAUG-GAUCC-3’ )[17], 与38序列具有相同的识别性能, 本研究使用具有27个碱基序列的MG-RNA核酸适配体。
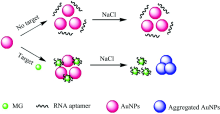
基于免修饰AuNPs和无标记RNA建立可视化检测MG的方法。 MG的特异性RNA适配体可保护AuNPs免受盐诱导的聚集作用, 使AuNPs呈分散状态而显红色。 当有MG存在时, RNA与MG特异结合, 导致AuNPs失去保护而聚集, 肉眼可观察到溶液由红色变为蓝色。 通过可见光度法可检测出溶液在520和690 nm处吸光度值的变化。 结果表明, 该方法灵敏度高, 选择性强, 可用于水产养殖水样中微量MG的检测。
孔雀石绿(MG, 天津福晨化学试剂厂); 氯金酸(HAuCl4, 上海阿拉丁试剂有限公司); 焦碳酸二乙酯(DEPC, 上海阿拉丁试剂有限公司); 氯化钠、 醋酸钠(上海国药化学试剂有限公司); 冰醋酸(广东锡龙科技有限公司); MG核酸适体(上海生工生物技术有限公司)。 96孔板(厦门科展)。 表1为本实验中所用RNA适配体序列, RNA用水溶解后在零下20 ℃储存。 实验中所用到的水均为DEPC水(1‰ DEPC高温高压处理), 所有材料包括离心管、 枪头等均用1‰ DEPC浸泡过夜后再高压处理烘干后方使用。
| 表1 不同MG检测方法的比较 Table 1 Comparison of different methods for MG detection |
紫外-可见吸收光谱的检测使用美国硅谷公司的Molecular Devices酶标仪; AuNPs的制备使用北京龙兴创实验仪器有限公司的MS7-H550-PRO磁力搅拌器; AuNPs的电镜表征使用日本电子光学实验室的JEM-2100透射电子显微镜(TEM)。 TEM表征所用样品的制备使用德国Christ公司的Alpha 1-2 LD plus冷冻干燥机; RNA使用前离心处理采用德国Eppendorf的5417R高速冷冻离心机。
AuNPs合成方法参考文献[18]的方法并稍作修改。 首先, 将10 mL 38.8 mmol· L-1的柠檬酸钠溶液快速加入沸腾的HAuCl4(100 mL, 1 mmol· L-1)溶液中。 溶液由黄色变为酒红色后, 继续加热搅拌20 min, 待溶液冷却至室温后于4 ℃保存备用。 制得的AuNPs的浓度约为14 nmol· L-1, 其消光系数为2.01× 108 mol-1· cm-1, 直径约为13 nm, 吸收峰在520 nm处[19]。
用醋酸钠缓冲液(pH 6.5)配制不同浓度的MG溶液。 将30 μ L 10 μ mol· L-1的RNA适配体的与50 μ L的MG溶液混合于96孔板中, 充分振荡10 min。 然后加入70 μ L 7 nmol· L-1 的AuNPs溶液, 反应5 min后, 加入50 μ L 0.2 mol· L-1的NaCl溶液, 振荡20 min后用酶标仪扫描450~750 nm波长下吸收光谱图, 根据吸光度计算MG溶液的浓度。 所有实验操作均在室温下进行。
水样取自当地市场的养殖水。 将水样用尼龙膜过滤, 分别取1 mL加入不同浓度MG (1.2, 2.5和5.0 μ mol· L-1)。 从中取50 μ L加入到检测体系中, 分别测定520和690 nm处的吸光度值。 用HPLC验证MG检测结果的准确性, HPLC操作条件为: 色谱柱采用了C18柱(100 mm× 4.6 mm, 3.6 μ m), 流动相为乙酸铵溶液(50 mmol· L-1, pH 4.5)和乙腈等度洗脱(40∶ 60, V/V)流速为0.5 mL· min-1, 检测波长为618 nm。
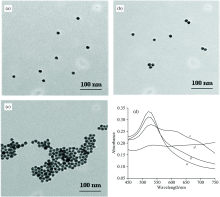
图1(a, b, c)为不同条件下胶体金溶液的透射电子显微镜(TEM)图, 图1(d)为不同条件下溶液的吸收光谱图。 图2的实验原理表明: 在AuNPs溶液中加入NaCl, 由于柠檬酸负电荷的中和作用使得AuNPs发生聚集[15], 溶液的颜色由红色变为蓝色, 可见吸收峰从520 nm移到690 nm处。 当在该溶液中加入RNA适配体时, RNA适配体与AuNPs通过静电结合, 同时溶液中的NaCl还可以稳定RNA链的结构、 减小链之间以及AuNPs之间的斥力, 使RNA更容易吸附到AuNPs上, 保护AuNPs不发生聚集[20]。 然而, 当有MG存在时, 由于MG与RNA适配体结合具有特异性, 而RNA适配体与AuNPs表面的静电作用较弱, MG与RNA适配体优先结合, 游离的AuNPs失去RNA适配体的保护作用遇盐发生聚集。 肉眼可以观察到溶液颜色由红色变为蓝色。 此时, 用酶标仪测出溶液在520 nm处的吸光度值有所降低, 690 nm处的吸光度值有所增加。 在此基础上, 建立了一种基于核酸适配体检测MG的可视化检测方法。
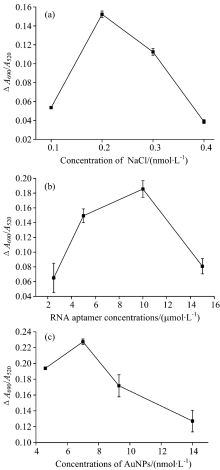
实验以体系中添加与不添加MG时, 溶液在690 nm处与520 nm处吸光度比值的差值Δ (A690/A520)为检测信号, 对NaCl浓度、 RNA适配体浓度和AuNPs的浓度进行了优化, 如图3所示。 结果显示, NaCl最佳浓度为0.2 mol· L-1, RNA最佳浓度为10 μ mol· L-1, AuNPs最佳浓度为7 nmol· L-1。
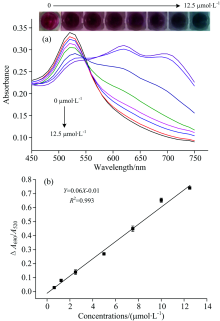
在最优条件下, 用一系列浓度的MG建立工作曲线。 如图4(b)所示, 在0.6~12.5 μ mol· L-1浓度范围内, Δ (A690/A520)与MG呈良好的线性关系, 线性回归方程为Y=0.06X-0.01 (R2=0.993)。 用3α /κ (α 为9次检测MG标准偏差, κ 为线性回归方程的斜率)计算该方法的检出限为为0.04 μ mol· L-1。 如图4(a)所示, 检测体系颜色由红色逐渐变为蓝色。 实验反应在1 h内完成, 优于以前报道的MG检测方法, 表1为几种MG检测方法的比较结果。
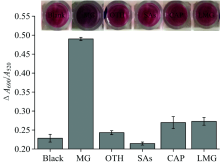
选择水产养殖的其他几种禁用杀菌药物盐酸土霉素(OTH)、 磺胺(SAs)、 氯霉素(CAP)和隐性孔雀绿(LMG)研究本体系的选择性。 结果如图5所示, 加入MG的体系A690/A520值明显高于其他四种药物。 MG体系的颜色由红色变为蓝色, 而其他颜色不变。 结果表明, 该比色分析法对MG的检测具有较高的特异性。
将该比色法应用于水产养殖水样中MG的检测。 结果如表2所示, MG回收率为92%~108%, 相对标准偏差为0.23%~1.77%。 为验证所建立的方法的可靠性和准确性, 采用高效液相色谱法(HPLC)对加标水样进行了验证, 表2中的数据表明, HPLC与所建立的核酸适配体/AuNP生物传感器方法的检测结果一致, 表明所建立的方法能够快速、 准确地检测水产养殖水样中的MG。
| 表2 RNA/AuNPs检测体系中MG水样加标回收率和HPLC检测结果 Table 2 Recovery tests of MG in aquaculture water measured with aptamer/AuNP biosensor and HPLC, respectively |
建立了一种基于MG-RNA适配体和胶体金(AuNPs)的高灵敏可视化检测方法, 并具有以下优点: 首先, 这是一种基于可视化或比色检测MG的生物传感检测方法; 其次, 该方法不需要对检测材料进行任何的化学修饰, 从而简化了实验步骤, 并降低了检测成本; 第三, 以RNA作为MG的特异识别核酸适配体, 提高了检测的特异性。 因此, 该方法可用于检测水产养殖水体中的微量MG含量。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|