作者简介: 路亚楠, 女, 1996年生, 内蒙古科技大学化学与化工学院硕士研究生 e-mail: 1422021803@qq.com
研究不同液体酸酸析对碱溶酸析法提取腐植酸的光谱学特性的影响, 进而优选酸析液体酸, 解析泥炭甲烷发酵、 腐植酸提取耦合的泥炭利用新工艺机理。 泥炭甲烷发酵, 将发酵后泥炭残渣和未发酵的泥炭, 采用碱溶酸析法提取腐植酸, 提取时采用不同液体酸酸析, 对得到的腐植酸进行傅里叶红外光谱分析、 荧光光谱分析、 E4 /E6的表征。 碱溶酸析法提取泥炭腐植酸, PHA1腐植酸产率最高, PHA2腐植酸产率有所降低。 PHA1和PHA2硝酸酸析腐植酸产率为45.30%和35.00%, 且硝酸酸析腐植酸纯度较大, PHA1是54.83 mg·L-1, PHA2为61.03 mg·L-1, 综合产率与纯度, 硝酸是碱溶酸析法提取泥炭腐植酸的最佳液体酸。 傅里叶红外光谱分析显示, 硝酸酸析得到的腐植酸含O—H基团最多, 存在较多的脂肪碳链结构、 烷基、 醇羟基。 PHA1和PHA2腐植酸的红外谱图相似, PHA1腐植酸饱和碳明显高于PHA2, PHA2腐植酸羰基、 苯环较多。 三键和累积双键、 羟基、 PHA1和PHA2差别不大。 荧光光谱分析表明, 泥炭腐植酸均在450 nm附近出现峰值, 以PHA1腐植酸峰值最高, PHA2峰值最低。 磷酸酸析腐植酸峰值最高, 硝酸酸析峰值次之, 表明不同液体酸酸析得到的腐植酸官能团数目不同。 E4 /E6分析显示, PHA1腐植酸的 E4 /E6比值均较大, 芳香缩合程度低, 发酵后PHA2的 E4 /E6均降低, 芳香缩合程度高。 表明甲烷发酵会消耗低芳香缩合度的腐植酸, 而复杂芳香结构无法被降解, 提取的腐植酸芳香缩合程度明显增大。 碱溶酸析法提取泥炭腐植酸光谱学变化特征研究表明, 不同液体酸、 甲烷发酵对碱溶酸析法提取泥炭腐植酸产率、 纯度、 官能团有明显影响, 泥炭联产甲烷和腐植酸的工艺可行。
Effects of different liquid acid precipitation on the spectral characteristics of humic acid extracted by alkali solution acid precipitation method were studied to select the preferable liquid acid, and analyze the mechanism of new process of peat combined production by methane fermentation and humic acid extraction. Used the peat for methane fermentation, then adopted the alkali extraction acid precipitation method by different liquid acids to extract humic acid from fermented peat residue and unfermented peat. Finally, the humic acid was characterized by Fourier transform infrared spectroscopy analysis, fluorescence spectrum analysis and E4 /E6 analysis. The results of extracting peat humic acid showed that the yield of humic acid the PHA1 was the highest, the PHA2 was somewhat lower. The yields of humic acid from PHA1, PHA2 precipitated by nitric acid were 45.30%, 35.00%. And the purity of humic acid precipitated by nitric acid was higher, which in PHA1 was 54.83 mg·L-1, and in PHA2 was 61.03 mg·L-1. Considering the yield and purity, nitric acid was the best liquid acid for extracting peat humic acid by alkali-extraction acid-precipitation method. Fourier transform infrared spectroscopy analysis showed that the humic acid by nitric acid precipitation contained the most O—H groups, and there were more fatty carbon chain structure, alkyl and alcohol hydroxyl groups. The infrared spectra of humic acids obtained from PHA1 and PHA2 were similar. There was little difference between the triple bond,the cumulative double bond and hydroxyl groups of PHA1 and PHA2. The fluorescence spectrum analysis showed that the humic acid from peat had a peak value of about 450 nm, the peak value of PHA1 humic acid was the highest, and that of the PHA2 was the lowest. The peak value of phosphate acid precipitation humic acid was the highest, followed by nitric acid, indicating that the number of humic acid functional groups obtained by different liquid acid precipitation was different. The results of E4 /E6 analysis showed that the E4 /E6 ratio of PHA1 humic acid was higher and the degree of aromatic condensation was lower. After fermentation, the E4 /E6 of PHA2 decreased, the degree of aromatic condensation was higher. Therefore, methane fermentation could consume more humic acid with low aromatic condensation degree, but the complex aromatic structure could not be degraded, and the aromatic condensation degree of extracted humic acid was obviously increased. Study on the characteristics of the spectroscopic changes in the extraction of peat humic acid by alkali-extraction acid-precipitation method showed that different liquid acids and methane fermentation have obvious effects on the yield, purity and functional groups of peat humic acid by alkali-extraction acid-precipitation method. The process of co-production of methane and humic acid from peat is feasible.
腐植酸(Humic acid)是具有天然活性和药用价值的羟基羧酸混合物[1], 由芳环和脂环构成, 环上连有羧基、 羟基、 羰基、 醌基、 甲氧基等官能团。 内蒙古泥炭(Peat)储量高达1.28亿吨, 具有矿体大、 埋藏浅、 易开发的特点, 为泥炭的深加工提供了资源条件。 泥炭富含纤维, 疏松多孔, 内表面积巨大, 吸附水分能力较强[2], 主要作为园艺基质, 广泛应用于花卉园艺等领域[3], 仅将泥炭作为园艺基质是一种浪费, 应将泥炭作为一种化工原料, 最大限度发挥资源价值。 泥炭含有平均36%的腐植酸, 可作为腐植酸提取的原料。 现在多采用碱溶酸析法提取腐植酸。 Zara等[4]研究从塔尔、 查克瓦勒和奎塔的低阶煤HNO3氧化后KOH提取腐殖酸, 结果表明, 3.5%浓度的KOH是提取腐殖酸的最佳浓度, 从塔尔、 查克瓦勒和奎塔的低阶煤中分别提取了24.6%, 13.6%和18.0%的腐殖酸, 紫外分光光度法测定腐殖酸含量分别为29.67%, 20.1%和22.6%。 腐殖酸样品的红外光谱分析表明, 腐殖酸中存在羧基、 酚类、 醇类和胺类官能团。 三种腐殖酸的13C NMR谱显示了腐殖酸中存在多种脂肪族和芳香族化合物, 如羧酸、 碳水化合物、 乙烯、 酚类和胺类等。 Trofimova[5]等研究采用氢氧化钠和焦磷酸钠从泥炭中提取腐植酸对巨噬细胞的活化作用, 焦磷酸钠提取的泥炭腐植酸相比氢氧化钠提取的具有芳香性和官能团多样性, 对抗原呈递细胞产生内毒素有独立刺激作用, 具有明显优势。 目前关于提取泥炭腐植酸的研究中, 尚无液体酸对碱溶酸析法提取泥炭腐植酸光谱学变化特征的相关研究报道。 本实验以草本泥炭为研究对象, 研究碱溶酸析法提取腐植酸过程中不同液体酸酸析对泥炭腐植酸光谱学变化特征的影响, 寻找最佳的酸析液体酸, 同时对比研究甲烷发酵对腐植酸光谱学变化特征的影响, 解析泥炭甲烷发酵耦合腐植酸提取的工艺机理, 通过泥炭化学组分有机质腐植酸的分级转化, 实现泥炭的转化效益叠加, 提高泥炭资源转化整体经济效益。
草本泥炭: 吉林吉祥有限公司提供; 活性污泥: 包头市南郊污水处理厂获得; 傅里叶变换红外光谱仪, 德国布鲁克RX1; 紫外可见近红外分光光度计, CAYR 5000; 荧光光谱仪, Perkin Elmer Luminescence Spectrometer LS55。
(1) 草本泥炭进行微生物甲烷厌氧发酵, 在发酵的过程中, 每天定时震荡发酵瓶, 记录产气数据, 发酵完成后, 将残渣烘干, 提取腐植酸, 待测。
(2) 腐植酸的提取第一组为未甲烷发酵的泥炭PHA1; 第二组为甲烷发酵后的泥炭PHA2。 每组称取一定质量样品, 添加5%氢氧化钠浸泡24 h后, 加入20倍体积的蒸馏水, 调节pH值为10~12, 在80 ℃下加热2 h, 多次离心得到上清液, 分别采用硫酸、 硝酸、 盐酸、 磷酸调节pH值为3.0, 取下层沉淀烘干, 待测。
(1) 傅里叶变换红外光谱分析取1 mg烘干的腐植酸样品用CF-IR光谱仪(TENSOR Ⅱ 03040404)测定并记录其光谱, 所有样品的测定条件完全一致。
(2) 荧光光谱分析发射和激发单色器的扫描速度均为1 000 nm· min-1, 发射单色器狭和激发单色器狭缝宽度均为8 nm。 荧光发射光谱从275 nm扫描到650 nm, 固定的激发波长为274 nm。
PHA1分别采用硫酸、 硝酸、 盐酸、 磷酸酸析腐植酸命名为1-1, 1-2, 1-3和1-4; PHA2相应的命名为2-1, 2-2, 2-3和2-4。
图1(a)为不同液体酸碱溶酸析法提取腐植酸的产率图, PHA1腐植酸产率最高, PHA2腐植酸产率有所降低。 PHA1腐植酸磷酸酸析(1-4)产率最高达52.80%, 硝酸酸析(1-2)产率次高45.30%; PHA2腐植酸提取时硝酸酸析(2-2)产率最高35.00%, 磷酸酸析(2-4)产率次高34.73%。 不同液体酸对碱溶酸析法提取泥炭腐植酸的产率有显著影响。 表明甲烷发酵过程中会消耗掉部分泥炭腐植酸。 甲烷发酵及不同液体酸酸析对腐植酸纯度影响如图1(b)所示。 硝酸酸析腐植酸纯度高于硫酸、 盐酸、 磷酸, 其中PHA2硝酸酸析腐植酸(2-2)纯度达61.03 mg· L-1, 从不同泥炭样品使用不同液体酸酸析得到的腐植酸最大纯度。 由此可知, 使用不同液体酸酸析对腐植酸的纯度有较大的影响, 其中硝酸酸析腐植酸纯度较大。 综合考虑产率与纯度, 硝酸是碱溶酸析法提取泥炭腐植酸的最佳液体酸, 与文献[6]报道一致, 机理是源于硝酸作为氧化剂能够氧化改性泥炭及泥炭残渣, 得到高产率、 高纯度腐植酸。
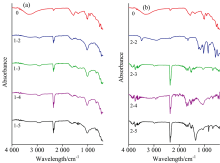
从图2中可以看出, 发酵前后样品不同液体酸酸析时得到的腐植酸在红外谱图中的出峰位置大致相同, 出现7个峰(3 364, 2 924, 1 703, 1 560, 1 460, 1 380和1 030 cm-1)。 3 500~3 000 cm-1为O— H键和N— H键的伸缩振动区域; 2 960~2 850 cm-1是饱和C的C— H键的伸缩振动区域, 证明饱和脂肪链烃存在; 1 750~1 680 cm-1是羰基C═O的伸缩振动吸收峰; 1 650~1 450 cm-1有峰, 为芳烃骨架振动, 证明苯环存在; 1 460和1 380 cm-1处是芳环C═C羟基的C— O键和脂肪族C— H键的伸缩振动区域[7]; 1 200~1 020 cm-1处有峰, 为醇羟基的伸缩振动区域, 结合3 500~3 000 cm-1处有峰则可以证明醇羟基的存在。
图2(a)不同液体酸酸析未经甲烷发酵的泥炭提取的腐植酸的红外谱图, 腐植酸标准品(0)的红外谱图峰强度明显高于采用不同液体酸碱溶酸析法提取的腐植酸。 在3 500~3 000 cm-1区域内, 不同液体酸酸析腐植酸红外谱图峰强度按硝酸、 硫酸、 磷酸、 盐酸的顺序呈现逐渐降低的趋势, 硝酸酸析腐植酸(1-2)含O— H基团最多; 在2 924 cm-1处, 硝酸酸析腐植酸(1-2)的吸收峰最强, 表明硝酸酸析腐植酸(1-2)存在较多的脂肪碳链结构; 在1 750~1 680 cm-1区域内, 硫酸酸析腐植酸(1-1)吸收较强, 盐酸(1-3)较弱, 表明硫酸酸析腐植酸(1-1)含有较多的羰基和羧基; 在1 560 cm-1处, 代表芳香环的骨架振动, 硫酸酸析腐植酸(1-1)吸收峰最强, 芳香结构最多; 1 460和1 380 cm-1处, 四种液体酸酸析腐植酸都具有较强的吸收峰, 在1 460 cm-1处, 硝酸酸析腐植酸(1-2)的吸收最强, 在1 380 cm-1处磷酸酸析腐植酸(1-4)吸收最强, 表明硝酸酸析腐植酸(1-2)含有较多的烷基, 磷酸酸析腐植酸(1-4)含有较多的甲基; 在1 200~1 020 cm-1区域内, 硝酸酸析腐植酸(1-2)峰强度最大。 表明硝酸酸析腐植酸(1-2)含有更多的醇羟基, 不同液体酸酸析对腐植酸官能团有显著影响。
色谱纯腐植酸标准品命名为0; PHA1分别采用硫酸、 硝酸、 盐酸、 磷酸酸析腐植酸命名为1-1, 1-2, 1-3和1-4; PHA2相应的命名为2-1, 2-2, 2-3和2-4。
甲烷发酵后不同液体酸酸析腐植酸红外谱图如图2(b)所示, PHA1和PHA2腐植酸的红外谱图出峰位置大致相似而峰面积有明显差异, 表明甲烷发酵会影响腐植酸官能团含量。 以硝酸酸析腐植酸(1-2, 2-2)为例, PHA1硝酸酸析腐植酸(1-2)的吸收峰较强, 甲烷发酵后PHA2硝酸酸析腐植酸(2-2)吸收峰较弱, 表明甲烷发酵会引起腐植酸部分降解, 在3 500~3 000及1 200~1 020 cm-1区域内, PHA1腐植酸在此区域的吸收强度略大; 在2 924, 1 460和1 380 cm-1范围内, PHA1腐植酸强度明显高于发酵后的PHA2腐植酸; 在2 500~2 000 cm-1区域内, 发酵前后峰强度相差不大, 此区域为三键和累积双键的伸缩振动区域; 在1 750~1 680和1 560 cm-1范围内, PHA2腐植酸峰强度较大。 综上所述, 在发酵过程中, 微生物主要利用了腐植酸脂肪链烃中烷基甲基等, 而对于羟基利用很少, 苯环、 三键和累积双键几乎没有被利用。
色谱纯腐植酸标准品命名为1; PHA1分别采用硫酸、 硝酸、 盐酸、 磷酸酸析腐植酸命名为1-1, 1-2, 1-3和1-4; PHA2相应的命名为2-1, 2-2, 2-3和2-4。
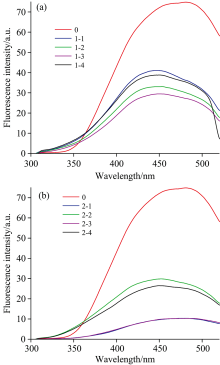
图3为固定激发波长为274 nm的条件下, 测得的腐植酸的发射光谱图, 其中图3(a)为未甲烷发酵不同液体酸酸析腐植酸(PHA1)的发射光谱图, 图3(b)为甲烷发酵后不同液体酸酸析腐植酸(PHA2)的发射光谱图。 由图3可知, 腐植酸荧光光谱具有对称性, 且峰值大致出现在440~480 nm之间, 这是源于腐植酸含有大量苯环和杂环, 环之间以桥键连接, 环及环支链上有羧基、 酚羟基、 醌基、 甲氧基等, 即腐植酸具有多种荧光发色基团, 荧光性质较为特殊[8]。 PHA1和PHA2腐植酸中, 以硝酸酸析腐植酸(1-2, 2-2)为例, 均在450 nm左右出现峰值, 以PHA1腐植酸峰值最高, PHA2腐植酸峰值最低, 根据已有报道知, 这可能是由于苯环、 羰基、 羧基存在造成干扰形成的[9]。 表明PHA2腐植酸中芳构化程度高, 分子结构复杂, 腐植酸荧光强度因苯环、 羰基等和不同液体酸分子的相互作用而降低, 出现荧光猝灭现象。 PHA2腐植酸最大峰位置发生红移, 由PHA1腐植酸的445 nm红移至457 nm。 根据Zhao等[10]研究, 有机质中芳构化程度高的稠环等的存在, 会导致最大荧光峰发生红移, 可推测发酵过程中消耗降解较多脂肪链烃, PHA2腐植酸的稠环比率增加, 芳香缩合度提高。
不同液体酸酸析腐植酸均在454 nm附近出现峰值, 而且呈现由磷酸、 硝酸、 盐酸、 硫酸逐渐降低的趋势, 表明不同液体酸酸析腐植酸官能团数目不同。 硫酸酸析腐植酸存在较多的羰基、 羧基以及苯环等芳构化程度较大的结构, 受到溶剂、 溶液温度的影响导致荧光猝灭。 由红外谱图可知磷酸酸析腐植酸的甲基较多, 荧光官能团较少, 则荧光强度最高。 不同液体酸酸析腐植酸最大峰位置不同, 452 nm(1-4), 457 nm(1-2), 460 nm(1-3), 462 nm(1-1), 表明硫酸、 盐酸酸析腐植酸的芳构化大、 分子较复杂; 硝酸、 磷酸酸析腐植酸的稠环数目较少、 分子结构简单。
E4和E6表示在465和665 nm波长下的吸光度, 可以反映分子的缩合度和分子复杂程度, E4/E6的大小可以反映分子的芳香缩合度、 芳构化度和分子量的大小[11], 呈现负相关趋势, 其比值越高, 芳构化度越低[12]。 由表1可知, PHA1腐植酸的E4/E6均较大, PHA2腐植酸的E4/E6有所下降。 表明PHA1腐植酸的分子复杂程度较低, 芳香缩合程度低; PHA2腐植酸的E4/E6芳香缩合程度高, 在发酵过程中脂肪烃大量消耗, 而复杂的芳香结构无法被降解消耗, 提取的腐植酸分子聚合度明显增大。 腐植酸结构复杂, 分子量分布很宽, 可能从几百到几十万, 根据文献中腐植酸分子量(M)与E4/E6的关系式: lgM=-0.089 3E4/E6+5.193 5[15]可估算腐植酸分子量, 可得, 腐植酸标准品(0)的分子量最大为90 916, PHA1腐植酸分子量最小和最大分别为硝酸(1-2)和硫酸(1-1)酸析腐植酸, 分子量是分别是: 55 617和24 135; PHA2腐植酸分子量最小和最大分别为盐酸(2-3)、 硫酸(2-1)酸析腐植酸是: 58 072和51 331。 表明PHA1腐植酸的分子量小, 甲烷发酵后PHA2腐植酸的低芳香缩合程度的脂肪烃大量消耗, 而复杂的芳香结构无法被降解消耗, 腐植酸分子量明显增大。
| 表1 液体酸碱溶酸析法提取腐植酸的E4/E6 Table 1 E4/E6 of humic acid extracted by liquid acidbased alkali-extraction acid-precipitation method |
由扫描图谱分析可知, 腐植酸分子是由苯环、 醇羟基、 酚羟基、 羧基、 羰基及饱和脂肪链烃组成的结构复杂的分子。
(1)PHA1和PHA2腐植酸的红外谱图在峰面积上有明显区别, PHA1腐植酸稠环较少, PHA2腐植酸芳构化程度高, 表明甲烷发酵会引起腐植酸部分降解。 不同液体酸酸析值得到的腐植酸红外谱图峰强度不同, 表明硝酸酸析腐植酸含O-H基团、 脂肪碳链结构较多, 硫酸酸析腐植酸含有较多的羰基、 羧基、 醇羟基和芳香结构, 磷酸酸析腐植酸含有及较多的甲基。
(2)腐植酸荧光光谱图具有对称性, 均在450 nm左右出现峰值, PHA1腐植酸峰值高于PHA2腐植酸峰值。 不同液体酸酸析时腐植酸峰值由高到低为磷酸、 硝酸、 盐酸、 硫酸, 表明甲烷发酵后腐植酸稠环比率增加, 芳香缩合度提高。 硫酸、 盐酸酸析腐植酸的芳构化大、 分子较复杂; 硝酸、 磷酸酸析腐植酸的稠环数目较少、 分子结构简单。
(3)PHA1腐植酸的E4/E6比值高于PHA2腐植酸, 甲烷发酵过程中微生物会降解消耗部分易降解腐植酸, 导致PHA2腐植酸分子聚合程度明显增大。 硫酸、 磷酸酸析腐植酸的分子量大、 芳香缩合度高; 硝酸、 盐酸酸析腐植酸的分子量小、 芳香缩合度低。
综上所述, 硝酸酸析腐植酸产率纯度均较高, 存在较多的— OH、 脂肪碳链结构, 分子量小、 稠环数目较少、 芳香缩合度低为最佳酸析液体酸。 甲烷发酵后, 腐植酸产率均值为32.81%, 纯度均值为46.03 mg· L-1, 相较于未甲烷发酵泥炭得到的腐植酸分子量增大, 芳香缩合程度提高。 泥炭为原料, 生物甲烷联产腐植酸工艺可行。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|