作者简介: 陈 蓉, 女, 1995年生, 西南大学化学化工学院硕士研究生 e-mail: 2244102476@qq.com
利用密度泛函理论(density function theory, DFT)的B3LYP/6-31G(d, p)基组计算环丙沙星(ciprofloxacin, CIP)的拉曼峰, 与实验拉曼峰相比, 吻合度较高。 并对其拉曼峰进行了全面的归属。 环丙沙星溶液的表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)与常规拉曼实验结果显示, 以金纳米粒子为基底, 对环丙沙星的拉曼峰有较好的增强效果。 探究了结合时间对氨茶碱与环丙沙星混合物的影响, 结果表明随着时间的延迟, 两者之间的作用力加强, 环丙沙星的部分拉曼峰消失。 氨茶碱的加入, 影响了环丙沙星的分子结构, 使得环丙沙星拉曼信号减弱, 多处拉曼峰发生改变, 主要是1 184 cm-1处的吡嗪环、 1 252 cm-1的C—F、 1 627 cm-1处的C C以及1 458 cm-1处O—C—O的振动频率发生了变化; 氨茶碱含量的增加, 对环丙沙星结构的影响更为严重, 其中800~1 200 cm-1处的拉曼峰消失, 当氨茶碱的量超过22.5 mg·L-1时, 除1 384 cm-1处有微弱信号出现外, 几乎无其他峰出现。 表面增强拉曼光谱作为一种常用的分析工具, 具有分析时间短, 灵敏度高等优点。 实验利用SERS技术, 考察氨茶碱与环丙沙星之间的相互作用, 为其药理研究提供了参考。
The Raman peak of Ciprofloxacin (CIP) was calculated by the density functional theory (DFT) B3LYP/6-31G(d, p) basis set, compared with the experimental Raman peak. The degree of fit is high. And its Raman Peak has been fully vested. The surface enhanced Raman spectroscopy (SERS) and conventional Raman experiments of ciprofloxacin showed that the gold nanoparticles were used as the substrate to enhance the Raman peak of ciprofloxacin. The effect of binding time on the mixture of aminophylline and ciprofloxacin was explored. The results showed that the interaction between the two increased with time, and the partial Raman peak of ciprofloxacin disappeared. The addition of aminophylline affected the molecular structure of ciprofloxacin, which caused the haloxixine Raman signal to weaken and many Raman peaks to change, mainly pyrazine ring at 1 184 and 1 252 cm-1. The vibration frequency of C—F at Raman, C C at 1 627 cm-1 and O—C—O at 1 458 cm-1 changed; the increase of aminophylline content had a more serious effect on the structure of ciprofloxacin, of which the Raman peak at 800~1 200 cm-1 disappeared. When the amount of aminophylline exceeded 22.5 mg·L-1, almost no other peak appeared except for the weak signal at 1 384 cm-1. As a commonly used analytical tool, surface-enhanced Raman spectroscopy has the advantages of short analysis time and high sensitivity. The experiment used SERS technology to investigate the interaction between aminophylline and ciprofloxacin, and provided a reference for its pharmacological research.
环丙沙星作为新一代的喹诺酮类抗生素, 因其抗菌活性强、 毒性低、 组织穿透能力强等优点, 是当前世界上抗感染药物最佳品种之一[1]。 在临床医学[2]、 水产养殖等多个行业得到了广泛的应用[3]。 氨茶碱是茶碱与乙二胺的复盐, 是一类常规的临床药物。 其药理作用主要是源于茶碱 , 乙二胺增强其水溶性[4]。 但由于氨茶碱受多种因素的影响, 很容易引发不良反应。 而临床上, 氨茶碱与环丙沙星联用的机会非常频繁, 有研究报道喹诺酮类抗菌药物与氨茶碱联合使用, 会引发严重的副作用, 比如心律失常、 恶心呕吐等症状[5, 6]。 研究表明当氨茶碱的血液浓度超过20 μ g· mL-1, 甚至会导致毒性反应[7]。 因此, 深入了解氨茶碱的使用量对环丙沙星的影响, 这对于临床医学来说具有实际意义。
目前有关环丙沙星的研究已有许多的报道, 王佩[8]等研究了环丙沙星对氨茶碱药物的动力学影响; 何华[9]等利用荧光光谱对环丙沙星与牛血清白蛋白之间的相互作用进行了研究; 赵进辉[10]等利用表面增强拉曼光谱, 实现了对鸭肉中环丙沙星残留的快速检测。 而这些仅是对环丙沙星进行定量的检测或研究环丙沙星与蛋白之间的相互作用, 有关于氨茶碱对环丙沙星分子结构影响的研究未见报道。
表面增强拉曼光谱因作为一个高灵敏度的分析工具而获得了巨大的关注与应用。 有相关研究表明喹诺酮类抗菌药物与氨茶碱的联用, 会引起严重的副反应, 危及人体健康。 实验利用表面增强拉曼光谱技术, 考察了氨茶碱对环丙沙星的影响, 了解两者的作用方式对于药物的混合使用具有重要的理论意义和实践意义。
环丙沙星(C17H18FN3O3)、 氨茶碱(C16H24N10O4)、 氯金酸(HAuCl4)、 柠檬酸钠(NaC6H5O7· 2H2O)统购于阿拉丁; 以上试剂均为分析纯, 实验室用水为自制的超纯水, 电阻率为18.3 MΩ · cm。
Renishaw lnvia拉曼光谱仪(英国雷尼绍公司), 激光波长为633 nm, 激光强度为1 mW, 拉曼光谱检测波长范围0~3 000 cm-1; UV-2450紫外-可见分光光度计(岛津), pH酸度计(上海雷滋pHSJ-3); 透射电子显微镜(TEM)(德国蔡司)。
根据Lee[11]的方法制备金纳米基底, 以柠檬酸钠作为还原剂。
环丙沙星溶液的配制: 称取环丙沙星固体10 mg, 溶解于蒸馏水, 定容至50 mL, 再将其稀释至浓度为4 mg· L-1, 待用。
氨茶碱溶液的配制: 称取氨茶碱固体1 mg, 溶解于蒸馏水, 定容至50 mL, 待用。
SERS检测: 运用密度泛函理论计算环丙沙星的拉曼峰; 测定环丙沙星固体的常规拉曼光谱与环丙沙星溶液的表面增强拉曼光谱, 并对环丙沙星的拉曼峰进行全面的归属; 分别探究了环丙沙星与氨茶碱的结合时间以及氨茶碱的量对环丙沙星的影响。
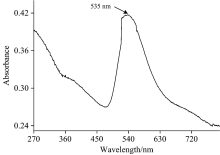
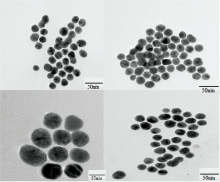
实验测定了纳米金的吸收光谱, 结果如图1所示。 纳米金的吸收峰会受到其形状、 聚合度等影响[12]。 由图1可知, 纳米金的吸收峰大约在535 nm处, 与文献[13]所报道的金纳米粒子的吸收峰基本一致。 图2是金纳米粒子的TEM扫描图, 其粒径大小在17 nm左右。 从图中可以看出, 纳米金分散较为均匀, 加上金纳米粒子的比表面较大, 能有效地吸附样品分子。
密度泛函理论是一种利用量子力学研究多电子体系电子结构的方法, 它在物理和化学领域都有很广泛的应用, 特别是用来研究分子的性质, 是化学领域计算经常使用的方法之一。 从图3中可以看出, 在500~3 000 cm-1拉曼位移之间, 两者峰型的匹配程度较好, 但仍有一些细微的差别。 参考《有机结构波谱鉴定》与文献[14, 15]对环丙沙星的拉曼峰进行了相应的归属。 其中355, 410以及465 cm-1处属于C— H弯曲振动, 637 cm-1是环的变形振动, 704和753cm-1归属于环呼吸振动, 826和1 544 cm-1为C— N的伸缩振动, 943和1 341 cm-1归属于C— H弯曲振动, 1 029, 1 102, 1 145, 1 184及1 194 cm-1是属于吡嗪环呼吸振动, 1 274 cm-1归属于C— F伸缩振动, 1 390 cm-1为O— C— O对称伸缩振动, 1 458 cm-1属于O— C— O的非对称伸缩振动, 1 623 cm-1是C═C 伸缩振动, 1 703 cm-1归属于C═O伸缩振动, 3 013和3 087 cm-1属于O— H伸缩振动。 而3 000 cm-1以后的波数区, 环丙沙星理论计算出现的谱峰信息与固体拉曼光谱信息略有不同, 这是由于实验测试的是环丙沙星分子之间作用力的综合表现, 而理论没有考虑到分子间的作用力, 从而导致该区域信号弱。 结果如图3(a)和(b)所示。 同时对环丙沙星溶液进行了常规拉曼检测与SERS检测, 结果如图3(c)所示, 图3(c)中a为环丙沙星溶液的常规拉曼, b是环丙沙星溶液的SERS拉曼。 从图中可以看到, 环丙沙星的SERS光谱图中出现较多拉曼信号较强的峰, 主要集中在1 200~1 700 cm-1, 表明环丙沙星溶液与金纳米粒子混合后, 环丙沙星分子中各官能团的振动获得了较大提升, 拉曼峰得到了很大程度的增强。 其中744, 1 384和1 627 cm-1这三处拉曼信号较强, 结合上述的拉曼分析确定是环丙沙星固体拉曼光谱的753, 1 390和1 623 cm-1, 并与环丙沙星的理论计算值相吻合, 其中624, 753, 1 029, 1 274及1 458 cm-1处的拉曼位移略出现蓝移, 可能在极性溶剂中, 由于R带发生蓝移而造成的。 拉曼位移744 cm-1为环的呼吸振动, 1 342与1 384 cm-1处峰信号相对较强, 此处归属为O— C— O的伸缩振动, 可作为环丙沙星的表面增强拉曼光谱特征峰, 用于环丙沙星的定性定量分析。 而环丙沙星溶液的常规拉曼光谱, 无增强信号出现。 从图中可以发现环丙沙星的SERS信号强度远远超过其常规拉曼, 表明以金纳米粒子为基底, 环丙沙星的拉曼峰有明显的增强。 环丙沙星理论计算值以及实验测试拉曼峰的归属见表1。
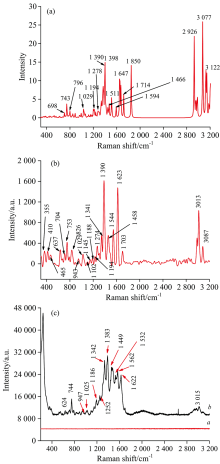 | 图3 环丙沙星理论计算值(a)和固体的常规拉曼光谱(b)与环丙沙星溶液的SERS光谱(c)Fig.3 Calculated values of ciprofloxacin (a) and conventional Raman spectra of solids (b) and SERS spectra of ciprofloxacin solution (c) |
| 表1 环丙沙星的拉曼位移及归属 Table 1 The Raman displacement and attribution of CIP |
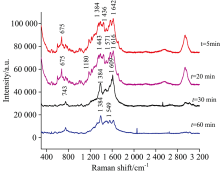
为了探究不同结合时间对环丙沙星与氨茶碱之间拉曼光谱的影响, 研究了不同的结合时间, 氨茶碱与环丙沙星结合后的拉曼光谱。 从图4中可以看出, 结合时间在5~20 min之间, 环丙沙星与氨茶碱混合后的出峰位置大致相同, 而当t=30 min, 两者混合物的拉曼峰发生了明显的变化, 其中较为明显的是拉曼位移1 384和1 617 cm-1两处信号增强, 由于过长时间的结合, 氨茶碱对环丙沙星的影响更甚。 而t=60 min时, 拉曼位移1 568, 1 224和1 170 cm-1处峰消失, 随着时间的延长, 两者的作用加强, 拉曼信号大大减弱。
将氨茶碱溶液加入到环丙沙星溶液中, 结果如图5所示。 当氨茶碱与环丙沙星体积比按1:1混合时, 环丙沙星947 cm-1处的C— H弯曲振动拉曼峰分裂为1 002和1 020 cm-1两处峰, 而拉曼位移744, 1 184, 1 252, 1 342, 1 449, 1 627和3 015 cm-1等多处拉曼峰发生蓝移, 这是由于氨茶碱的加入, 使得环丙沙星的结构发生了改变。 1 184 cm-1处的吡嗪环由于氨茶碱大分子部分的撞击, 导致能量增大, 氨茶碱分子中的— NH2与环丙沙星分子的苯环结合, 使得1 252 cm-1拉曼位移的C— F振动频率加快, 氨茶碱分子结构中的碱性官能团— NH2与环丙沙星分子中的酸性官能团— COOH发生反应, 致使环丙沙星分子的O— C— O的振动频率发生变化, 酰胺中C═O伸缩振动大概波数范围在1 600 cm-1左右, 导致1 449 cm-1处拉曼信号减弱, 1 600 cm-1处拉曼信号增强。 氨茶碱分子影响了环丙沙星中的C═C的振动频率, 使得1 627 cm-1处的拉曼峰发生改变。 而1 384和1 569 cm-1没有发生移动, 与环丙沙星溶液的SERS相比, 拉曼信号强度减弱, 表明氨茶碱与环丙沙星有一定程度的结合, 氨茶碱的加入影响了环丙沙星的分子结构, 使得拉曼信号减弱。 当两者按照体积比为2:1混合时, 峰的强度减弱较为明显, 随着氨茶碱含量的逐渐增加, 对环丙沙星结构的影响更为严重。 其中744, 1 184和1 252 cm-1拉曼峰消失, 947 cm-1蓝移, 1 449 cm-1峰分裂为1 442和1 488 cm-1两处峰, 进一步说明了氨茶碱分子的部分官能团与环丙沙星分子的官能团结合, 使得环丙沙星的拉曼峰型发生改变。 而1 384 cm-1处的峰信号增强, 这是二者结合后酰胺中的C— N伸缩振动在此处有拉曼峰信号, 发生了峰的重叠, 导致信号增强。 当二者体积比例按3:1混合时, 即氨茶碱的量进一步增加到22.5 mg· L-1时, 除1 384 cm-1处有一点信号出现外, 其他峰几乎无增强信号, 说明氨茶碱的量达到22.5 mg· L-1时, 环丙沙星分子的结构受到了严重的影响[7], 其药效也将直接受到影响。
实验计算了环丙沙星(ciprofloxacin, CIP)的理论拉曼光谱峰, 环丙沙星溶液的表面增强拉曼光谱结果显示, 以金纳米粒子为基底, 环丙沙星的拉曼增强信号较强。 结合环丙沙星的理论计算值以及实验测定的拉曼光谱, 对环丙沙星做了全面的归属。 探究了不同结合时间对氨茶碱与环丙沙星混合物的影响, 结果表明结合时间超过20 min后, 环丙沙星与氨茶碱混合物的拉曼信号减弱, 随着结合时间的延长, 两者之间的作用力加强, 环丙沙星有部分的拉曼峰消失。 当氨茶碱与环丙沙星混合后, 多处拉曼峰发生改变, 其中1 184 cm-1处的吡嗪环、 1 252 cm-1处的C— F、 1 627 cm-1处的C C及1 458 cm-1处O— C— O的振动频率发生变化; 随着氨茶碱含量的逐渐增加, 其中800~1 200 cm-1拉曼峰消失; 而当氨茶碱的量超过22.5 mg· L-1时, 环丙沙星的拉曼峰除1 384 cm-1处C— N振动有微弱信号出现外, 其他峰几乎无增强信号出现。 利用SERS技术具有分析时间短, 灵敏度高等优点, 考察了氨茶碱与环丙沙星之间的相互作用, 这对临床药物的混合使用而言是有必要的。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|