作者简介: 张 露, 1987年生, 江西师范大学生命科学学院讲师 e-mail: zhanglu00104@163.com
荧光光谱学法具有灵敏度高、 选择性强、 样品用量少、 操作简便的优点, 同时又可提供多种分子间相互作用的物理参数, 所以被广泛用于研究小分子和蛋白质的相互作用。 因此, 通过内源荧光、 同步荧光以及三维荧光光谱技术, 研究异槲皮素抑制α-乳白蛋白(α-lactalbumin, α-La)-果糖体系糖基化过程中晚期糖基化产物(AGEs)形成的能力, 并从分子间相互作用的角度阐述其作用机制, 最终阐明异槲皮素抑制食品热加工过程中AGEs形成的能力。 结果表明, 异槲皮素可显著降低糖基化反应诱导的α-La构象变化, 抑制AGEs的形成, 样品浓度为36.58 μmol·L-1时, 其抑制率达74.66%, 高于阳性对照品氨基胍盐酸盐。 同步荧光和三维荧光光谱分析结果表明, 异槲皮素会改变α-La的构象, 使色氨暴露于更亲水的环境中, 增加其微环境的亲水性。 抑制动力学和热力学分析结果显示, 异槲皮素通过静态方式猝灭α-La的内源荧光, 且与α-La按照1:1的摩尔比例结合形成了稳定的复合物, 该结合是一个自发放热的过程, 范德华力和氢键是异槲皮素-α-La复合物形成的主要作用力。
Fluorescence spectroscopy has the advantages of high sensitivity, strong selectivity, small sample amount, simple operation, and can provide a variety of physical parameters of intermolecular interaction. So it is widely used to study the interaction between small molecules and proteins. To elucidate the potential of isoquercetin suppressing the formation of (advanced glycation end products, AGEs) during thermal processing of high-protein foods, intrinsic fluorescence, synchronous fluorescence and three-dimensional fluorescence spectroscopic techniques were employed to evaluate the inhibition through α-lactalbumin (α-La)-fructose model, and the mechanism was elucidated from the perspective of intermolecular interactions. The results showed that isoquercetin significantly decreased the conformational change of α-La induced by glycosylation, resulting in the inhibition on AGEs formation. The inhibition rate reached up to 74.66% when the sample concentration was at 36.58 μmol·L-1. As revealed by synchronous and three-dimensional fluorescence spectroscopy, isoquercetin could change the conformation of α-La, promote the exposure of tryptophan to a more hydrophilic environment, and increased the hydrophilicity of its micro-environment. Inhibition kinetics and thermodynamic analysis showed that isoquercetin quenched the intrinsic fluorescence of α-La by static mechanism, and bound with α-La in a molar ratio of 1:1 to form a stable complex. The formation of isoquercetin-α-La complexes is a spontaneous and endothermic progressing, van der Waals forces and hydrogen bonds are the main driving forces.
糖基化反应, 又叫美拉德反应, 是还原糖的醛基和蛋白质、 核苷酸和脂质的氨基之间发生的一种自发的非酶促反应[1], 通常包括初期、 中期和晚期三个阶段, 最后会形成一系列晚期糖基化终产物(advanced glycation end products, AGEs)。 在食品加工工业, 常通过糖基化反应提高蛋白质的功能特性(如起泡性、 乳化性、 抗氧化性等), 改善食品的风味、 色泽和口感 [2, 3]。 但食品体系或食品蛋白在糖基化过程中也会形成对人体有害的AGEs, 降低氨基酸的营养价值[4]。 研究发现, 坚果、 谷类产品、 高温加工的罐头产品、 烤肉、 饼干和蛋糕通常含有相对较高的AGEs[1]。 长期摄入富含AGEs的食物, 会导致AGEs在机体中的积累, 加速血管中胶原蛋白的交联, 促进活性氧和活性碳自由基的形成, 增强胰岛素抵抗, 促进促炎症反应等, 从而增加阿尔茨海默病、 糖尿病、 炎症、 心血管疾病、 视网膜病变等系列慢性疾病的发病率[5]。 添加AGEs抑制剂降低食品在热加工过程中AGEs的形成是提高食品安全, 促进人体健康的有效方法之一。
AGEs抑制剂包括合成和天然化合物两类, 其中植物来源的天然AGEs抑制剂因其种类多、 效果较好、 副作用小等优点已成为国内外的研究热点[6]。 Oral等[7]研究发现, 石榴皮提取物、 欧洲布什蔓越莓汁提取物、 咖啡酸、 儿茶素、 鞣花单宁等植物提取物和多酚类化合物可有效降低饼干焙烤过程中呋喃和丙烯酰胺的形成; 添加0.2%的白藜芦醇、 表儿茶素和迷迭香酸, 可使饼干中荧光性AGEs的形成量降低28.60%~62.05%[8]。 异槲皮素(槲皮素-3-O-葡萄糖苷)是普遍存在于植物中的功能性次级代谢产物, 具有降血压、 抗氧化、 保肝、 抗增殖、 抗利尿、 抗癌等多种生物活性[9], 前期研究发现, 槲皮素能有效抑制BSA-葡萄糖体系在37 ℃条件下的糖基化反应, 降低AGEs的形成, 但糖苷形式的槲皮素— — 异槲皮素, 能否有效抑制食品蛋白在热处理条件下的糖基化反应需进一步研究。
近年来, 荧光光谱法因其具有灵敏度高、 选择性强、 样品用量少、 操作简便, 同时又可以提供较多的物理参数的特点, 广泛应用于小分子和蛋白质的相互作用研究。 因此本文以α -La-果糖体系为研究模型, 通过分析荧光性AGEs相对含量的变化, 研究热处理条件下, 异槲皮素对α -La-果糖体系糖基化反应的影响, 然后通过内源荧光、 同步荧光和三维荧光光谱技术研究异槲皮素对α -La的构象结构、 微环境的影响及其相互作用机制, 最后从α -La结构变化和分子间相互作用的角度探讨异槲皮素抑制α -La糖基化的机制。
果糖、 异槲皮素(北京索莱宝科技有限公司); NaH2PO4和Na2HPO4(上海阿拉丁生化科技股份有限公司); α -La(美国Sigma公司)。
F-7000荧光光谱仪(日本日立公司); 天平FA1104N电子分析天平(丙林电子科技有限公司); PE28 PH计(梅特勒-托力多仪器(上海)有限公司)。
根据文献[10]报道方法制备糖基化体系。 采用0.2 mol· L-1、 pH 7.4的磷酸盐缓冲溶液(PBS)配制20 mg· mL-1的α -La和果糖溶液。 α -La和果糖溶液按等体积比加入带盖玻璃瓶中, 然后分别加入不同浓度的异槲皮素溶液, 使反应体系中异槲皮素的浓度分别为12.20, 24.39, 36.58, 48.78和73.17 μ mol· L-1。 用乙醇代替异槲皮素和用PBS代替果糖的反应体系分别设为控制组和样品空白组。 最后, 所有混合体系于55 ℃下反应36 h, 4 ℃冷却后, 测定其荧光性AGEs的相对含量。
1.3.1 AGEs抑制活性测定
采用日立F-7000荧光光谱仪测定样品中荧光性AGEs的相对含量[10]。 样品用0.2 mol· L-1、 pH 7.4的PBS稀释6倍后测定其在激发波长370 nm, 发射波长440 nm处的荧光强度, 激发和发射波长的狭缝宽度均设为2.5 nm, 扫描速度为1 200 nm· min-1。 AGEs抑制率的计算公式为
其中FIs为含有α -La、 果糖和异槲皮素的反应体系的荧光强度; FIc, FIb和FInb分别为控制组、 空白组和样品空白组的荧光强度。
1.3.2 内源荧光光谱
采用日立F-7000荧光光谱仪测定α -La内源荧光光谱的变化[11], 扫描参数为: 激发波长, 280 nm; 发射波长, 300~400 nm; 激发和发射波长的狭缝宽度, 5.0 nm; 扫描速度, 1 200 nm· min-1。 测定前用0.2 mmol· L-1, pH 7.4的PBS将所有样品稀释30倍。
1.3.3 同步荧光光谱
采用日立F-7000荧光光谱仪分析298 K条件下不同浓度异槲皮素对α -La同步荧光光谱的影响。 波长间隔(Δ λ )为15 nm时的扫描范围为260~350 nm, Δ λ 为60 nm时的扫描范围为250~350 nm, 激发和发射波长的狭缝宽度均为5 nm, 扫描速度为1 200 nm· min-1, α -La的浓度为0.3 mg· mL-1, 异槲皮素的浓度范围为0.0 ~25.97 μ mol· L-1。
1.3.4 三维荧光光谱
根据前期研究方法[12], 2.0 mL 0.3 mg· mL-1的α -La与10 μ L 0.5 mmol· L-1的异槲皮素在25 ℃下混匀后, 静置5 min, 然后测定其在激发和发射波长扫描范围均为200~600 nm时的荧光光谱, 激发和发射波长的狭缝宽度均为5.0 nm, 扫描速率为12 000 nm· min-1。
1.3.5 抑制动力学研究
采用荧光滴定的方法[13], 分别测定298, 304和310 K时, 不同浓度异槲皮素对α -La在300~400 nm范围内的荧光发射光谱的影响。 激发波长为280 nm, 激发和发射狭缝宽度为5.0 nm, 扫描速度为1 200 nm· min-1。 混合体系中, α -La的浓度为0.3 mg· mL-1, 异槲皮素的浓度从3.32 μ mol· L-1增加到25.97 μ mol· L-1。
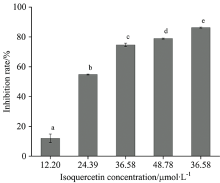
蛋白糖基化过程中形成的AGEs包括荧光性AGEs和非荧光性AGEs组成, 因此, 很多研究者采用荧光光谱技术评价样品抑制蛋白糖基化过程中AGEs形成的能力, 荧光强度越高, 表明反应体系中AGEs形成的相对含量越高, 抑制率就越低。 异槲皮素对α -La-果糖体系中AGEs形成的影响如图1所示, 当异槲皮素的浓度为12.20, 24.39, 36.58, 48.78和73.17 μ mol· L-1时, 其对AGEs形成的抑制率分别为11.97%, 54.79%, 74.66%, 78.90%和86.25%, 而阳性对照品氨基胍盐酸盐在浓度为24.39和36.58 μ mol· L-1时, 对AGEs形成的抑制率为38.21%和58.72%, 低于异槲皮素, 表明异槲皮素能有效抑制α -La糖基化过程中AGEs的形成。
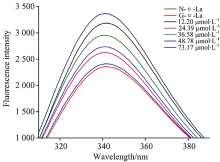
异槲皮素对糖基化α -La内源荧光强度的影响如图2所示。 天然α -La具有最大荧光强度, 糖基化后α -La的荧光从3 386降低至2 357。 说明糖基化反应能显著降低了α -La的内源荧光, 可诱导蛋白构象的展开, 降低其内源荧光强度[14]。 但随着异槲皮素浓度从12.20 μ mol· L-1增加到48.78 μ mol· L-1时, 糖基化α -La的内源荧光强度也逐渐增强, 说明异槲皮素能够降低糖基化反应诱导的α -La构象变化, 这可能是其抑制AGEs形成的原因之一。 Zhang等也表明, 缓解糖基化诱导的蛋白构象变化是天然提取物[10]和黄酮类化合物[11]抑制蛋白糖基化的机制之一。 但当样品浓度为73.17 μ mol· L-1时, 最大荧光强度值出现下降, 这可能是因为黄酮类化合物本身可与蛋白发生相互作用, 猝灭其内源荧光。 当黄酮的相对浓度过高的时候, α -La的糖基化反应被完全抑制, 反应体系中多余的黄酮类化合进一步猝灭蛋白质的的荧光, 改变其构象。
同步荧光光谱可以检测蛋白质的主要荧光性发色团苯丙氨酸、 酪氨酸和色氨酸, 激发波长为280 nm时, 蛋白质的荧光强度主要来源于色氨酸, 其次为酪氨酸, 因此, 可以通过同步荧光光谱技术分析异槲皮素对α -La中荧光性氨基酸残基附近微环境变化的影响。 如图3所示, Δ λ =15 nm和Δ λ =60 nm时的最大荧光发射光谱的变化分别反应酪氨酸和色氨酸微环境的变化。 酪氨酸[图3(a)]和色氨酸[图3(b)]残基的最大荧光强度均随着异槲皮素浓度的增加而明显降低, 其中对色氨酸的荧光猝灭效果明显高于酪氨酸, 其荧光强度分别从1 213和6 925降至827.4和3 700。 另外, 色氨酸的最大发射波长出现了红移现象, 而酪氨酸的最大发射波长没有明显的变化。 以上结果表明, α -La的荧光猝灭的主要贡献者是色氨酸, 异槲皮素与α -La的结合会改变色氨酸微环境的极性, 使其暴露在更加亲水的环境中, 增加其周围微环境的亲水性[13]。 这可能是因为色氨酸比酪氨酸对其周围极性的变化更敏感, 如芹菜素、 柚皮素、 山柰酚和染料木素与β -乳球蛋白的相互作用使色氨酸的荧光发射波长发生红移, 但是对酪氨酸的最大发射波长无影响[15]。
三维荧光光谱技术可以研究蛋白质的构象变化。 异槲皮素对天然α -La的三维荧光光谱的影响如图4所示, Rayleigh(Ex=Em)峰是瑞利散射峰, 峰1(Ex=280 nm, Em=330 nm)为色氨酸残基的分光特性峰, 主要表明蛋白质的多肽骨架结构的变化。 从图4(a)和(b)可以看出, α -La与异槲皮素相互作用后, Rayleigh峰和峰1的荧光强度显著降低, 这可能归因于色氨酸荧光团微环境的变化以及α -La内多肽骨架结构的变化[13]。
2.5.1 荧光猝灭动力学
荧光光谱是研究小分子配体和蛋白受体间相互作用的强有力的工具, 已广泛被用于研究生物大分子和小分子间的相互作用机制[13, 15]。 由图5(a)所示, α -La的荧光强度随异槲皮素浓度的增加逐渐降低, 且发射波长出现了明显的蓝移, 表明异槲皮素改变了α -La的构象结构, 有效猝灭了α -La的内源荧光, 其荧光猝灭机制可通过Stern-Volmer方程计算
式(2)中, F和F0分别为含和不含异槲皮素时α -La的荧光强度; [Q]是异槲皮素的浓度; Kq为荧光猝灭速率常数; KSV为Stern-Volmer猝灭常数; τ 0为没有猝灭剂的情况下α -La的平均荧光寿命。
以异槲皮素浓度[Q]为横坐标, F0/F为纵坐标绘制的Stern-Volmer曲线如图5(b)所示, 根据方程计算的KSV和Kq如表1所示, KSV随着反应温度的升高而降低, Kq在298, 304和310 K时的值分别为6.07× 1012, 5.33× 1012和5.14× 1012 L· mol-1· s-1, 且远高于生物大分子最大扩散碰撞猝灭常数(2× 1012 L· mol-1· s-1), 表明异槲皮素是通过静态方式猝灭α -La的内源荧光[16]。
2.5.2 结合常数和热力学参数
基于静态猝灭机理, 可采用double logarithmic方程(3)计算结合常数Ka和结合位点数n
结合常数Ka和结合位点n如表1所示, 异槲皮素和α -La的Ka值随温度升高逐渐减小, 并且与KSV的变化一致, 说明随温度的升高, 异槲皮素-α -La复合物的稳定性降低, 说明异槲皮素与α -La的结合是一个放热的过程。 结合位点数n分别为1.368, 1.472, 1.128, 接近于1。 说明异槲皮素在α -La上是只有一个或者一类结合位点的[13]。
用van’ t Hoff方程计算热力学参数中的焓变(Δ Ho), 熵变(Δ So)和自由能变化(Δ Go)来研究异槲皮素-α -La复合物的形成过程中的热力学变化, 即
其中R是气体常数(8.314 J· mol-1· K-1), T是实验温度(288, 298和310 K), Ka是通过式(2)得到的结合常数。 根据方程(4)绘制以lnKa为纵坐标, 以1/T为横坐标的直线[图5(d)], 得到的Δ Ho, Δ So和Δ Go如表1所示。 根据文献报道, Δ Ho< 0, Δ So< 0表明氢键和范德华力是分子间的主要作用力; Δ Ho> 0, Δ So> 0表明疏水相互作用是分子间的主要作用力; Δ Ho> 0, Δ So< 0表明静电相互作用是分子间的主要作用力[15]。 异槲皮素与α -La相互作用的Δ Ho和Δ So分别为-458.79和-1.39 kJ· mol-1, 均小于0, 且|Δ Ho|< |TΔ So|, 这进一步验证了异槲皮素与α -La的结合是一个放热的过程, 范德华力和氢键是其主要驱动力。 另外, Δ Go< 0, 表明异槲皮素-α -La复合物的形成是一个自发的过程[16]。
| 表1 槲皮素与α -La相互作用的荧光猝灭常数、 结合位点数、 结合常数和热力学参数 Table 1 The fluorescence quenching constants, binding sites, binding constant and thermodynamic parameters for the interaction of isoquercetin with α -La |
通过荧光光谱技术研究了异槲皮素抑制α -La-果糖模型中AGEs形成的能力。 研究结果表明, 异槲皮素可以显著抑制α -La糖基化过程中AGEs的形成, 减弱糖基化反应诱导的α -La构象变化。 同时, 异槲皮素与α -La的相互作用会显著猝灭α -La的内源荧光, 改变α -La的构象, 使色氨酸暴露在更加亲水的环境中, 增加其微环境的极性。 分子间相互作用研究发现, 异槲皮素与α -La作用后按照1:1的摩尔比结合形成了稳定的复合物, 且通过静态的方式猝灭α -La荧光团; 异槲皮素-α -La复合物的形成是一个自发的放热过程, 范德华力和氢键是其主要作用力。 本研究结果证明, 异槲皮素可作为天然的糖基化抑制剂用于食品加工工业, 减少食品热加工过程中AGEs的产生, 提高食品的营养品质和安全性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|