作者简介: 曾剑华, 1993年生, 哈尔滨商业大学食品工程学院硕士研究生 e-mail: foodleslie@163.com
汉麻是高端植物油脂的重要来源, 而汉麻饼粕中含有大量的优质蛋白目前尚未得到充分开发利用。 汉麻蛋白含有20种氨基酸, 必需氨基酸含量相对均衡, 且其精氨酸含量较高, 是一种营养丰富的优质植物蛋白源; 但汉麻蛋白溶解性较差, 这严重限制了其在食品加工中的应用。 目前对汉麻分离蛋白构象研究还较少, 在加工过程中酸碱性变化对其构象的影响研究还少未见报道。 该研究采用圆二色谱、 傅里变换叶红外光谱、 荧光光谱和紫外光谱技术对汉麻分离蛋白(HPI)构象进行表征, 并与大豆分离蛋白构象进行比较, 同时探究不同pH条件对HPI构象的影响。 构象分析结果显示: 与大豆分离蛋白相比, 圆二色谱和傅里叶变换红外光谱结果显示HPI含有比例更高的α-螺旋结构(39.1%和33.1%), 而SPI含有较多的β-折叠; 荧光光谱和紫外光谱结果显示, HPI暴露的芳香族氨基酸残基含量较少, 此外HPI分子内含有更多的二硫键(10.06 μmol·g-1)以及更高的表面疏水性(374), 且HPI的游离巯基/总巯基比值显著( p<0.05)小于SPI中游离巯基/总巯基比值, 表明HPI三级结构紧凑程度要高于SPI的三级结构。 因而导致天然HPI分子粒径小于SPI。 强酸强碱条件下, HPI分子结构得到适当伸展, 粒径变大, 芳香族氨基酸残基之间的距离增大, 降低了Phe到Tyr和Trp的能量传递效率, 最终导致Try残基荧光强度减弱, Phe和Tyr残基的荧光部分得到显示, 改变HPI的结构特性。 相对而言, 在酸性条件下HPI的构象稳定性相对较差, 蛋白亚基容易发生解离缔合反应; 而在碱性条件下, HPI构象则相对稳定, 且构象灵活性更大。 借助荧光光谱和紫外二阶导数光谱, 可以推测HPI氨基酸残基微环境的变化, 从而了解蛋白质分子三维结构的变化信息。 综上所述, 深入对HPI构象的了解以及明晰酸碱性变化对HPI构象的影响有利于为特异性改性HPI制备高品质的汉麻籽蛋白粉以及具有生理活性的多肽提供理论参考。
Hemp seeds are the important resource of high-quality vegetable oil, while the numerous high-quality protein in the hemp seed meal has not been fully exploited. Hemp protein isolates (HPI) are the resource of the high-quality protein, containing 20 kinds of amino acids with a relative equilibrium of the content of 8 essential amino acid and a high content of Agr. However,the application of HPI in food processing was severely hindered by the poor protein solubility. At present, there was a few pieces of literature on the conformation of HPI, and the effect of pH change on its conformation during processing has not been reported. In this study, the conformation of hemp protein isolate (HPI) was characterized by Circular dichroism (CD) spectrum, Fourier transforms infrared (FTIR) spectroscopy, Fluorescence spectrum and Ultraviolet (UV) spectrum, which compared with soybean protein isolate (SPI). The effects of different pH conditions on the conformation of HPI were investigated. Conformation results showed that comparing with SPI, there was more α-helix content in HPI, determined by CD and FTIR, which was 39.1% and 33.1%, respectively, while SPI contained β-sheet. The exposure of aromatic amino acid residues from HPI was lower than SPI, revealed by intrinsic fluorescence and UV spectroscopy. Moreover, the content of disulfide bond of HPI (10.06 mmol·g-1) was more than SPI, as was as higher surface hydrophobicity (374), but the value of free sulfydryl/total free sulfydryl of HPI was significantly lower than that of SPI. These results suggested that the tertiary structure of HPI was more compact than SPI, leading to a smaller particle size of nature HPI. The structure characteristics of HPI were changed in strong acid and strong alkaline conditions, which induced the structure of HPI to unfold and increased the size. As a result, the distance between aromatic amino acid residues was increased, and the energy transfer efficiency of Phe to Tyr and Trp was decreased. Finally, the fluorescence intensity of Try residues was decreased, and the fluorescence of Phe and Tyr residues was partly showed. Comparatively speaking, under acidic conditions, the conformation stability of HPI was relatively poor, and dissociation-association reactions were prone to the protein subunits. However, the conformation of HPI was relatively stable and with more flexibility. Therefore, with the help of fluorescence spectrum and UV second derivative spectrum, changes in the microenvironment of amino acid residues of HPI could be predicted, so as to understand changes in the three-dimensional structure of protein molecules. In conclusion, further understanding of HPI conformation and clarifying the influence of pH changes on HPI conformation are conducive to providing a theoretical reference for specific modification of HPI to prepare high-quality HPI and active physiological polypeptides.
汉麻俗称大麻、 火麻, 汉麻籽中油脂和蛋白的含量约为40%~50%和25%~30%; 国际上将四氢大麻酚含量低于0.3%的大麻品种称为工业大麻, 我国将工业大麻称为汉麻[1]。 中国是全球汉麻籽最大生产国和出口国, 目前, 汉麻籽的主要利用方式是提取汉麻纤维和制备高端植物油, 而剩下大量富含蛋白的汉麻籽饼粕没有得到充分的利用。 如何充分利用丰富的汉麻籽饼粕资源开发高品质的汉麻籽蛋白粉及其衍生物已成为目前汉麻产业发展的重大问题之一。
国外较早研究报道了汉麻分离蛋白(hemp protein isolate, HPI), 汉麻蛋白主要由35%的白蛋白和65%球蛋白组成, 而球蛋白主要由麻仁球蛋白构成, 其中麻仁球蛋白是由酸性亚基和碱性亚基通过二硫键键合而成的六聚体[2]。 国外关于汉麻蛋白的功能、 生物活性及其衍生肽的相关报道已有很多[3]; 如, Hadnađ ev等[4]研究显示HPI的最低溶解度在pH 5.0, 且碱提过程有助于提高HPI的保水性; Teh[3]和Malomo等[5]研究显示汉麻水解物具有抗氧化和降血压等作用。 目前国外对汉麻蛋白的研究已深入到蛋白结构与功能的构效关系研究, 如Malomo等[2]研究了汉麻蛋白中水溶性蛋白和盐溶性蛋白的结构和功能关系, 与麻仁球蛋白比, 白蛋白因含有的二硫键含量较少, 因而其蛋白结构具有良好的柔性, 致使其具有较高的溶解性和起泡性; 发现汉麻蛋白产品的功能特性不仅取决于蛋白浓度和pH值, 还与汉麻分离蛋白构象具有密切关系[6]。 而国内对汉麻蛋白的研究主要是2000年后, 对汉麻蛋白的研究起步较晚; 且主要集中在汉麻蛋白的提取及其肽的衍生物制备研究, 如张涛等[7]通过正交优化得到汉麻蛋白提取率达70.56%; Tang等[8]研究显示汉麻蛋白水解物具有良好的抗氧化功能。 然而, 关于汉麻分离蛋白构象特征等研究国内还未有报道, 而蛋白构象对其功能性有着重要的影响, 因此有必要对HPI的构象展开研究。
本试验以脱脂汉麻饼粕为原料制备HPI, 利用圆二色谱、 傅里叶红外光谱、 荧光光谱和紫外光谱等手段表征HPI构象; 并探究不同pH条件对HPI构象的影响。 本文对HPI构象的研究有助于了解汉麻分离蛋白结构及与小分子相互作用等信息, 为特异性改性HPI制备高品质的汉麻籽蛋白粉以及具有生理活性的多肽提供理论参考。
Nano-ZS-90马尔文激光粒度仪(英国马尔文仪器有限公司); Spectrum Two傅里叶变换近红外光谱仪和LAMBDA 365紫外光谱(美国珀金埃尔默股份有限公司); F-7000荧光光谱仪(日本日立仪器(上海)有限公司); ALPHA 1-2 LD plus冷冻干燥机(德国Christ); Chirascan qCD(英国应用光物理公司)。
汉麻籽仁(广西巴马: 蛋白31.11%± 1.15%、 脂肪53.05%± 2.32%); 大豆分离蛋白(实验室自制, 蛋白92.64%± 1.34%, 脂肪0.4%± 0.12%); 硼酸、 硫酸铜、 磷酸氢二钠, 磷酸二氢钠等均为国产分析纯。
汉麻籽仁先用正己烷以1:4(w/v)脱脂4 h, 后在通风橱烘干(40 ℃)。 称取一定量的脱脂汉麻籽饼粕(蛋白57.93%± 1.32%), 与去离子水以按1:15(w/v)料液比混合, 用1 mol· L-1 NaOH调节料液至pH 8.5, 震荡(200 r· min-1、 60 min、 25 ℃)碱提1 h, 离心(10 000 r· min-1, 20 min), 上清液用1 mol· L-1 HCl调节至pH 4.7, 静置30 min后, 离心(10 000 r· min-1、 20 min), 得到汉麻籽蛋白凝乳, 调节汉麻籽蛋白凝乳pH值为7.0, 冷冻干燥得到汉麻分离蛋白(蛋白含量90.54%± 1.45%, 脂肪含量1.4%± 0.32%)备用。
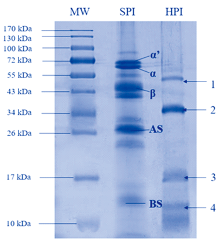
如图1, 通过聚丙烯酰胺凝胶电泳分析可知HPI主要为分子量为37 kDa(2号条带)和21 kDa(3号条带)由酸性亚基和碱性亚基组成的麻仁球蛋白; 光密度分析结果显示HPI中麻仁球蛋白组分占HPI 76.41%, 白蛋白占23.59%左右。 此外, 51 kDa和12 kDa左右有一条明显的条带(1和4号条带), 可能与HPI中白蛋白成分相对应, 此结论与Tang等人研究结论相一致[13]。
将HPI用0.05 mol· L-1 不同pH(3.0~10.0)的磷酸盐缓冲溶液配制成2 mg· mL-1蛋白溶液, 溶解过夜后备用。
HPI和SPI巯基含量的测定参考Beveridge[9]改进的Ellman试剂法。
采用马尔文激光粒度仪测定样品的流体动力学粒径及其分布。 将蛋白样品用 pH 7.2的磷酸盐缓冲液配制成1 mg· mL-1的蛋白溶液, 过0.45 μ m水系醋酸纤维素滤膜。 测定温度为25 ℃、 平衡时间为120 s、 分散相折射率为1.471和分散剂折射率为1.330条件下测定3次取平均值。 将蛋白样品用DTS1060C皿在Malvern Zeta Plus测定电位。
将样品用磷酸盐缓冲液(pH 7.2, 0.01 mol· L-1)稀释成浓度为0.2 mg· mL-1, 采用Chirascan qCD圆二色光谱仪在波长范围为190~260 nm内扫描三次取平均值, 光径10 mm, 扫描频率为90 nm· min-1, 间隔时间0.25 s, 以相应磷酸盐缓冲液为溶剂空白。
将冻干的蛋白样品置于干燥器内, 充分干燥, 精确称取2 mg干燥的蛋白样品, 加入200 mg的KBr, 研磨混合均匀, 然后进行压片, 样品红外光谱扫描, 扫描波段 4 000~400 cm-1, 分辨率4 cm-1, 扫描次数32。 采集的红外图谱进行基线校正和平滑处理后, 使用Peakfit 4.0.2结合Origin 2017对蛋白酰胺Ⅰ 带(1 700~1 600 cm-1)做二阶导数、 去卷积和高斯曲线拟合, 根据峰面积计算各种二级结构的相对百分含量。
采用F-7000荧光光谱仪测定蛋白样品荧光光谱, 将样品液用pH 7.2的盐酸缓冲溶液(PBS)稀释为浓度为0.1 mg· mL-1, 在激发和发射狭缝均为5 nm、 电压为500 V条件下, 以激发波长295 nm, 从300~400 nm波长范围扫描得到荧光光谱, 扫描3次取平均值最后得到内源荧光光谱。
外源荧光采用1-苯胺基-8-萘磺酸荧光探针(ANS)法测定疏水性, 用pH 7.2磷酸盐缓冲液配制2 mg· mL-1的蛋白样品溶液, 并稀释成0.02, 0.04, 0.06, 0.08和1 g· mL-1的蛋白样品溶液; 测试前, 取2 mL样品液加入20 μ L 8 mmol· L-1 ANS, 摇匀静置3 min; 在狭缝为5 nm、 激发波长330 nm、 发射波长490 nm测定样品荧光强度(FI); 试剂做空白。 以相对荧光强度对蛋白浓度作图, 曲线初始阶段的斜率即为蛋白质分子的表面疏水性指数(H0)。
称取一定量的蛋白样品, 溶于10 mmol· L-1磷酸缓冲液(pH 7.2)中, 配置成浓度为0.5 mg· mL-1的溶液, 磁力搅拌后于25 ℃离心(10 000 r· min-1, 10 min), 上清液用于紫外光谱分析。 波长范围为190~800 nm, 分辨率为0.2 nm, 扫描速率为60 nm· min-1。 所得的紫外光谱经origin软件微分化得到紫外光谱二级导数光谱[图4(b)]。
在pH 7时, 汉麻蛋白(HPI)游离巯基和二硫键含量如表1所示, 与SPI相比, HPI的游离巯基、 二硫键和总巯基含量均显著(p< 0.01)高于大豆分离蛋白(SPI)中游离巯基、 二硫键和总巯基含量, 分别为10.06, 12.14和32.26 μ mol· g-1。 HPI中麻仁球蛋白含量约为65%, 而SPI中大豆球蛋白含量约为50%~60%, 即HPI中11S球蛋白含量比SPI中11S球蛋白含量高, 11S球蛋白是由碱性亚基和酸性亚基通过二硫键维持的六聚体, 因而由此也可以推测出HPI中二硫键含量高于SPI中二硫键的含量。 此外, HPI的游离巯基/总巯基比值显著(p< 0.05)小于SPI中游离巯基/总巯基比值, 表明HPI三级结构紧凑程度高于SPI的三级结构。
| 表1 HPI和SPI中游离巯基、 总巯基和二硫键含量及游离巯基/总巯基比值 Table 1 Free sulfydryl tatol sulfydryl and disulfide bond content in HPI and SPI, as well as the value of Free sulfydryl/tatol sulfydryl |
在25 ℃、 pH 7.2 条件下HPI和SPI粒径分布如图2(a)所示, HPI和SPI粒子数量主要分布范围集中在10 nm左右, 该部分粒子主要为HPI和SPI的天然态, 与文献[9, 10]报道SPI中11S球蛋白(9.5 nm× 9.5 nm× 4.0 nm)和7S球蛋白(9.6 nm× 9.6 nm× 4.4 nm)的大小基本一致; 由此推测, HPI中白蛋白和麻仁球蛋白的粒子大小约为10 nm左右, 由于HPI三级结构比SPI紧凑(表1), 导致HPI粒子大小相比SPI小一些。 还有一部分粒径分布在100~1000 nm范围内的粒子, 这主要是天然态HPI交联形成的可溶性聚集体或者微小杂质造成的; 由此得到的HPI平均粒径为167.4 nm, SPI平均粒径为83.5 nm, HPI平均粒径大于SPI, 可能是因为HPI具有较大的表面疏水性(HPI: 374, SPI: 173), HPI之间通过疏水相互作用形成较大的聚集体。
HPI和SPI表面电荷曲线分布如图2(b)所示, 在pH从10到2过程中, HPI和SPI的表面电荷由负值变成正值, 也即蛋白质分子逐渐质子化过程; 且SPI的表面电荷变化程度大于HPI, SPI等电点(4.51)比HPI等电点(4.65)小, 这个差异主要是由于SPI中酸性氨基酸含量大于HPI, 这些氨基酸使得SPI具有酸性特征。 而本研究中HPI等电点(4.7)比现有文献记载(pI=5)略低, 可能是由蛋白品种差异造成[4]。
2.3.1 二级结构分析
HPI和SPI二级结构表征如图3所示, 由图3(a)可知, 与SPI相比, HPI在208和222 nm处有显著的负吸收双峰, 表明HPI二级构象中α -螺旋含量高于SPI; HPI和SPI在195 nm处具有显著正吸收峰, 表明HPI和SPI均含有β -折叠结构[11]。 经dichroweb拟合得出HPI和SPI二级结构分别为: α -螺旋39.1%和11.7%、 β -折叠13.1%和34.4%、 β -转角21.9%和22.9%、 无规则卷曲25.9%和31.9%。 此外, HPI的摩尔椭圆率大于SPI, 也证实了HPI具有紧密的结构特征[2]。
 | 图3 HPI和SPI的圆二色谱图(a)、 傅里叶红外光谱(b)及其酰胺Ⅰ 带分峰拟合结果(c: HPI, d: SPI)图Fig.3 Circular dichroism (a), FTIR (b) and curve-fitting results of amide I band (c: HPI, d: SPI) of HPI and SPI |
由图3(b)可知, HPI和SPI均在2 800 cm-1附近有— NH和— OH的伸缩振动峰; 在3 010~2 700 cm-1范围内有烷烃或烯烃类(脂肪)的碳碳键或氢键伸缩振动峰, 在1 744 cm-1附近具有脂基C=O键典型的伸缩振动峰[12], 其中HPI吸收峰强度远大于SPI, 表明HPI中油脂残留含量高于SPI, 这与原料信息结果一致。 在1 650~1 500 cm-1范围内的吸收峰是蛋白质典型的肽键(O=C— N— H)振动峰。 在1 150~1 000 cm-1范围内吸收峰是由碳水化合物引起的, 1 237 cm-1处的吸收峰则是由C— O或O— H弯曲振动产生的[12]; 由HPI的FTIR图谱可知HPI中结合油脂含量较高。 由图3(c)和(d)可知, HPI和SPI酰胺Ⅰ 带经peakfit分峰拟合后得到的二级结构含量基本与CD得到的二级结构含量一致, HPI含有较多的α -螺旋结构, 而SPI含有较多的β -折叠。
2.3.2 三级构象分析
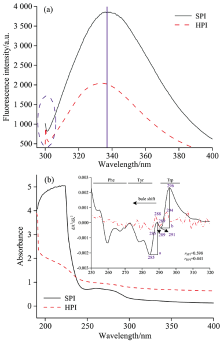
由图4(a)可知, HPI和SPI均在330~340 nm附近具有典型的色氨酸残基最大荧光吸收峰, 与SPI相比(λ max 336.9), HPI最大吸收波长为λ max 334.4, 说明HPI的亲水性比SPI要差, 也即HPI结构更紧凑, 这与现有文献记载HPI溶解性低于SPI的结果相符[13]。 与SPI相比, 在300~310 nm处, HPI出现一个小的吸收峰, 可能是为HPI中酪氨酸高于SPI, 因而暴露于亲水环境的酪氨酸比SPI更多, 导致吸收峰比SPI更明显[6], 此外, 该处的吸收峰还可能有苯丙氨酸残基的荧光贡献。 而SPI最大荧光吸收比HPI要强, 可能是因为HPI结构紧密, 导致芳香族氨基酸残基暴露的程度比SPI差。
同理, 由图4(b)可知, HPI和SPI在190~400 nm范围内出现两个蛋白特征吸收峰在200~230和260~280 nm; 在260~280 nm处HPI吸收峰强度比SPI弱, 也说明HPI暴露的芳香族氨基酸残基含量较少, 具有紧凑的三级结构特征。 这两个特征吸收峰是由芳香族氨基酸残基π → π * 跃迁产生, 常规紫外光谱难以分辨酪氨酸、 色氨酸和苯丙氨酸残基对局部微环境影响的贡献, 而二阶导数光谱能很好得分辨以上三个发色基团的贡献率; 由HPI紫外二阶导数光谱可知, HPI和SPI在280~300 nm内有两个正吸收峰, 分别为288, 294 nm和289, 296 nm, 两个负吸收峰285, 289 nm和285, 291 nm; 与SPI相比, HPI发生蓝移, 这与内源荧光结果一致。 此外, 两正负吸收峰距离的比例(r=a/b)可用来推测酪氨酸对构象变化的影响, r值越大, 蛋白结构伸展程度越大, 由图4(b)得到的rHPI和rSPI分别为0.441和0.589, 即SPI伸展程度大于HPI。
基于以上得出的HPI结构信息, 为改善HPI溶解特性等功能特性, 探究不同pH条件对HPI构象的影响。
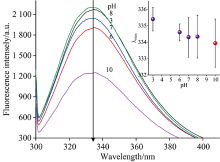
图5可知, 在pH 7→ 3过程中荧光强度先下降后增大, 并伴随着红移; 当pH 7→ 10时, 荧光强度先增大后降低, 伴随着蓝移。 HPI中含有Phe, Tyr和Trp 3个发色基团, 且能量转移由Phe到Tyr和Trp是非常有效的, 因而含有这些基团的蛋白质的吸收性质并不是这些基团的简单加和, 通常认为当发射波长大于290 nm时, 可认为荧光都来自Trp残基[14]。 在pH 3.0时, 大部分Trp暴露在亲水环境中, 且红移至335.4 nm, 表明此时HPI结构比较松散[2]。 在pH 6.0时, 荧光强度下降, 最大发射波长发生微小红移至334.6 nm, 表明pH 6.0条件下, 酸诱导HPI蛋白分子展开, 降低了Phe到Tyr和Trp的能量传递效率, 使得Trp的荧光强度下降[14]。 在pH 8.0时, 荧光强度增强, 表明蛋白分子结构发生了重排, Trp和Trp的相互作用增强, 同时蛋白分子表面的芳香族氨基酸由表面转移至疏水核心, 从而导致荧光强度增大[2, 6]。 而在pH 10.0时, HPI荧光强度显著下降, 最大吸收峰波长微小蓝移, 表面Trp微环境变得更疏水, 荧光强度显著下降可能归因于: (1)解离的Tyr残基荧光消失, 且Trp残基的荧光可能被阴离子状态的Tyr残基猝灭; (2)溶剂猝灭效应; (3)也可能是Lys和Arg残基的正电荷被中和[2, 14]。 本试验在高pH值条件下荧光峰出现蓝移, 在低pH条件下荧光峰出现红移, 并暴露出更多芳香族氨基酸残基于亲水环境中, 与藜麦蛋白质分离[14]和麻仁球蛋白的行为类似[6]。
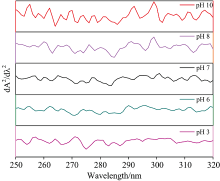
由图6可知, pH值由7.0到3.0时, 紫外吸收强度先减小后增大, 在250, 270和285 nm附近出现新的吸收峰, 并伴随着红移, 且290 nm以后的吸收峰逐渐削弱; 该变化趋势与荧光光谱反映出的现象基本一致。 在pH 3.0时, 紫外二阶导数光谱峰信号和峰型与pH 7.0现象相比变化显著, 峰吸收强度增大, 且发生红移, 表明低pH条件下HPI结构得到适当舒展, Phe和Tyr残基的微环境变得更亲水, 在270 nm出现的峰是Tyr残基特征峰, 可能与Tyr上的酚羟基电离后酚氧原子与苯环的大π 键的共轭效应有关; 在250 nm附近出现新的峰是Phe的特征峰, 这可能是由于Phe残基之间的相互作用被减弱, 同时Tyr残基的吸收红移, 使得原本被掩盖的Phe残基特征峰显露出来。 由此推测酸诱导HPI变性时, HPI分子结构得到适当舒展, 使得更多疏水性氨基酸残基暴露于微环境中。
在pH由7.0到10.0时, 紫外二阶导数光谱峰型也发生显著变化, 紫外吸收增强且伴随着蓝移, 而研究认为在三种发色氨基酸中, Phe是疏水性最强的, pH变化基本不会引起其电离度和质子化的变化; 引起这一变化主要可能是强碱条件下蛋白结构打开, Phe残基之间的相互作用减弱, 导致π → π * 能极差下降, 由此推测碱性条件下含有Phe残基的侧链柔性增强。
由图7可知, 在不同pH条件下, HPI粒径与天然态(pH 7.0)相比均增大, 天然态的HPI主要以单体形式存在[图2(a)], 在pH降低过程中, HPI粒径不断增大, pH 6.0时有最大平均粒径, 这是因为pH 6.0条件最靠近等电点, HPI表面电荷绝对值较低, 分子之间的排斥力减弱, 容易发生聚集形成大的聚集体。 pH 3.0条件下HPI粒径增大是因为强酸条件蛋白结构变得松散, 肽链展开(图5和图6), 且蛋白表面正电势增大, 分子间的排斥力增大, 抑制了分子之间的聚集, 但一定程度上促进了线性多聚体的产生, 从而提高蛋白溶解度[15]。 在pH增大过程中, 蛋白粒径逐渐增大; pH 8.0时, 粒径主要分布在10~11和50~60 nm范围, 保持了大部分单体。 在pH 10.0时, 粒径进一步增大, 可能是因为蛋白结构舒展后, 形成更多的单体分子形成线性聚集体。
由图5— 图7可知, 在强酸强碱条件下, 能使HPI分子结构得到适当伸展, 粒径变大, 使得芳香族氨基酸残基之间的距离增大, 降低了Phe到Tyr和Trp的能量传递效率, 最终导致Try残基荧光强度减弱, Phe和Tyr残基的荧光部分被显示, 表明在强酸强碱pH条件下HPI溶解度得到改善。 从荧光光谱和紫外光谱的变化趋势可知, 在酸性条件下HPI的构象稳定性相对较差, 蛋白亚基容易发生解离缔合反应; 而在碱性条件下, HPI构象则相对稳定, 且HPI构象具有更大柔性, 这与大豆硒蛋白的构象类似[15]。 因此借助荧光光谱和紫外二阶导数光谱, 可以推测HPI氨基酸残基微环境的变化, 从而了解蛋白质分子三维结构的变化信息。
汉麻分离蛋白与大豆分离蛋白相比, 其分子构象存在很大差异, 分子内含有更多的二硫键, 圆二色谱和傅里叶红外光谱检测结果显示HPI含有更多的α -螺旋结构; 荧光光谱和紫外光谱结果显示HPI分子表面分布更多的芳香族氨基酸, 增大表面疏水性, 具有紧凑的三级结构。 在强酸强碱条件下, 能使HPI分子结构得到适当伸展, 粒径变大, 使得芳香族氨基酸残基之间的距离增大, 降低了Phe到Tyr和Trp的能量传递效率, 导致Try残基荧光被屏蔽强度减弱, Phe和Tyr残基的荧光部分被显示。 相对而言, 在酸性条件下HPI的构象稳定性相对较差, 蛋白亚基容易发生解离缔合反应; 而在碱性条件下, HPI构象则相对稳定, 且构象灵活性更大。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|