作者简介: 梁昊岳, 1987年生, 中国医学科学院血液病医院(中国医学科学院血液学研究所)卫生主管技师e-mail: lianghaoyue@ihcams.ac.cn
急性白血病的诊断基于一系列检测方法, 细胞遗传学和荧光原位杂交方法旨在鉴定涉及白血病发生过程的特定基因和染色体改变, 通过流式细胞术和分子生物学进行的免疫表型分析也是目前可用于明确诊断的检查手段。 这些检查的侵入性和时效性方面的不足促使人们寻找以拉曼光谱技术为代表的新的方法和技术, 以减少假设和诊断结论之间的时间间隔, 有利于患者获得更好的预后。 拉曼光谱技术可用来非标记识别血液中存在的血细胞和生化元素的光谱信息, 例如氨基酸、 蛋白质、 脂质、 核酸和类胡萝卜素, 并且该技术在使用细胞系、 血涂片和血清样本进行的不同类型血液学疾病的诊断中变得愈为重要, 具有广阔的应用前景。 实验研究了人急性T细胞白血病细胞系(Jurkat)、 人急性骨髓性白血病细胞系(KG-1α)、 人急性早幼粒细胞白血病细胞系(NB4)和人急性单核细胞白血病细胞系(THP-1)的拉曼光谱特征, 建立使用拉曼光谱非标记鉴别四种白血病细胞系的新方式, 为临床实验研究提供科学基础。 分别培养并收集四种急性白血病细胞系细胞, 使用Horiba Xplora拉曼光谱仪获取拉曼光谱, 每种细胞系捕获25~30个白血病细胞光谱。 联合运用主成分分析法、 偏最小二乘判别分析和聚类分析等光谱分析方法, 对四种细胞系细胞的光谱展开深入分析和建立鉴别模型, 联合两两组合分析, 对细胞光谱进行甄别。 四种细胞的拉曼光谱具有差异, 主要通过769, 826, 844, 957, 1 048, 1 141, 1 255, 1 313, 1 415, 1 539和1 575 cm-1等峰位进行区分, 反映了jurkat细胞活跃的增殖代谢, KG-1α细胞活跃的与核酸相关的能量代谢以及NB4细胞较强的细胞呼吸等生物学信息。 结果表明: 依据PLS-DA建立的拉曼光谱辨别模型能准确甄别四种急性白血病细胞, 模型具有良好的拟合稳定性、 预判能力和应用前景。
The diagnosis of acute leukemia is based on a series of essays. Cytogenetics and fluorescence in situ hybridization are designed to identify specific genes and chromosomal changes involved in the development of leukemia. Immunophenotypic analysis by flow cytometry and molecular biology is also present. It can be used to check the diagnosis. The invasiveness and timeliness of these tests prompted people to look for new methods and techniques, represented by Raman spectroscopy, to reduce the time interval between hypotheses and diagnostic conclusions, and to help patients achieve good prognosis. Raman spectroscopy can be used to non-label identify spectral information of blood cells and biochemical elements present in the blood, such as amino acids, proteins, lipids, nucleic acids, and carotenoids, and the technique is performed using cell lines, blood smears, and serum samples. The diagnosis of different types of hematological diseases becomes more and more important and has broad application prospects. This experiment investigated the Raman spectral characteristics of human acute T cell leukemia cell line (Jurkat), human acute myeloid leukemia cell line (KG-1α), human acute promyelocytic leukemia cell line (NB4) and human acute monocytic leukemia cell line (THP-1), build a novel Raman label-free method to distinguish four kinds of acute leukemia cells, and provide the basis for clinical experimental research. Raman spectra were obtained using Horiba Xplora Raman spectrometer, and Raman spectra of 25~30 cells from four kinds of acute leukemia cell line were recorded. Spectral analysis methods, including principal component analysis, partial least squares discrimination analysis and cluster analysis were used to build the discrimination model and classify the spectra of leukemia cells. There were differences among Raman spectra of acute leukemia cells, which were distinguished primarily by peaks in 769, 826, 844, 957, 1 048, 1 141, 1 255, 1 313, 1 415, 1 539, 1 575 cm-1, which reflects the active metabolism of Jurkat cells, the nucleic acid-related energy metabolism of KG-1α cells, and the strong cellular respiration of NB4 cells. The identification models built by PLS-DA can accurately distinguish these Raman spectra of different acute leukemia cell lines. The model has good fitting stability, predictive ability and application prospect.
急性白血病是指原始的造血细胞, 尤其是白细胞以克隆、 不受控制和自主的方式遭受恶性转化, 并伴随它们的功能、 形态和成熟顺序上的改变而引起的一种恶性肿瘤。 常按形态分为髓细胞和淋巴细胞白血病两大类。 白血病的诊断基于一系列测试, 从血细胞计数筛查开始, 能够评估血细胞, 然后进行更具侵入性的脊髓造影检查, 分析相关的血管内细胞[1, 2]。 这些形态学化验不足以进行准确的诊断, 因此, 临床医生要求进行更复杂的实验室检查, 例如流式细胞术和细胞遗传学检查, 以便进行确凿的诊断[3, 4]。 然而, 这些检查方法对细胞样本具有侵入性且耗时较长, 因此, 探索一种新型白血病细胞鉴别方法具有重要的科研和临床意义。
拉曼光谱是一种新型光学技术, 能够识别与病理状况相关的生物组织和液体的生化变化, 诊断血清中的阿尔茨海默症以及体外定量人体血液和血清成分等。 拉曼效应是基于可极化分子对入射激光的非弹性散射, 有着提供不同材料的振动能级的详细信息的强大能力。 Vanna等通过拉曼光谱技术鉴定正常和白血病细胞[5], Ehlicke等鉴别了间充质干细胞和软骨细胞的不同光谱特征[6]。 Hobro等应用拉曼光谱来提供有关不同淋巴细胞的细胞系组成的生化信息。 虽然拉曼光谱法测量的淋巴细胞系之间的生化差异很小, 但结合偏最小二乘判别分析, 不仅可以区分T细胞和B细胞, 而且可以区分单个T细胞和B细胞系[7, 8]。
当被应用于血液及肿瘤疾病的诊断时, 拉曼光谱技术具有诸如体内使用的可能性、 快速性, 不需要试剂或染料来揭示组织生化信息, 以及使用少量样品非破坏性地获得诊断等优势[9]。 本实验使用拉曼光谱技术对人急性T细胞白血病细胞系(Jurkat)、 人急性骨髓性白血病细胞系(KG-1α )、 人急性早幼粒细胞白血病细胞系(NB4)和人急性单核细胞白血病细胞系(THP-1)展开研讨, 获取拉曼光谱数据, 通过光谱分析软件建立区分四种细胞系的方法。 同时, 探讨拉曼光谱特征, 以期为四种急性白血病细胞的早期鉴别诊断提供一种新方式。
细胞系Jurkat、 NB4用RPMI 1640 培养液(含10%胎牛血清), 在37 ℃饱和湿孵箱中培养。 细胞系KG-1α 用Iscove’ s Modified Dulbecco’ s培养液(含20%胎牛血清), 在37 ℃孵箱中培养。 细胞系THP-1用含10%胎牛血清和终浓度0.05 mmol· L-1 2-mercaptoethanol的RPMI 1640培养液, 在37 ℃饱和湿孵箱中培养。
将培养的细胞系细胞借助甩片机Cytospin4涂于石英玻片上, 做成待测样本。 实验选用共聚焦拉曼光谱仪XploRA Raman microscope对目的细胞展开检测。 选取785 nm激光作为激发光, 输出功率为40 mW, 物镜选取40倍, 拉曼光谱记录波数范围为600~1 800 cm-1, 标本固定在XYZ三维平台上, 在镜下随机选取一个白血病细胞系细胞进行拍摄, 拍摄过程使用× 40 0.75 NA尼康镜头, 样品上约2× 2 μ m的光斑大小范围接收输出功率为40 mW的激光束照射, 每种急性白血病细胞系捕获25~30个细胞光谱数据, 每个细胞扫描累积时间为250 s, 分辨率为1 cm-1。 应用Labspec6软件进行平滑、 去背景和基线校正等数据处理, 全部光谱以各自的1 450 cm-1拉曼峰为内标完成了强度归一化。
采用SIMCA-P应用软件对四种白血病细胞系细胞进行主成分分析、 偏最小二乘判别分析和聚类分析, 建立四种急性白血病细胞鉴别模型。 所有数据操作使用Origin软件进行。
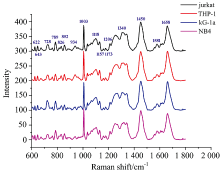
本研究共获得急性白血病细胞系细胞拉曼特征光谱113例, 其中jurkat细胞29例, THP-1细胞29例, kG-1α 细胞30例, NB4细胞25例(图1)。 细胞光谱的拉曼峰位归属见表1。 在600~1 800 cm-1的范围内可见四种白血病细胞拉曼光谱, 形态相似, 可以充分地反映出不同种白血病细胞内物质的含量、 组分。
| 表1 细胞拉曼光谱的峰位归属 Table 1 Molecular structure and composition of Raman peaks |
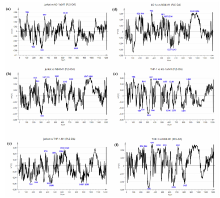
从4类细胞拉曼光谱结果中随机抽取40张特征光谱(每类10张), 构成四组数据资料。 对样本数据分析应用有监督主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)展开详细分析比照。 图2表明运用有监督的PCA和PLS-DA方法可以很好地甄别jurkat, THP-1, kG-1α 和NB4细胞的光谱数据。 PLS-DA模型质量参数R2X=0.434, R2Y=0.863, Q2=0.693, 模型质量参数表示该模型归纳了第一、 第二两种主成分整体信息的43.4%, 概括了因变量86.3%的变异信息, 预估精确度为69.3%。 PCA模型质量参数R2X=0.589, Q2=0.274。 PLS-DA比PCA更好地捕捉了光谱中的差异信息, 样本之间的区分度更好, 分群效果更加显著。 图3所示四种细胞使用PCA和PLS-DA得到的得分、 载荷和聚类结果比较情况, 可知PLS-DA对四种白血病细胞系具有更好的鉴别效果。 四种细胞主要通过769, 826, 844, 957, 1 048, 1 141, 1 255, 1 313, 1 415, 1 539和1 575 cm-1等峰位进行区分[图3(d)]。
为进一步验证四种细胞的谱峰差别, 比较两种分析模型的差异, 将四种细胞两两组合进行有监督PCA并分析拟合参数情况。 如图4、 图5所示, 四种细胞被两两成功区分, PCA拟合参数如表2所示。 PCA模型的R2X参数值处于0.43~0.581区间范围内, 表示模型对光谱数据信息具备一定概括能力; 但Q2参数值处于0.093 6~0.163区间范围内, 表示模型可预估精确程度低, 模型的总体效果不甚理想。
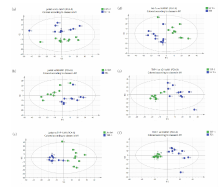 | 图4 四组细胞两两组合PCA二维得分图Fig.4 Two-dimentional score figure for PCA model from two combinations of the four groups |
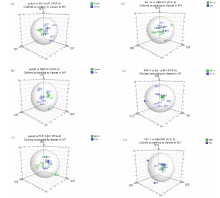 | 图5 四组细胞两两组合PCA三维得分图Fig.5 Three-dimentional score figure for PCA model from two combinations of the four groups |
| 表2 四组细胞两两组合PCA模型质量参数 Table 2 Model quality parameter for PCA model from two combinations of the four groups |
按前文所述方法将四种细胞两两组合进行PLS-DA并分析拟合参数情况。 如图6、 图7所示, 四种细胞被两两成功区分, PLS-DA拟合参数如表3所示。 模型R2Y处于0.91~0.996区间范围内, Q2参数值处于0.706~0.94区间范围内, 表明该模型能描述因变量的变异信息和模型可预估精确程度很理想, 基本满足四种白血病细胞两两区分的辨别要求。 Jurkat vs THP-1和 KG-1α vs NB4两个组合中模型R2X参数值较低, 可能是由于这两组中两类细胞的光谱相似性较高, 需要更多的主成分来表征它们的信息内容, 因此模型概括第一、 第二主成分的信息比重较少。
 | 图6 四组细胞两两组合PLS-DA二维图Fig.6 Two-dimentional score figure for PLS-DA model from two combinations of the four groups |
 | 图7 四组细胞两两组合PLS-DA三维图Fig.7 Three-dimentional score figure for PLS-DA model from two combinations of the four groups |
| 表3 四组细胞两两组合PLS-DA模型质量参数 Table 3 Model quality parameter for PLS-DA model from two combinations of the four groups |
通过载荷分析, jurkat细胞在708, 957和1 243 cm-1峰高于KG-1α 细胞, 在789和920 cm-1峰低于KG-1α 细胞[图8(a)]。 jurkat细胞在826, 842, 957, 971, 1 155, 1 243, 1 313, 1 547和1 596 cm-1峰高于NB4细胞, 在920 cm-1峰低于NB4细胞[图8(b)]。 jurkat细胞在966, 1 118, 1 206, 1 230和1 240 cm-1峰高于THP-1细胞, 在759, 842, 1 031, 1 050, 1 485和1 538 cm-1峰低于THP-1细胞[图8(c)]。 KG-1α 细胞在826, 844, 962, 1 119, 1 155, 1 206, 1 548和1 596 cm-1峰高于NB4细胞, 在1 227和1 243 cm-1峰低于NB4细胞[图8(d)]。 THP-1细胞在708, 842, 957, 1 031, 1 050, 1 155, 1 240和1 485 cm-1峰高于KG-1α 细胞, 在789, 826, 920, 966, 1 206, 1 258和1 415 cm-1峰低于KG-1α 细胞[图8(e)]。 THP-1细胞在826, 844, 957, 1 050, 1 155和1 313 cm-1峰高于NB4细胞, 在920, 1 258和1 415 cm-1峰低于NB4细胞[图8(f)]。 归纳上述两两组合载荷分析得知, jurkat细胞的羟基磷灰石/类胡萝卜素/胆固醇(957 cm-1)含量高于其他细胞, 且蛋白(1 243 cm-1)含量较高, 反映了淋巴细胞活跃的增殖代谢; KG-1α 细胞的核酸(789 cm-1)、 葡萄糖/乳酸(920 cm-1)和羟脯氨酸/酪氨酸(1 206 cm-1)含量高于其他细胞, 且羟基磷灰石/类胡萝卜素/胆固醇(957 cm-1)含量较低, 反映了其活跃的与核酸相关的能量代谢; NB4细胞的葡萄糖/乳酸(920 cm-1)含量较高, 且核酸(826 cm-1)、 胶原/脂质(1 313 cm-1)、 羟基磷灰石(962 cm-1)和蛋白(1 155和1 548 cm-1)含量少于其他细胞, 反映了其可能存在较强的细胞呼吸; THP-1细胞的羟基磷灰石/类胡萝卜素/胆固醇(957 cm-1)含量较高, 且核酸(1 415 cm-1)含量少。
运用前文所述方法从4类细胞拉曼光谱结果中随机抽取40张特征光谱(每类10张), 组合而成四组数据资料。 由图9、 图10可知, PCA模型下特征光谱聚类分析存在偏差, 部分分组中两类细胞被区分为两类以上结果。 相比之下, PLS-DA模型下聚类分析能很好地将四种细胞特征光谱两两区分, 准确度可达100%。
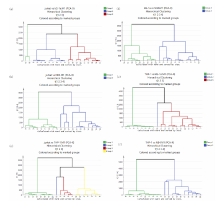 | 图9 四组细胞两两组合PCA模型下聚类分析图Fig.9 Dendrogram of cluster analysis from two combinations of the four groups using PCA |
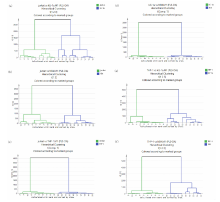 | 图10 四组细胞两两组合PLS-DA模型下聚类分析图Fig.10 Dendrogram of cluster analysis from two combinations of the four groups using PLS-DA |
外周血白细胞分析是血液系统疾病诊断检查中的关键步骤, 并且通常需要分子标记。 只有详细的表型分析才能识别细胞的特定病理阶段, 如白血病。 细胞的固定和化学染色对于提供对细胞生化特性的更深入了解是必要的, 然而, 这种标记方法不允许科研人员研究其生理生化状态下的细胞行为。 拉曼光谱技术以其非标记无损检测的优势, 弥补了流式细胞术、 免疫组化、 细胞遗传学和分子生物学对白血病细胞分析方法的不足, 提供了一种操作简便、 价格低廉的白血病细胞生物学信息的表征方式。 本研究的目的是使用拉曼光谱技术鉴别来自四种不同白血病细胞系的白血病细胞的光谱差异, 并使用这些差异来区分这四种细胞。
采用PCA与PLS-DA特征光谱分析相比较的方法, 鉴别不同的急性白血病细胞。 虽然这些分析技术借助视觉上可描述的分数图提供了复杂数据集的低维表示, 但是从分数图中推测显微拉曼技术所展示的细胞生物学相关结论, 还需依靠科研工作者的的主观检验。 在上述化学计量学方法基础上, 聚类分析佐证了PLS-DA方法的可行性和稳定性。
综上, 共聚焦显微拉曼光谱技术与PCA、 PLS-DA和聚类分析等特征光谱分析方法紧密结合, 可以科学检测四种急性白血病细胞内生物大分子结构、 组分及含量的差异, 并可以以这些差别为依据鉴别不同类型的急性白血病, 具有深远的科研和临床意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|