作者简介: 王 东, 1990年生, 中国林业科学研究院木材工业研究所博士研究生 e-mail: wangrookie@163.com
应压木的适应性生长导致了针叶树木材化学性质发生变化, 其中微纤丝角的变大主要引起木材主要化学组分变形机制发生了变化, 影响其力学性质。 以马尾松应压木和正常材为研究对象, 通过傅里叶变换红外光谱对比研究应压木和正常材在拉伸过程中木材主要化学组分官能团的变化规律差异, 对研究应压木力学性能变化的分子响应机制具有重要意义。 结果表明: 应压木的微纤丝角为35.17°±2.30°, 而正常材为15.15°±1.61°; 应压木和正常材的顺纹抗拉强度分别为(45.37±3.41)和(109.75±11.87) MPa, 弹性模量分别为(18.10±0.76)和(70.95±6.60) MPa, 但应压木的屈服变形大于正常材, 破坏点的应变值约为正常材的3倍。 傅里叶变换红外光谱结果表明: 应压木和正常材纤维素中糖苷键C—O—C(1 161 cm-1)和纤维素分子内氢键O(3)H…O(5)(3 348 cm-1)的红外吸收特征峰波数都随拉伸应变发生线性变化。 其中, 应压木中纤维素的糖苷键C—O—C向低波数偏移量为-1.52 cm-1·dε-1, 而正常材的苷键偏移量为-2.15 cm-1·dε-1; 应压木中纤维素分子链内氢键O(3)H…O(5)的波数向高波数偏移量为4.62 cm-1·dε-1, 而正常材纤维素分子链内氢键偏移量为2.76 cm-1·dε-1。 应压木纤维素的糖苷键向低波数的偏移量、 纤维素分子链内氢键向高波数的偏移量均小于正常材, 但两者木质素和半纤维素特征官能团的红外吸收特征峰波数没有明显偏移。 根据应压木和正常材拉伸过程中的主要化学组分响应规律, 纤维素依然作为应压木在拉伸过程中的承载物质, 而基体的主要作用是应力传递; 但微纤丝排列重新取向; 与正常材相比, 应压木中较大的微纤丝角会导致纤维素分子链长度方向的变形较小, 但微纤丝与基体之间的剪切变形会较大。 这也导致了应压木在拉伸过程中会发生较大的屈服变形, 破坏点的应变大于正常材。
The adaptive growth of compression wood (CW) leads to the changes of chemical properties of coniferous wood, which the change of microfibril angle (MFA) affects the wood mechanical properties and macromolecular deformation. In this paper, the Fourier transform infrared spectroscopy (FTIR) was explored together with mechanical loading as a means of studying the molecular responses to the loading of Masson pine CW and normal wood (NW). It is of great significance to study the molecular biological mechanism of the mechanical properties changes of the CW. The results indicated that the MFA, tensile strength along grain and modulus of elasticity of the CW were 35.17°±2.30°, (45.37±3.41) and (18.10±0.76) MPa, respectively, and were 15.15°±1.61°, (109.75±11.87) and (70.95±6.60) MPa of the NW. What is more, the strain at the break-point of the CW was three times than that of the NW. The FTIR results indicated that the wavenumber shifts of the FTIR bands at 1 161 and 3 348 cm-1 showed an approximately linear relationship with strain. The C—O—C of cellulose at 1 161 cm-1 band shifted to lower wavenumber with tensile strain increase, and shift rate was 2.15 and 1.52 cm-1·dε-1 for the CW and NW, respectively. Furthermore, the O(3)H…O(5) of cellulose intramolecular 3 348 cm-1 bands shifted to higher wavenumber, and shift rate was 4.62 and 2.76 cm-1·dε-1 of the CW and NW, respectively. The shift rates of 1 161 and 3 348 cm-1 bands of NW were more than that of CW. However, the characteristic peaks of lignin and hemicellulose were shown not to be affected. The above results indicate that the cellulose mainly provides the strength of the wood and the matrix of hemicellulose and lignin is benefited to load transform between cellulose microfibrils. Compared with the NW, the larger orientation of microfiber of the CW leads to smaller tension deformation along the direction of cellulose molecular chain, but the larger of shear deformation between microfibrils and matrix. This also leads to a large yield deformation in the tensile process of the CW, and the strain of the failure point is greater than the NW.
应压木是针叶树受到立地条件、 风或其他外力等刺激后, 木材发生适应性生长, 大量管胞积累在倾斜树干或枝的下端, 形成的一种特殊结构木材[1]。 应压木的适应性生长会对木材的主要化学组分(纤维素、 半纤维素和木质素)性质产生影响[2, 3, 4]。 如: 木质素含量偏高, 取向程度大于正常材; 纤维素含量和结晶度降低, 纤维素的排列取向也发生变化, 应压木的微纤丝角在30° ~45° 之间, 大于正常材; β -1, 4-半乳糖含量增加, 木聚糖和葡甘露聚糖含量较少。 此外, 应压木微纤丝角的变化会直接影响其力学性能。 如: 应压木的顺纹抗拉强度小于正常材, 但拉伸过程中会产生较大的屈服变形[5]。 这些力学性质变化主要和应压木微纤丝角变大有关, 因此研究应压木拉伸过程中主要化学组分的响应机制, 对分析应压木力学性质具有重要意义。
通过傅里叶变换红外光谱研究材料在拉伸过程中的化学组分官能团变化规律。 与传统的静态傅里叶变换红外光谱相比, 该方法将为研究材料化学结构取向、 交联以及变形机理提供一种重要的手段。 该方法在木材上的主要应用是研究木材化学组分的结构取向和大分子对载荷的响应规律[6, 7], 当正常木材纵向拉伸时纤维素分子链中糖苷键(1 161 cm-1)和纤维素分子链内氢键(3 348 cm-1)键角变大, 红外特征峰分别向低波数和高波偏移, 但木质素骨架C=O(1 510 cm-1)或半纤维素(木聚糖乙酰基CH3C=O, 1 732 cm-1)的红外特征峰未见明显变化[6, 7], 其结果表明: 正常木材中纤维素作为主要的承载物质, 而基体(半纤维素和木质素)主要起传递应力的作用。 所以本文主要通过傅里叶变换红外光谱研究应压木在拉伸过程中木材主要化学组分的响应机制, 分析应压木因化学性质变化而引起的力学性质变化机理。
马尾松(Pinus massoniana)应压木(compression wood, CW)采伐于广西南宁武鸣区南宁市林业科学研究所示范林, 造林时间2012年, 胸径13 cm, 树高8.1 m, 活枝下高3.9 m。 选择弯曲曲率最大部分的应压木, 并截取其受拉一侧第4个年轮的早材作为实验材料, 基本密度(0.58± 0.04) g· cm-3。 正常材(normal wood, NW)选择同一批造林的马尾松木材的第4个年轮早材, 基本密度(0.32± 0.06) g· cm-3。
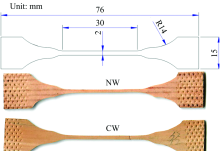
为了减小斜纹理和早晚材差异对木材顺纹拉伸过程中应变的影响, 实验采用纹理通直的径切面试件。 试样如图1所示, 试样设计为哑铃状, 试件厚度1 mm, 颈部宽度2 mm, 颈部全为早材。 采用小量程微型力学试验机(Instron 5848 Crop, USA, 最大量程2 000 N), 加载速度0.15 mm· min-1。 为确保木材具有较大的应变范围, 使得木材微纤丝与半纤维素之间产生较大的剪切变形以及较大的微纤丝取向, 调节试样含水率至纤维饱和点, 即27.60%。 应压木和正常材各测试10个有效样品, 计算平均顺纹抗拉强度, 破坏点应变以及弹性模量。
采用傅里叶变换红外光谱(VERTEX 70/80 system, BRUKER)比较不同纵向拉伸应变下的木材红外谱图变化, 从而研究应压木顺纹拉伸过程中化学组分官能团变化规律, 分析大分子的变形机理。 不同纵向拉伸应变通过拉伸附件(A555/Z, BRUKER)的螺旋测微计实现。 为得到稳定的红外光谱信号和有效地识别拉伸过程中大分子的特征官能团吸收峰变化, 设置样品和背景的扫描次数为32, 波数分辨率为1 cm-1。 傅里叶变换红外光谱完成一次完整的扫描时间为40 s, 此时载荷依然保持原有最大载荷的90%以上, 所以红外测试过程中忽略试样松弛产生的实验误差。 谱图波数范围为4 000~600 cm-1, 选择1 800和750 cm-1这两个点对红外谱图线性基线校准。 试样要求为15 mm(T)× 20 mm(L)× 30 μ m(R)的薄片。
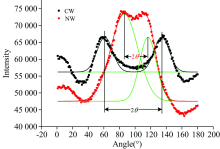
利用X射线衍射仪(Xpert PRO多晶型X射线衍射仪, PANalytical)分别测试应力木和正常材的微纤丝角。 实验选择标准的弦切面, 大小为20 mm(L)× 10 mm(T)× 1 mm(R)。 主要参数设置为: 2θ =22.14° , 电压40 kV, 电流40 mA, 扫描步进1.0° , 试样旋转角度0° ~360° 。 木材试样的X-ray吸收强度随试样的旋转角度变化如图2所示, 试样的微纤丝角度为相邻两个吸收峰之间角度(2θ )的1/2。 如图2所示, 首先用Origin 8.5对X-ray吸收强度曲线对进行双峰高斯拟合(R2> 0.9), 然后测木材微纤丝角, 应力木和正常材各取10个样品计算平均微纤丝角。
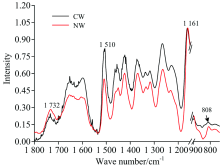
马尾松应压木和正常材中纤维素、 半纤维素(木聚糖和葡甘露糖)以及木质素的傅里叶变换红外光谱图(图3)。 在1 161 cm-1位置处进行归一化处理, 谱图中木质素和半纤维素的特征峰吸收强度分别表示木质素和半纤维素相对纤维素的含量。 从图3中可以看出马尾松应压木中木质素和葡甘露糖相对纤维素的含量大于正常材, 但木聚糖含量小于正常材。 X-ray结果表明: 马尾松应压木的微纤丝角为35.17° ± 2.30° , 而正常材为15.15° ± 1.61° (见图2), 马尾松应压木微纤丝角大于正常材。
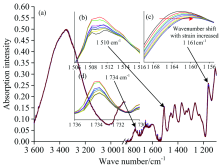
图4(a)表示马尾松木材不同应变范围内的傅里叶变换红外光谱。 纤维素分子链内糖苷键C— O— C[1 161 cm-1, 图4(c)]的特征峰向低波数发生明显的位移, 该结果与相关研究类似[6, 7]。 其中, 应压木的应变从0增加到0.83%时, 纤维素分子链内糖苷键C— O— C的特征峰向低波数偏移量为1.1 cm-1, 但对正常材, 应变范围从0增加到0.85%时, 纤维素分子链内糖苷键C— O— C的特征峰向低波数偏移量为1.9 cm-1。 纤维分子链中的糖苷键C— O— C向低波数移动意味着键角变大, 参与振动吸收的C— O— C共价键的长度增加, 共价键的力常数减小[8]。 表明木材受到纵向拉伸时, 纤维素分子链在长度方向上发生了变形。 如图5所示, 通过线性拟合结果表明: 应压木和正常材纤维素的C— O— C特征峰波数偏移都与木材应变呈现较好的线性相关性, 在95%的置信区间内线性回归检验决定系数R2大于0.8。 应压木纤维素糖苷键特征峰的偏移量为-1.52 cm-1· dε -1, 而正常材的偏移量为-2.19 cm-1· dε -1, 应压木纤维素中糖苷键向低波数的偏移量小于正常材。
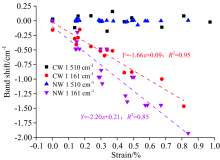 | 图5 应压木和正常材纤维素C— O— C糖苷键和木质素C=O骨架特征峰波数变化Fig.5 The wavenumber changes of the C— O— C of cellulose and C=O of lignin skeleton numberwave with the strain increase of the CN and NW samples |
纤维素分子链内氢键O(3)H…O(5)的红外特征峰波数范围为3 340~3 375 cm-1[9, 10]。 因为该羟基特征峰受水分影响较大, 峰宽比较大, 所以为了准确找到该羟基特征峰位置, 对3 600~3 200 cm-1之间的吸收谱图进行高斯单峰拟合, 决定系数R2大于0.99。 结果表明: 马尾松应压木和正常材纵向拉伸时, 纤维素分子链内氢键特征峰(3 348 cm-1)向高波数发生明显偏移(图6), 主要因为纤维素分子链拉伸变形时, 分子链内氢键O(3)H…O(5)变弱, 而O(3)H吸收强度变大[6, 7]。 如图6所示, 通过线性拟合结果也表明应压木和正常材的纤维素分子链内氢键特征峰波数偏移与木材的应变呈现较好的线性相关, 在95%的置信区间内线性回归检验决定系数R2正常材为0.91, 应压木为0.75。 应压木中纤维素分子链内部氢键特征峰波数偏移量为2.76 cm-1· dε -1, 而正常材偏移量为4.62 cm-1· dε -1, 应压木也小于正常材。 正常材和应压木的木质素骨架 [C=O, 1 510 cm-1, 图4(b)和图5]和半纤维素中木聚糖乙酰基 (CH3C=O, 1 734 cm-1)的特征吸收峰都未检测到明显的波数变化[图4(d)]。
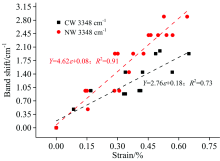 | 图6 应压木和正常材纤维素分子链内氢键特征峰波数变化Fig.6 The wavenumber changes of the — OH of cellulose intramolecular numberwave with the strain increase of the CN and NW samples |
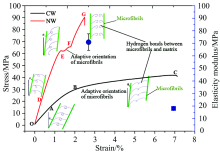
根据针叶材细胞壁三大素的交联结构[11, 12, 13], 木质素和半纤维素作为基体材料, 半纤维素主要通过氢键连接纤维素和木质素, 并且桥接了两个相邻的微纤丝[14, 15]。 图7曲线表示不同微纤丝角木材细胞壁纵向拉伸时纤维长度方向上的应力分量(σ F)与垂直纤维长度方向上的应力分量(σ M)的比值, 即微纤丝角余切值。 如图7所示, 细胞壁层在纵向拉伸过程中的变形主要包括了纤维素分子链长度方向上的拉伸变形(ε 1), 基体与微纤丝之间剪切滑移(ε 12)以及垂直于纤维长度方向上的变形(ε 2)。 根据上述应压木和正常材拉伸过程中木材主要成分的响应规律, 平行于纤维方向上的应力主要引起纤维素分子内糖苷键以及分子内氢键的键角变大, 纤维素聚合物链发生线性变化[16]。 但应压木的纤维素糖苷键以及分子内氢键变化小于正常材, 其主要原因是应压木在纤维方向上的应力分量相比正常材小。 此外, 应压木和正常材的木质素和半纤维素在拉伸过程中基体的骨架或者主分子链未发生明显变化, 但这并不意味着木质素和半纤维素在拉伸过程未发生变形[6, 7]。 因为当木材细胞壁受到纵向拉伸时, 微纤丝之间通过纤维素与基体之间氢键的“ molecular Velcro” 机制允许基体与微纤丝之间发生剪切滑移(ε 12)[14, 15, 16, 17], 微纤丝发生适用性取向, 重新排列。
图8表示马尾松应压木和正常材的顺纹拉伸应力-应变曲线, 马尾松应压木和正常材的顺纹抗拉强度分别为(45.37± 3.41)和(109.75± 11.87) MPa, 弹性模量分别为(18.10± 0.76)和(70.95± 6.60) MPa, 但应压木破坏点的应变约为正常材的3倍。 如图8所示, 应压木在拉伸过程中经历了弹性变形(OA段)、 屈服变形(AB段), 快速屈服变形(BC段), 而正常材变形过程主要包括了弹性变形(OD段)、 屈服变形(DE段)、 松弛阶段(EF)以及强化阶段(FG)。 应压木与正常材相比, 应压木沿微纤丝方向的应力分量约为垂直于微纤丝方向的应力分量小于正常材, 这导致了正常材的纤维素沿长度方向的变形ε 1较大(图7)。 此外, 当剪切滑移变形(ε 12)超过了微纤丝与半纤维素之间氢键容许变形量时氢键破坏, 微纤丝会发生适应性趋向(图7), 即微纤丝角减小[17]。 对于正常材, 当微纤丝与半纤维素之间完全剪切破坏时微纤丝角减小到最小时, 应力-应变曲线会出现一个平台区域(图8EF段), 木材发生松弛现象; 当应变继续增加时木材出现明显的强化现象(图8FG段)。 应压木在剪切应变作用下也发生微纤丝的适应性取向[17], 但载荷-位移曲线中未表现出明显的强化现象。 并且应压木在拉伸过程中相比正常材会发生较大的屈服变形, 其主要原因是应压木中较大的微纤丝取向导致微纤丝和基体之间会发生较大的剪切滑移变形(ε 12)。 应压木微纤丝与基体之间的剪切滑移变形大于正常材, 这也导致了应压木破坏点的应变大于正常材。
应压木和正常材的纤维素中糖苷链与分子链内氢键的红外吸收特征峰波数都随拉伸应变线性变化, 其中应压木纤维素的糖苷键向低波数的偏移量、 分子链内氢键向高波数的偏移量均小于正常材, 但两者木质素和半纤维素的特征官能团的红外吸收峰没有明显的波数偏移。 与正常材相比, 应压木中较大的微纤丝取向导致了纤维素分子链长度方向的变形较小, 但微纤丝与基体之间的剪切变形较大, 这也是应压木在拉伸过程中会发生较大的屈服变形, 破坏点的应变大于正常材的主要原因。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|